La fibrillazione atriale è l’aritmia sostenuta di riscontro più frequente in età avanzata. Studi di popolazione condotti in Europa hanno dimostrato, nel corso di quasi 13 anni di follow-up, una sua incidenza complessiva più alta negli uomini che nelle donne (6,4% vs 4,4%), con trend progressivamente crescente all’aumentare dell’età (1,2). Dopo i 50-60 anni, rispettivamente in uomini e donne, i nuovi casi di fibrillazione atriale sono sempre più numerosi, raggiungendo la massima incidenza oltre gli 80 anni (3). Negli ultratottantenni la prevalenza è di circa il 10%. Probabilmente, le migliori condizioni di cura, con il conseguente aumento della sopravvivenza dopo eventi clinici anche molto gravi, e la maggior attenzione alla diagnosi di aritmia, hanno comportato, in un breve arco temporale, il rapido incremento dei nuovi casi di fibrillazione atriale, particolarmente oltre i 75 e gli 85 anni di età (2,4). In uno studio osservazionale in 21 paesi, il 9% circa degli ultraottantenni aveva fibrillazione atriale (5); in altri contesti, la prevalenza di aritmia in soggetti di età ≥85 anni cresceva addirittura al 23% (6). Ovviamente, questi dati di prevalenza non tengono conto delle forme non diagnosticate la cui rilevanza epidemiologica appare tutt’altro che trascurabile.
La particolare suscettibilità dell’anziano a sviluppare fibrillazione atriale è in parte da ricondurre ai fenomeni di rimodellamento elettrico e anatomico a livello atriale legati in parte alle modificazioni fisiologiche o “parafisiologiche” del miocardio atriale dovute alla senescenza stessa. Infatti, dal punto di vista anatomico, nel paziente anziano si osserva una progressiva e costante deposizione di tessuto amiloide in atrio, con conseguente perdita di elasticità e contrattilità del miocardio e dilatazione della cavità cardiaca (9). Dal punto di vista elettrico, invece, si verifica un diffuso rallentamento nella conduzione del potenziale elettrico e un aumento dei periodi refrattari dell’atrio associato ad una riduzione della frequenza di scarica del nodo del seno (10). Questi fenomeni involutivi, ovviamente, non sono sempre sufficienti ad innescare una fibrillazione atriale che, se così fosse, dovrebbe interessare tutti gli anziani. Invero, le succitate modificazioni del miocardio rappresentano per lo più condizioni predisponenti che vengono amplificate nelle loro potenzialità aritmogeniche dalla cronica esposizione nel corso della vita ai diversi fattori di rischio che amplificano significativamente il rischio di fibrillazione atriale connesso all’età quali l’eccedenza ponderale e la sindrome delle apnee ostruttive, l’ipertensione arteriosa, il diabete mellito e l’insufficienza renale. Le linee guida 2019 American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society (ACC/AHA/HRS) suggeriscono infatti il controllo dei fattori di rischio come primo intervento per la gestione della fibrillazione atriale sottolineando i benefici della perdita di peso nei pazienti con fibrillazione atriale e body mass index >27 kg/m2 (8). L’ipertensione, in particolare, aumenta considerevolmente il rischio di fibrillazione atriale sia negli uomini che nelle donne (9-13). Invero, la fibrillazione atriale rappresenta una sorta di mini-epidemia nell’ambito dell’ampia popolazione degli anziani ipertesi. Peraltro, l’ictus ischemico dovuto alla fibrillazione atriale è spesso particolarmente grave negli anziani ipertesi con un enorme impatto prognostico sia quoad valetudinem che quoad vitam e ricadute socio-economiche di vaste proporzioni (9-13). Non sorprende, quindi, che le linee guida raccomandino lo screening sistematico della fibrillazione atriale nelle popolazioni a rischio più elevato quali, appunto, gli anziani ipertesi (12,14). Non meno rilevante appare il rischio di fibrillazione atriale nei pazienti con patologia coronarica o scompenso cardiaco, problematiche cliniche di comune riscontro nella popolazione geriatrica (15). La malattia coronarica e la fibrillazione atriale spesso coesistono in ragione della condivisione dei principali fattori di rischio. L’ischemia miocardica, inoltre, può contribuire a fenomeni di rimodellamento e di dilatazione atriale che a loro volta aumentano il rischio di fibrillazione atriale e condizionano la prognosi in misura non trascurabile, creando un circolo vizioso di progressiva amplificazione del rischio (16,17). La fibrillazione atriale, infatti, è associata ad un aumentato rischio di infarto miocardico (risk ratio 1,54, C.I. 95% 1,26-1,85) (18) e l’infarto miocardico, a sua volta, si associa ad aumentato rischio di fibrillazione atriale (risk ratio 1,64, C.I. 95% 1,38-1,96) (19). I pazienti con infarto miocardico hanno un aumentato rischio di morte indipendentemente dal fatto che la fibrillazione atriale venga diagnostica prima (odds ratio 1,86) o concomitantemente all’infarto miocardico (odds ratio 1,37) (20). Ancora più stretta è la relazione tra fibrillazione atriale ed infarto miocardico con una reciproca influenza fisiopatologica principalmente dovuta a fenomeni di rimodellamento cardiaco (21). La fibrillazione atriale rappresenta uno dei principali determinanti delle riacutizzazioni di scompenso cardiaco e si associa ad una aumentata mortalità e morbilità (16,22,23). All’opposto, l’ottimizzazione della terapia medica dello scompenso cardiaco a ridotta frazione di eiezione è associata ad una riduzione del rischio di fibrillazione atriale (24-27).
L’impatto clinico della fibrillazione atriale è particolarmente rilevante nell’anziano. Il rischio di ictus ischemico nella popolazione con fibrillazione atriale, infatti, è 5 volte maggiore rispetto alla popolazione generale con una diretta responsabilità di questa aritmia su circa il 20% di tutti gli eventi ischemici cerebrali sintomatici, percentuale che nei pazienti anziani ultraottantenni sale al 25-30% (28,29). Non appare inutile sottolineare come la fibrillazione atriale rappresenti uno dei principali fattori di rischio per declino cognitivo e demenza nella popolazione geriatrica (2). Uno studio coreano condotto utilizzando un ampio database amministrativo, ad esempio, ha dimostrato una incidenza di demenza significativamente maggiore nei pazienti con fibrillazione atriale rispetto ai soggetti in ritmo sinusale, con un significativo incremento del rischio di malattia di Alzheimer anche nei soggetti senza storia di ictus. Lo stesso studio ha anche dimostrato un ridotto rischio di demenza nei pazienti con fibrillazione atriale di nuova insorgenza trattati con anticoagulanti orali (hazard ratio 0,61, CI. 95% 0,54-0,68) (30). Simili risultati sono stati prodotti anche da uno studio svedese che ha dimostrato un aumentato rischio di declino cognitivo e demenza nei pazienti con fibrillazione atriale ed una riduzione del 60% del rischio di demenza in corso di terapia anticoagulante nei pazienti con fibrillazione atriale sia incidente che prevalente (hazard ratio 0,40, CI. 95% 0,18-0,92) (31). Peraltro, la frequente coesistenza di comorbilità condiziona in modo non trascurabile la prognosi.
Quanto sopra esposto suggerisce l’opportunità di una precoce identificazione della fibrillazione atriale al fine di definirne l’approccio gestionale più adeguato in termini di controllo della frequenza cardiaca o del ritmo e di impostazione della terapia anticoagulante al fine di ridurre il rischio di ictus (Figura 1) (1). Lo screening opportunistico della fibrillazione atriale attraverso la palpazione del polso rappresenta l’approccio più seguito (32), ma la sua accuratezza diagnostica è piuttosto modesta, con una sensibilità pari a 0,87 ed una specificità pari a 0,81 (33). Invero, la fibrillazione atriale ha spesso carattere parossistico e, conseguentemente, può sfuggire alla singola rilevazione. Non di rado l’ictus embolico rappresenta l’evento con cui viene diagnosticata una fibrillazione atriale fino ad allora misconosciuta in ragione della sua sintomatologia modesta, se non del tutto assente. Per questo motivo le linee guida supportano l’uso di tecniche di monitoraggio per lo screening della fibrillazione atriale negli anziani ipertesi (12,14,34).
L’automisurazione domiciliare della pressione arteriosa, oltre a rappresentare da anni uno dei pilastri su cui poggia la gestione dell’ipertensione arteriosa (35,36), grazie all’introduzione in commercio di moderni strumenti automatici dotati di specifici algoritmi diagnostici che consentono di porre il sospetto di fibrillazione atriale nel corso della misurazione pressoria, rappresenta anche una preziosa opportunità per la identificazione della quota misconosciuta di fibrillazione atriale. Una meta-analisi di 6 studi finalizzati alla valutazione dell’affidabilità diagnostica della misurazione automatica della pressione arteriosa nell’identificazione della fibrillazione atriale ha evidenziato una sensibilità pari a 0,98 (intervallo di confidenza al 95% compreso tra 0,95 e 1,00) ed una specificità pari a 0,92 (intervallo di confidenza al 95% compreso tra 0,88 e 0,96) (37).
E’ evidente che l’utilità diagnostica dei dispositivi automatici per la misurazione della pressione arteriosa nell’individuazione della fibrillazione atriale è condizionata dalla validità degli algoritmi utilizzati. A questo riguardo è meritevole di menzione un recente studio condotto in 99 pazienti anziani (età media 70,2 anni) sottoposti simultaneamente a registrazione elettrocardiografica e a misurazione della pressione arteriosa con dispositivo automatico (Omron BP785N) provvisto di specifico algoritmo per la rilevazione di una possibile fibrillazione atriale. Questo studio ha dimostrato una accuratezza diagnostica dell’87,88% con una sensibilità del 100% ed una specificità dell’84,8% (38). La ricerca tecnologica ha reso oggi disponibili speciali manicotti – quali l’Intelli-wrap-cuff in dotazione con il misuratore automatico Omron M6 comfort-IT – in grado di misurare correttamente la pressione arteriosa senza risentire in modo significativo delle diverse misure di circonferenza brachiale. Queste speciale manicotto, peraltro, consente di rilevare la pressione in modo accurato senza essere condizionato ad un eventuale malposizionamento a livello del braccio, elemento che invece può determinare una non trascurabile variabilità delle rilevazioni pressorie quando si utilizzano i bracciali tradizionali.
Le Linee Guida ESC per la fibrillazione atriale sottolineano come per la diagnosi certa di fibrillazione atriale sia sempre necessaria la conferma elettrocardiografica, considerando la possibilità di utilizzare, oltre alla classica registrazione elettrocardiografica a 12 derivazioni, anche una registrazione elettrocardiografica a singola derivazione con un tracciato di almeno 30 secondi (39). Invero, anche dalla registrazione di una singola derivazione possono essere dedotte tutte le informazioni necessarie per individuare la presenza di fibrillazione atriale. Attualmente sono disponibili in commercio dispositivi di dimensione contenute, e quindi facili da portare con se, che interfacciandosi con una App dedicata consentono di ottenere una registrazione di 1 o 6 derivazioni elettrocardiografiche della durata di 30 secondi, adeguata, secondo quanto indicato dalle linee guida, per lo screening della fibrillazione atriale (39). A tale riguardo, i risultati dello studio AF-SMART, condotto in una popolazione di quasi duemila individui ultrasessantacinquenni seguiti in un contesto di primary care, mostrano come l’uso del dispositivo portatile per la registrazione elettrocardiografica KardiaMobile abbia consentito di individuare una fibrillazione atriale misconosciuta nell’1,1% dei soggetti sottoposti a screening (40). Meritevoli di attenzione anche i risultati di uno studio condotto da 133 medici di medicina generale canadesi che hanno effettuato uno screening della fibrillazione atriale nei loro pazienti ultrasessantacinquenni in un arco temporale di 3 mesi utilizzando il dispositivo KardiaMobile ECG. Lo studio ha dimostrato l’elevata frequenza della fibrillazione atriale nella popolazione geriatrica rilevando questa aritmia in circa il 6% dei soggetti arruolati nello studio (41). Questa prevalenza piuttosto elevata in confronto a quanto osservato in studi simili esprime probabilmente una particolare attenzione dei medici coinvolti nel ricercare la fibrillazione atriale nei loro pazienti a più elevato rischio di presentare questa aritimia. Non meno interessante il dato relativo alla elevata quota di pazienti che non assumevano anticoagulanti, pari al 71%, pazienti che erano ignari di essere affetti da fibrillazione atriale e per i quali si è concretizzata la possibilità di una efficace prevenzione delle complicanze emboliche. Meritevole di menzione l’importante riconoscimento del valore clinico del dispositivo e della sua semplicità d’uso da parte della generalità dei medici coinvolti nello studio.
Conclusioni
Lo screening della fibrillazione atriale rappresenta una problematica clinica di indiscutibile rilevanza. L’attuale disponibilità di dispositivi automatici per la misurazione della pressione arteriosa dotati di specifici algoritmi per rilevare la possibile presenza di irregolarità del ritmo cardiaco rappresenta una preziosa opportunità per identificare quella quota sommersa di fibrillazione atriale responsabile di una proporzione rilevante di eventi embolici a livello cerebrale e sistemico, soprattutto nella popolazione geriatrica. Non meno interessanti per lo screening della fibrillazione atriale sono i moderni dispositivi che consento di derivare, interfacciandosi con una App dedicata, una registrazione elettrocardiografica di 1 o più derivazioni della durata di 30 secondi, nel rispetto di quanto raccomandato dalle linee guida. Questi dispositivi, infatti, semplici da usare e di dimensioni contenute, rappresentano una preziosa opportunità per estendere con semplicità lo screening della fibrillazione atriale ad ampie fasce di popolazione, come i pazienti geriatrici tra i quali la fibrillazione atriale misconosciuta è una problematica assai frequente e condiziona ricadute cliniche spesso particolarmente rilevanti.
Bibliografia
- Marchionni N, Fumagalli S, Bo M, et al. Percorso clinico decisionale nel paziente anziano fragile con fibrillazione atriale: la proposta di un gruppo di lavoro multidisciplinare. G Ital Cardiol (Rome). 2021 Feb;22(2 Suppl 1):e3-e27.
- Volgman AS, Nair G, Lyubarova R, et al. Management of Atrial Fibrillation in Patients 75 Years and Older: JACC State-of-the-Art Review. J Am Coll Cardiol. 2022 Jan 18;79(2):166-179. doi: 10.1016/j.jacc.2021.10.037.
- Magnussen C, Niiranen TJ, Ojeda FM, et al. Sex differences and similarities in atrial fibrillation epidemiology, risk factors, and mortality in community cohorts: results from the BiomarCaRE Consortium (Biomarker for Cardiovascular Risk Assessment in Europe). Circulation 2017;136:1588-97.
- Lane DA, Skjoth F, Lip GY, et al. Temporal trends in incidence, prevalence, and mortality of atrial fibrillation in primary care. J Am Heart Assoc 2017;6:e005155.
- Chugh SS, Havmoeller R, Narayanan K, et al. Worldwide epidemiology of atrial fibrillation: a Global Burden of Disease 2010 Study. Circulation 2014;129:837-47.
- Miyasaka Y, Barnes ME, Gersh BJ, et al. Secular trends in incidence of atrial fibrillation in Olmsted County, Minnesota, 1980 to 2000, and implications on the projections for future prevalence. Circulation 2006;114:119-25.
- Rocken C, Peters B, Jeunemann G et al. An arrhythmogenic substrate for persistent atrial fibrillation. Circulation 2002; 106:2091-97
- January CT, Wann LS, Calkins H, et al. 2019 AHA/ACC/HRS focused update of the 2014 AHA/ ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm. Society. J Am Coll Cardiol. 2019;74:104–132.
- Kirchhof P, Lip GY, Van Gelder IC, et al. Comprehensive risk reduction in patients with atrial fibrillation: emerging diagnostic and therapeutic options. Executive summary of the report from the 3rd AFNET/EHRA consensus conference. Thromb Haemost. 2011;106:1012–1019.
- McIntyre WF, Healey J. Stroke prevention for patients with atrial fibrillation: beyond the guidelines. J Atr Fibrillation. 2017;9:1475. doi: 10.4022/jafib.147
- Chugh SS, Roth GA, Gillum RF, Mensah GA. Global burden of atrial fibrillation in developed and developing nations. Glob Heart. 2014;9:113–119. doi: 10.1016/j.gheart.2014.01.004
- Kirchhof P, Benussi S, Kotecha D, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur J Cardiothorac Surg. 2016;50:e1–e88. doi: 10.1093/ejcts/ezw313
- Chugh SS, Havmoeller R, Narayanan K, et al. Worldwide epidemiology of atrial fibrillation: a Global Burden of Disease 2010 Study. Circulation. 2014;129:837–847.
- January CT, Wann LS, Alpert JS, et al. ACC/AHA Task Force Members. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: executive summary: a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines and the Heart Rhythm Society. Circulation. 2014;130:2071–2104.
- Feinberg WM, Blackshear JL, Laupacis A, et al. Prevalence, age distribution, and gender of patients with atrial fibrillation. Analysis and implications. Arch Intern Med. 1995;155:469–473.
- Chung MK, Eckhardt LL, Chen LY, et al. Lifestyle and risk factor modification for reduction of atrial fibrillation: a scientific statement from the American Heart Association. Circulation. 2020;141:e750–e772.
- McMurray J, Køber L, Robertson M, et al. Antiarrhythmic effect of carvedilol after acute myocardial infarction: results of the Carvedilol Post-Infarct Survival Control in Left Ventricular Dysfunction (CAPRICORN) trial. J Am Coll Cardiol. 2005;45:525–530.
- Ruddox V, Sandven I, Munkhaugen J, et al. Atrial fibrillation and the risk formyocardial infarction, all-causemortalityand heart failure: a systematic review and meta-analysis. Eur J Prev Cardiol. 2017;24:1555–1566.
- Alonso A, Krijthe BP, Aspelund T, et al. Simple risk model predicts incidence of atrial fibrillation in a racially and geographically diverse population: the CHARGE-AF consortium. J Am Heart Assoc. 2013;2:e000102.
- Jabre P, Roger VL, Murad MH, et al. Mortality associated with atrial fibrillation in patients with myocardial infarction: a systematic review and meta-analysis. Circulation. 2011;123:1587-1593.
- Santhanakrishnan R, Wang N, Larson MG, et al. Atrial fibrillation begets heart failure and vice versa: temporal associations and differences in preserved versus reduced ejection fraction. Circulation. 2016;133:484-492.
- Ahmed MI, White M, Ekundayo OJ, et al. A history of atrial fibrillation and outcomes in chronic advanced systolic heart failure: a propensity matched study. Eur Heart J. 2009;30:2029-2037.
- Wang TJ, Larson MG, Levy D, et al. Temporal relations of atrial fibrillation and congestive heart failure and their joint influence on mortality: the Framingham Heart Study. Circulation. 2003;107: 2920-2925.
- Nasr IA, Bouzamondo A,Hulot JS, et al. Prevention of atrial fibrillation onset by beta-blocker treatment in heart failure: a meta-analysis. Eur Heart J. 2007;28:457–462.
- Vermes E, Tardif JC, Bourassa MG, et al. Enalapril decreases the incidence of atrial fibrillation in patients with left ventricular dysfunction: insight from the Studies Of Left Ventricular Dysfunction (SOLVD) trials. Circulation. 2003;107:2926–2931.
- Maggioni AP, Latini R, Carson PE, et al. Valsartan reduces the incidence of atrial fibrillation in patients with heart failure: results from the Valsartan Heart Failure Trial (Val-HeFT). Am Heart J. 2005;149:548–557.
- McMurray JJ, Packer M, Desai AS, et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med. 2014;371:993–1004.
- Lakshminarayan K, Solid CA, Collins JA, et al. Atrial fibrillation and stroke in the general medicare population: a 10-year perspective (1992 to 2002). Stroke 2006; 37(8):1969-74
- Marinigh R, Lip GY, Fiotti N, et al. Age as a risk factor for stroke in atrial fibrillation patients: implications for thromboprophylaxis. Journal of the Ame- rican College of Cardiology 2010; 56(11):827-837
- Kim D, Yang PS, Yu HT, et al. Risk of dementia in stroke-free patients diagnosed with atrial fibrillation: data from a population-based cohort. Eur Heart J. 2019;40:2313–2323.
- Ding M, Fratiglioni L, Johnell K, et al. Atrial fibrillation, antithrombotic treatment, and cognitive aging: a population-based study. Neurology. 2018;91:e1732–e1740.
- NICE, Hypertension: Clinical Management of Primary Hypertension in Adults, 2011 CG127. http://wwwniceorguk/guidance/CG127 (Assessed 18 Aug. 2015).
- Hobbs FD, Fitzmaurice DA, Mant J, et al. A randomised controlled trial and cost effectiveness study of systematic screening (targeted and total population screening) versus routine practice for the detection of atrial fibrillation in people aged 65 and over. The SAFE study, Health Technol. Assess. 9 (iii-iv, ix-x) (2005) 1-74.
- Jones C, Pollit V, Fitzmaurice D, Cowan C. Guideline Development Group. The management of atrial fibrillation: summary of updated NICE guidance. BMJ. 2014;348:g3655. doi: 10.1136/bmj.g3655
- Mancia G, Kreutz R, Brunström M, et al. Authors/Task Force Members:. 2023 ESH Guidelines for the management of arterial hypertension The Task Force for the management of arterial hypertension of the European Society of Hypertension Endorsed by the European Renal Association (ERA) and the International Society of Hypertension (ISH). J Hypertens. 2023 Jun 21. doi: 10.1097/HJH.0000000000003480.
- Unger T, Borghi C, Charchar F et al. 2020 International Society of Hypertension Global Hypertension Practice Guidelines. Hypertension. 2020;75:1334-1357.
- Verberk WJ, Omboni S, Kollias A et al. Screening for atrial fibrillation with automated blood pressure measurement: Research evidence and practice recommendations. Int J Cardiol 2016; 203:465-473
- Balanis T, Sander B. Detection of Atrial Fibrillation Using a Home Blood Pressure Monitor. Vascular Health and Risk Management 2021:17 407-414
- Hindricks G, et al; ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021 Feb 1;42(5):373-498.
- Orchard J, et al. eHealth tools to provide structured assistance for atrial fibrillation screening, management, and guideline-recommended therapy in metropolitan general practice: the AF-SMART study. J Am Heart Assoc 2019;8: e010959.
- Godin R, et al. Screening for atrial fibrillation using a mobile, single-lead electrocardiogram in Canadian Primary Care Clinics. Can J Cardiol 2019;35:840-845.
La fibrillazione atriale è l’aritmia sostenuta di riscontro più frequente in età avanzata. Studi di popolazione condotti in Europa hanno dimostrato, nel corso di quasi 13 anni di follow-up, una sua incidenza complessiva più alta negli uomini che nelle donne (6,4% vs 4,4%), con trend progressivamente crescente all’aumentare dell’età (1,2). Dopo i 50-60 anni, rispettivamente in uomini e donne, i nuovi casi di fibrillazione atriale sono sempre più numerosi, raggiungendo la massima incidenza oltre gli 80 anni (3). Negli ultratottantenni la prevalenza è di circa il 10%. Probabilmente, le migliori condizioni di cura, con il conseguente aumento della sopravvivenza dopo eventi clinici anche molto gravi, e la maggior attenzione alla diagnosi di aritmia, hanno comportato, in un breve arco temporale, il rapido incremento dei nuovi casi di fibrillazione atriale, particolarmente oltre i 75 e gli 85 anni di età (2,4). In uno studio osservazionale in 21 paesi, il 9% circa degli ultraottantenni aveva fibrillazione atriale (5); in altri contesti, la prevalenza di aritmia in soggetti di età ≥85 anni cresceva addirittura al 23% (6). Ovviamente, questi dati di prevalenza non tengono conto delle forme non diagnosticate la cui rilevanza epidemiologica appare tutt’altro che trascurabile.
La particolare suscettibilità dell’anziano a sviluppare fibrillazione atriale è in parte da ricondurre ai fenomeni di rimodellamento elettrico e anatomico a livello atriale legati in parte alle modificazioni fisiologiche o “parafisiologiche” del miocardio atriale dovute alla senescenza stessa. Infatti, dal punto di vista anatomico, nel paziente anziano si osserva una progressiva e costante deposizione di tessuto amiloide in atrio, con conseguente perdita di elasticità e contrattilità del miocardio e dilatazione della cavità cardiaca (9). Dal punto di vista elettrico, invece, si verifica un diffuso rallentamento nella conduzione del potenziale elettrico e un aumento dei periodi refrattari dell’atrio associato ad una riduzione della frequenza di scarica del nodo del seno (10). Questi fenomeni involutivi, ovviamente, non sono sempre sufficienti ad innescare una fibrillazione atriale che, se così fosse, dovrebbe interessare tutti gli anziani. Invero, le succitate modificazioni del miocardio rappresentano per lo più condizioni predisponenti che vengono amplificate nelle loro potenzialità aritmogeniche dalla cronica esposizione nel corso della vita ai diversi fattori di rischio che amplificano significativamente il rischio di fibrillazione atriale connesso all’età quali l’eccedenza ponderale e la sindrome delle apnee ostruttive, l’ipertensione arteriosa, il diabete mellito e l’insufficienza renale. Le linee guida 2019 American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society (ACC/AHA/HRS) suggeriscono infatti il controllo dei fattori di rischio come primo intervento per la gestione della fibrillazione atriale sottolineando i benefici della perdita di peso nei pazienti con fibrillazione atriale e body mass index >27 kg/m2 (8). L’ipertensione, in particolare, aumenta considerevolmente il rischio di fibrillazione atriale sia negli uomini che nelle donne (9-13). Invero, la fibrillazione atriale rappresenta una sorta di mini-epidemia nell’ambito dell’ampia popolazione degli anziani ipertesi. Peraltro, l’ictus ischemico dovuto alla fibrillazione atriale è spesso particolarmente grave negli anziani ipertesi con un enorme impatto prognostico sia quoad valetudinem che quoad vitam e ricadute socio-economiche di vaste proporzioni (9-13). Non sorprende, quindi, che le linee guida raccomandino lo screening sistematico della fibrillazione atriale nelle popolazioni a rischio più elevato quali, appunto, gli anziani ipertesi (12,14). Non meno rilevante appare il rischio di fibrillazione atriale nei pazienti con patologia coronarica o scompenso cardiaco, problematiche cliniche di comune riscontro nella popolazione geriatrica (15). La malattia coronarica e la fibrillazione atriale spesso coesistono in ragione della condivisione dei principali fattori di rischio. L’ischemia miocardica, inoltre, può contribuire a fenomeni di rimodellamento e di dilatazione atriale che a loro volta aumentano il rischio di fibrillazione atriale e condizionano la prognosi in misura non trascurabile, creando un circolo vizioso di progressiva amplificazione del rischio (16,17). La fibrillazione atriale, infatti, è associata ad un aumentato rischio di infarto miocardico (risk ratio 1,54, C.I. 95% 1,26-1,85) (18) e l’infarto miocardico, a sua volta, si associa ad aumentato rischio di fibrillazione atriale (risk ratio 1,64, C.I. 95% 1,38-1,96) (19). I pazienti con infarto miocardico hanno un aumentato rischio di morte indipendentemente dal fatto che la fibrillazione atriale venga diagnostica prima (odds ratio 1,86) o concomitantemente all’infarto miocardico (odds ratio 1,37) (20). Ancora più stretta è la relazione tra fibrillazione atriale ed infarto miocardico con una reciproca influenza fisiopatologica principalmente dovuta a fenomeni di rimodellamento cardiaco (21). La fibrillazione atriale rappresenta uno dei principali determinanti delle riacutizzazioni di scompenso cardiaco e si associa ad una aumentata mortalità e morbilità (16,22,23). All’opposto, l’ottimizzazione della terapia medica dello scompenso cardiaco a ridotta frazione di eiezione è associata ad una riduzione del rischio di fibrillazione atriale (24-27).
L’impatto clinico della fibrillazione atriale è particolarmente rilevante nell’anziano. Il rischio di ictus ischemico nella popolazione con fibrillazione atriale, infatti, è 5 volte maggiore rispetto alla popolazione generale con una diretta responsabilità di questa aritmia su circa il 20% di tutti gli eventi ischemici cerebrali sintomatici, percentuale che nei pazienti anziani ultraottantenni sale al 25-30% (28,29). Non appare inutile sottolineare come la fibrillazione atriale rappresenti uno dei principali fattori di rischio per declino cognitivo e demenza nella popolazione geriatrica (2). Uno studio coreano condotto utilizzando un ampio database amministrativo, ad esempio, ha dimostrato una incidenza di demenza significativamente maggiore nei pazienti con fibrillazione atriale rispetto ai soggetti in ritmo sinusale, con un significativo incremento del rischio di malattia di Alzheimer anche nei soggetti senza storia di ictus. Lo stesso studio ha anche dimostrato un ridotto rischio di demenza nei pazienti con fibrillazione atriale di nuova insorgenza trattati con anticoagulanti orali (hazard ratio 0,61, CI. 95% 0,54-0,68) (30). Simili risultati sono stati prodotti anche da uno studio svedese che ha dimostrato un aumentato rischio di declino cognitivo e demenza nei pazienti con fibrillazione atriale ed una riduzione del 60% del rischio di demenza in corso di terapia anticoagulante nei pazienti con fibrillazione atriale sia incidente che prevalente (hazard ratio 0,40, CI. 95% 0,18-0,92) (31). Peraltro, la frequente coesistenza di comorbilità condiziona in modo non trascurabile la prognosi.
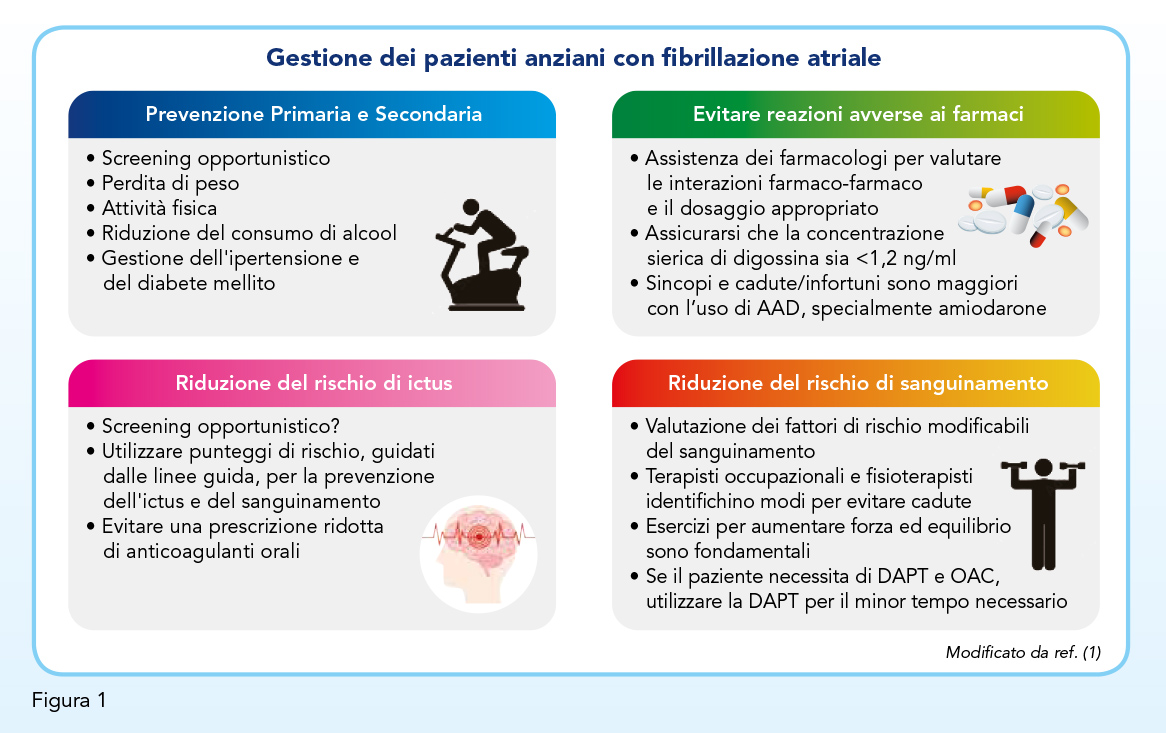
Quanto sopra esposto suggerisce l’opportunità di una precoce identificazione della fibrillazione atriale al fine di definirne l’approccio gestionale più adeguato in termini di controllo della frequenza cardiaca o del ritmo e di impostazione della terapia anticoagulante al fine di ridurre il rischio di ictus (Figura 1) (1). Lo screening opportunistico della fibrillazione atriale attraverso la palpazione del polso rappresenta l’approccio più seguito (32), ma la sua accuratezza diagnostica è piuttosto modesta, con una sensibilità pari a 0,87 ed una specificità pari a 0,81 (33). Invero, la fibrillazione atriale ha spesso carattere parossistico e, conseguentemente, può sfuggire alla singola rilevazione. Non di rado l’ictus embolico rappresenta l’evento con cui viene diagnosticata una fibrillazione atriale fino ad allora misconosciuta in ragione della sua sintomatologia modesta, se non del tutto assente. Per questo motivo le linee guida supportano l’uso di tecniche di monitoraggio per lo screening della fibrillazione atriale negli anziani ipertesi (12,14,34).
L’automisurazione domiciliare della pressione arteriosa, oltre a rappresentare da anni uno dei pilastri su cui poggia la gestione dell’ipertensione arteriosa (35,36), grazie all’introduzione in commercio di moderni strumenti automatici dotati di specifici algoritmi diagnostici che consentono di porre il sospetto di fibrillazione atriale nel corso della misurazione pressoria, rappresenta anche una preziosa opportunità per la identificazione della quota misconosciuta di fibrillazione atriale. Una meta-analisi di 6 studi finalizzati alla valutazione dell’affidabilità diagnostica della misurazione automatica della pressione arteriosa nell’identificazione della fibrillazione atriale ha evidenziato una sensibilità pari a 0,98 (intervallo di confidenza al 95% compreso tra 0,95 e 1,00) ed una specificità pari a 0,92 (intervallo di confidenza al 95% compreso tra 0,88 e 0,96) (37).
E’ evidente che l’utilità diagnostica dei dispositivi automatici per la misurazione della pressione arteriosa nell’individuazione della fibrillazione atriale è condizionata dalla validità degli algoritmi utilizzati. A questo riguardo è meritevole di menzione un recente studio condotto in 99 pazienti anziani (età media 70,2 anni) sottoposti simultaneamente a registrazione elettrocardiografica e a misurazione della pressione arteriosa con dispositivo automatico (Omron BP785N) provvisto di specifico algoritmo per la rilevazione di una possibile fibrillazione atriale. Questo studio ha dimostrato una accuratezza diagnostica dell’87,88% con una sensibilità del 100% ed una specificità dell’84,8% (38). La ricerca tecnologica ha reso oggi disponibili speciali manicotti – quali l’Intelli-wrap-cuff in dotazione con il misuratore automatico Omron M6 comfort-IT – in grado di misurare correttamente la pressione arteriosa senza risentire in modo significativo delle diverse misure di circonferenza brachiale. Queste speciale manicotto, peraltro, consente di rilevare la pressione in modo accurato senza essere condizionato ad un eventuale malposizionamento a livello del braccio, elemento che invece può determinare una non trascurabile variabilità delle rilevazioni pressorie quando si utilizzano i bracciali tradizionali.
Le Linee Guida ESC per la fibrillazione atriale sottolineano come per la diagnosi certa di fibrillazione atriale sia sempre necessaria la conferma elettrocardiografica, considerando la possibilità di utilizzare, oltre alla classica registrazione elettrocardiografica a 12 derivazioni, anche una registrazione elettrocardiografica a singola derivazione con un tracciato di almeno 30 secondi (39). Invero, anche dalla registrazione di una singola derivazione possono essere dedotte tutte le informazioni necessarie per individuare la presenza di fibrillazione atriale. Attualmente sono disponibili in commercio dispositivi di dimensione contenute, e quindi facili da portare con se, che interfacciandosi con una App dedicata consentono di ottenere una registrazione di 1 o 6 derivazioni elettrocardiografiche della durata di 30 secondi, adeguata, secondo quanto indicato dalle linee guida, per lo screening della fibrillazione atriale (39). A tale riguardo, i risultati dello studio AF-SMART, condotto in una popolazione di quasi duemila individui ultrasessantacinquenni seguiti in un contesto di primary care, mostrano come l’uso del dispositivo portatile per la registrazione elettrocardiografica KardiaMobile abbia consentito di individuare una fibrillazione atriale misconosciuta nell’1,1% dei soggetti sottoposti a screening (40). Meritevoli di attenzione anche i risultati di uno studio condotto da 133 medici di medicina generale canadesi che hanno effettuato uno screening della fibrillazione atriale nei loro pazienti ultrasessantacinquenni in un arco temporale di 3 mesi utilizzando il dispositivo KardiaMobile ECG. Lo studio ha dimostrato l’elevata frequenza della fibrillazione atriale nella popolazione geriatrica rilevando questa aritmia in circa il 6% dei soggetti arruolati nello studio (41). Questa prevalenza piuttosto elevata in confronto a quanto osservato in studi simili esprime probabilmente una particolare attenzione dei medici coinvolti nel ricercare la fibrillazione atriale nei loro pazienti a più elevato rischio di presentare questa aritimia. Non meno interessante il dato relativo alla elevata quota di pazienti che non assumevano anticoagulanti, pari al 71%, pazienti che erano ignari di essere affetti da fibrillazione atriale e per i quali si è concretizzata la possibilità di una efficace prevenzione delle complicanze emboliche. Meritevole di menzione l’importante riconoscimento del valore clinico del dispositivo e della sua semplicità d’uso da parte della generalità dei medici coinvolti nello studio.
Conclusioni
Lo screening della fibrillazione atriale rappresenta una problematica clinica di indiscutibile rilevanza. L’attuale disponibilità di dispositivi automatici per la misurazione della pressione arteriosa dotati di specifici algoritmi per rilevare la possibile presenza di irregolarità del ritmo cardiaco rappresenta una preziosa opportunità per identificare quella quota sommersa di fibrillazione atriale responsabile di una proporzione rilevante di eventi embolici a livello cerebrale e sistemico, soprattutto nella popolazione geriatrica. Non meno interessanti per lo screening della fibrillazione atriale sono i moderni dispositivi che consento di derivare, interfacciandosi con una App dedicata, una registrazione elettrocardiografica di 1 o più derivazioni della durata di 30 secondi, nel rispetto di quanto raccomandato dalle linee guida. Questi dispositivi, infatti, semplici da usare e di dimensioni contenute, rappresentano una preziosa opportunità per estendere con semplicità lo screening della fibrillazione atriale ad ampie fasce di popolazione, come i pazienti geriatrici tra i quali la fibrillazione atriale misconosciuta è una problematica assai frequente e condiziona ricadute cliniche spesso particolarmente rilevanti.
Bibliografia
- Marchionni N, Fumagalli S, Bo M, et al. Percorso clinico decisionale nel paziente anziano fragile con fibrillazione atriale: la proposta di un gruppo di lavoro multidisciplinare. G Ital Cardiol (Rome). 2021 Feb;22(2 Suppl 1):e3-e27.
- Volgman AS, Nair G, Lyubarova R, et al. Management of Atrial Fibrillation in Patients 75 Years and Older: JACC State-of-the-Art Review. J Am Coll Cardiol. 2022 Jan 18;79(2):166-179. doi: 10.1016/j.jacc.2021.10.037.
- Magnussen C, Niiranen TJ, Ojeda FM, et al. Sex differences and similarities in atrial fibrillation epidemiology, risk factors, and mortality in community cohorts: results from the BiomarCaRE Consortium (Biomarker for Cardiovascular Risk Assessment in Europe). Circulation 2017;136:1588-97.
- Lane DA, Skjoth F, Lip GY, et al. Temporal trends in incidence, prevalence, and mortality of atrial fibrillation in primary care. J Am Heart Assoc 2017;6:e005155.
- Chugh SS, Havmoeller R, Narayanan K, et al. Worldwide epidemiology of atrial fibrillation: a Global Burden of Disease 2010 Study. Circulation 2014;129:837-47.
- Miyasaka Y, Barnes ME, Gersh BJ, et al. Secular trends in incidence of atrial fibrillation in Olmsted County, Minnesota, 1980 to 2000, and implications on the projections for future prevalence. Circulation 2006;114:119-25.
- Rocken C, Peters B, Jeunemann G et al. An arrhythmogenic substrate for persistent atrial fibrillation. Circulation 2002; 106:2091-97
- January CT, Wann LS, Calkins H, et al. 2019 AHA/ACC/HRS focused update of the 2014 AHA/ ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm. Society. J Am Coll Cardiol. 2019;74:104–132.
- Kirchhof P, Lip GY, Van Gelder IC, et al. Comprehensive risk reduction in patients with atrial fibrillation: emerging diagnostic and therapeutic options. Executive summary of the report from the 3rd AFNET/EHRA consensus conference. Thromb Haemost. 2011;106:1012–1019.
- McIntyre WF, Healey J. Stroke prevention for patients with atrial fibrillation: beyond the guidelines. J Atr Fibrillation. 2017;9:1475. doi: 10.4022/jafib.147
- Chugh SS, Roth GA, Gillum RF, Mensah GA. Global burden of atrial fibrillation in developed and developing nations. Glob Heart. 2014;9:113–119. doi: 10.1016/j.gheart.2014.01.004
- Kirchhof P, Benussi S, Kotecha D, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur J Cardiothorac Surg. 2016;50:e1–e88. doi: 10.1093/ejcts/ezw313
- Chugh SS, Havmoeller R, Narayanan K, et al. Worldwide epidemiology of atrial fibrillation: a Global Burden of Disease 2010 Study. Circulation. 2014;129:837–847.
- January CT, Wann LS, Alpert JS, et al. ACC/AHA Task Force Members. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: executive summary: a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines and the Heart Rhythm Society. Circulation. 2014;130:2071–2104.
- Feinberg WM, Blackshear JL, Laupacis A, et al. Prevalence, age distribution, and gender of patients with atrial fibrillation. Analysis and implications. Arch Intern Med. 1995;155:469–473.
- Chung MK, Eckhardt LL, Chen LY, et al. Lifestyle and risk factor modification for reduction of atrial fibrillation: a scientific statement from the American Heart Association. Circulation. 2020;141:e750–e772.
- McMurray J, Køber L, Robertson M, et al. Antiarrhythmic effect of carvedilol after acute myocardial infarction: results of the Carvedilol Post-Infarct Survival Control in Left Ventricular Dysfunction (CAPRICORN) trial. J Am Coll Cardiol. 2005;45:525–530.
- Ruddox V, Sandven I, Munkhaugen J, et al. Atrial fibrillation and the risk formyocardial infarction, all-causemortalityand heart failure: a systematic review and meta-analysis. Eur J Prev Cardiol. 2017;24:1555–1566.
- Alonso A, Krijthe BP, Aspelund T, et al. Simple risk model predicts incidence of atrial fibrillation in a racially and geographically diverse population: the CHARGE-AF consortium. J Am Heart Assoc. 2013;2:e000102.
- Jabre P, Roger VL, Murad MH, et al. Mortality associated with atrial fibrillation in patients with myocardial infarction: a systematic review and meta-analysis. Circulation. 2011;123:1587-1593.
- Santhanakrishnan R, Wang N, Larson MG, et al. Atrial fibrillation begets heart failure and vice versa: temporal associations and differences in preserved versus reduced ejection fraction. Circulation. 2016;133:484-492.
- Ahmed MI, White M, Ekundayo OJ, et al. A history of atrial fibrillation and outcomes in chronic advanced systolic heart failure: a propensity matched study. Eur Heart J. 2009;30:2029-2037.
- Wang TJ, Larson MG, Levy D, et al. Temporal relations of atrial fibrillation and congestive heart failure and their joint influence on mortality: the Framingham Heart Study. Circulation. 2003;107: 2920-2925.
- Nasr IA, Bouzamondo A,Hulot JS, et al. Prevention of atrial fibrillation onset by beta-blocker treatment in heart failure: a meta-analysis. Eur Heart J. 2007;28:457–462.
- Vermes E, Tardif JC, Bourassa MG, et al. Enalapril decreases the incidence of atrial fibrillation in patients with left ventricular dysfunction: insight from the Studies Of Left Ventricular Dysfunction (SOLVD) trials. Circulation. 2003;107:2926–2931.
- Maggioni AP, Latini R, Carson PE, et al. Valsartan reduces the incidence of atrial fibrillation in patients with heart failure: results from the Valsartan Heart Failure Trial (Val-HeFT). Am Heart J. 2005;149:548–557.
- McMurray JJ, Packer M, Desai AS, et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med. 2014;371:993–1004.
- Lakshminarayan K, Solid CA, Collins JA, et al. Atrial fibrillation and stroke in the general medicare population: a 10-year perspective (1992 to 2002). Stroke 2006; 37(8):1969-74
- Marinigh R, Lip GY, Fiotti N, et al. Age as a risk factor for stroke in atrial fibrillation patients: implications for thromboprophylaxis. Journal of the Ame- rican College of Cardiology 2010; 56(11):827-837
- Kim D, Yang PS, Yu HT, et al. Risk of dementia in stroke-free patients diagnosed with atrial fibrillation: data from a population-based cohort. Eur Heart J. 2019;40:2313–2323.
- Ding M, Fratiglioni L, Johnell K, et al. Atrial fibrillation, antithrombotic treatment, and cognitive aging: a population-based study. Neurology. 2018;91:e1732–e1740.
- NICE, Hypertension: Clinical Management of Primary Hypertension in Adults, 2011 CG127. http://wwwniceorguk/guidance/CG127 (Assessed 18 Aug. 2015).
- Hobbs FD, Fitzmaurice DA, Mant J, et al. A randomised controlled trial and cost effectiveness study of systematic screening (targeted and total population screening) versus routine practice for the detection of atrial fibrillation in people aged 65 and over. The SAFE study, Health Technol. Assess. 9 (iii-iv, ix-x) (2005) 1-74.
- Jones C, Pollit V, Fitzmaurice D, Cowan C. Guideline Development Group. The management of atrial fibrillation: summary of updated NICE guidance. BMJ. 2014;348:g3655. doi: 10.1136/bmj.g3655
- Mancia G, Kreutz R, Brunström M, et al. Authors/Task Force Members:. 2023 ESH Guidelines for the management of arterial hypertension The Task Force for the management of arterial hypertension of the European Society of Hypertension Endorsed by the European Renal Association (ERA) and the International Society of Hypertension (ISH). J Hypertens. 2023 Jun 21. doi: 10.1097/HJH.0000000000003480.
- Unger T, Borghi C, Charchar F et al. 2020 International Society of Hypertension Global Hypertension Practice Guidelines. Hypertension. 2020;75:1334-1357.
- Verberk WJ, Omboni S, Kollias A et al. Screening for atrial fibrillation with automated blood pressure measurement: Research evidence and practice recommendations. Int J Cardiol 2016; 203:465-473
- Balanis T, Sander B. Detection of Atrial Fibrillation Using a Home Blood Pressure Monitor. Vascular Health and Risk Management 2021:17 407-414
- Hindricks G, et al; ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021 Feb 1;42(5):373-498.
- Orchard J, et al. eHealth tools to provide structured assistance for atrial fibrillation screening, management, and guideline-recommended therapy in metropolitan general practice: the AF-SMART study. J Am Heart Assoc 2019;8: e010959.
- Godin R, et al. Screening for atrial fibrillation using a mobile, single-lead electrocardiogram in Canadian Primary Care Clinics. Can J Cardiol 2019;35:840-845.
Related papers
La medicina tradizionale basa le sue scelte e soluzioni terapeutiche sulla dimostrazione della efficacia dei farmaci quale emerge dai risultati degli studi clinici controllati che selezionano le molecole più efficaci e dettano la strategia di impiego nei pazienti in cui si presume una maggiore efficacia. Nell’ambito di questa strategia di condotta è possibile identificare due [more info]
L’insostenibile leggerezza dell’essere, splendido romando di Milan Kundera, ha come tema principale la pesantezza esistenziale. Ogni persona vive una sola volta e non si ha mai la possibilità di valutare le proprie scelte, perciò diventa difficile capire se tutto ciò che si fa nella vita è giusto o sbagliato, perché non si ha modo di [more info]
Introduzione Le malattie cardiovascolari (CV) costituiscono una delle principali cause di mortalità in tutto il mondo. Secondo l’Organizzazione Mondiale della Sanità (OMS), nel 2019 circa il 32% delle morti globali è stato attribuito a malattie cardiovascolari (1). Tra queste, ruolo predominante gioca la malattia coronarica aterosclerotica, la quale rappresenta la prima causa di mortalità e [more info]