Introduzione
Le malattie cardiovascolari (CV) rappresentano ancora oggi la principale causa di mortalità in Italia e comportano un elevato costo economico e sanitario. Per ridurre l’incidenza di eventi CV fatali e non fatali (come la coronaropatia, l’ictus ischemico e l’arteriopatia periferica), è necessario agire sui fattori di rischio modificabili, tra cui il fumo, l’attività fisica, l’alimentazione, la pressione arteriosa, il diabete di tipo 2 e la dislipidemia (1). In particolare, la dislipidemia e i livelli di colesterolo LDL – il cosiddetto “colesterolo cattivo” – rappresentano i primi obiettivi per la prevenzione delle malattie CV.
L’osservatorio nazionale sull’impiego dei medicinali (OsMed) riporta che, nel 2021, il 13,5% della popolazione italiana ha utilizzato agenti ipolipemizzanti, percentuale che aumenta al 47,9% se si considerano esclusivamente i soggetti affetti da dislipidemia (2). Le statine, in particolare rosuvastatina e atorvastatina, costituiscono la categoria terapeutica maggiormente utilizzata, indipendentemente dal tipo di dislipidemia, con una prevalenza del 39,7% (2).
La terapia statinica
Da più di 30 anni, le statine vengono impiegate come efficace strumento terapeutico ipolipemizzante al fine di ridurre l’incidenza di eventi CV; sono farmaci ampiamente studiati nella prevenzione delle malattie CV e svariati studi clinici randomizzati ne hanno dimostrato la capacità di rallentare, o addirittura invertire, la progressione dell’aterosclerosi (3–7). Le statine, oltre a ridurre il colesterolo LDL, possono avere effetti pleiotropici e antinfiammatori che potrebbero risultare utili nelle fasi iniziali del trattamento, specialmente in condizioni cliniche acute come la sindrome coronarica acuta (8,9).
Gli effetti benefici delle statine derivano dalla loro capacità di ridurre la biosintesi del colesterolo, queste agiscono infatti inibendo l’enzima 3-idrossi-3-metilglutaril coenzima A (HMG-CoA) reduttasi, responsabile della sintesi endogena del colesterolo. Questo meccanismo porta a una maggiore espressione dei recettori delle LDL sulla superficie cellulare, favorendo l’assorbimento sia del colesterolo LDL e che delle lipoproteine a bassissima densità (VLDL; Very Low Density Lipoprotein), riducendo così il livello complessivo di colesterolo nel sangue (10). Poiché la via metabolica del mevalonato – in cui l’enzima HMG-CoA reduttasi è coinvolto – produce una serie di isoprenoidi vitali per diverse funzioni cellulari, l’inibizione di HMG-CoA reduttasi può indurre svariati effetti pleiotropici indipendentemente dall’azione ipolipidemizzante (11). Alcuni di questi meccanismi hanno un’azione vascolare diretta inibendo la generazione di specie reattive dell’ossigeno, riducendo la secrezione di metalloproteinasi, aumentando l’attività fibrinolitica e favorendo l’attività dell’ossido nitrico sintetasi endoteliale (11). Alcune statine possiedono inoltre importanti proprietà immunomodulanti che contribuiscono al loro effetto benefico nell’aterosclerosi, al di là della riduzione del colesterolo (12,13). Infine, vi sono evidenze di proprietà quali l’inibizione della migrazione, proliferazione e adesione cellulare, che contribuiscono all’inibizione della crescita tumorale (11).
Rosuvastatina
Vi sono varie statine disponibili e che si differenziano per assorbimento, biodisponibilità, legame con le proteine plasmatiche, escrezione e solubilità, nonché per il loro costo per il sistema sanitario (10). Tra queste, la rosuvastatina ha dimostrato la sua efficacia in svariati trial clinici, studi in cui un basso dosaggio di questa statina è risultato essere più efficace nel ridurre i livelli di LDL rispetto ad altre statine come simvastatina, atorvastatina e pravastatina (14–17), rivelandosi essere, tra queste, l’agente più potente nella riduzione del rischio CV (10). Oltre alla riduzione dei livelli di colesterolo LDL e VLDL, la rosuvastatina agisce su altri aspetti del profilo lipidico, riducendo i livelli di trigliceridi (TG) e di apolipoproteina B (la principale proteina delle LDL). La rosuvastatina aumenta contemporaneamente la produzione delle lipoproteine ad alta densità (HDL), note come “colesterolo buono”, si presume attraverso la stimolazione della sintesi dell’apolipoproteina A (la principale proteina delle HDL) o l’inibizione del suo catabolismo e/o del trasferimento degli colesteril estere (15,18). Rosuvastatina agisce inoltre sui marcatori di infiammazione vascolare e rallenta l’ispessimento della placca aterosclerotica.
Rosuvastatina raggiunge la concentrazione plasmatica massima dopo circa 5 ore dall’assunzione orale e possiede una biodisponibilità assoluta di circa il 20% (19). Questo farmaco viene inoltre captato a livello epatico, il principale sito di sintesi del colesterolo e di eliminazione delle LDL. Nell’impiego di rosuvastatina, è importante considerare le possibili interazioni farmacologiche, in particolare, le statine possono interagire con inibitori del CYP3A4; è stato infatti osservato un aumento del rischio di rabdomiolisi nei casi di co-somministrazione di statine e alcuni farmaci (e.g. amiodarone, eritromicina, etc.). Il metabolismo delle statine può variare a seconda dell’isoenzima coinvolto; tuttavia, statine come rosuvastatina o fluvastatina presentano un vantaggio in termini di interazioni farmacologiche rispetto ad altre statine (19).
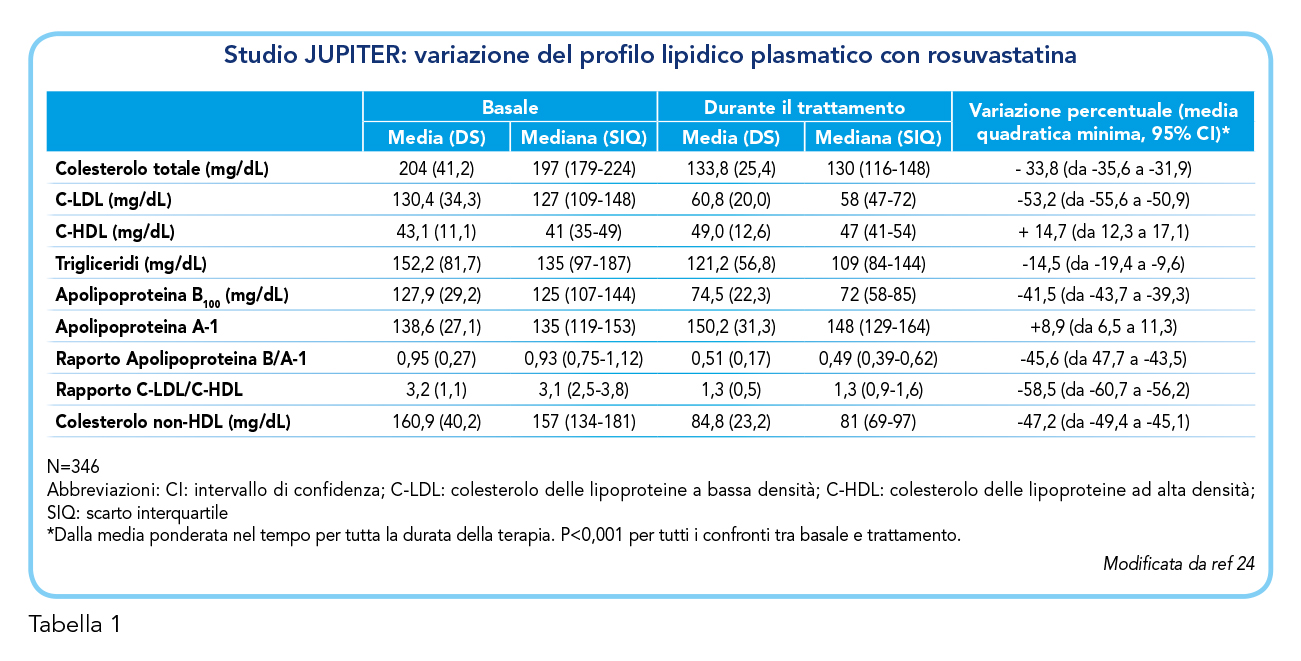
Numerosi trial clinici hanno dimostrato i benefici clinici del meccanismo d’azione della rosuvastatina. Tra questi, lo studio ASTEROID ha dimostrato come la terapia con rosuvastatina 40 mg/die porti a una significativa regressione delle stenosi vascolari (20,21). In questo studio, rosuvastatina ha consentito una riduzione del colesterolo LDL del 53,2%, riducendone i valori plasmatici medi da 130,4 mg/dL a 60,8 mg/dL, e contemporaneamente aumentando il colesterolo HDL del 14,7%, da valori plasmatici medi di 43,1 a 49,0 mg/dL (20). Inoltre, la rosuvastatina è risultata utile anche nella gestione dell’aterosclerosi carotidea, riducendo la progressione dello spessore dell’intima media e la percentuale di nucleo necrotico ricco di lipidi nell’ateroma (22,23). Un altro studio noto è lo studio JUPITER, interrotto prematuramente per via del notevole beneficio osservato nel braccio di trattamento con rosuvastatina rispetto al placebo. A circa due anni dall’inizio dello studio, rosuvastatina, somministrata alla dose di 20 mg/die, aveva comportato una riduzione del rischio di eventi CV (endpoint composito di infarto miocardico, ictus o morte per cause CV) pari al 55% nei pazienti che avevano raggiunto un livello di LDL inferiore a 70 mg/dL. Lo studio JUPITER ha inoltre preso in considerazione i livelli di proteina C reattiva (PCR), un biomarcatore dell’infiammazione e predittore del rischio CV su cui le statine agiscono riducendone i livelli. I pazienti che avevano raggiunto un valore di PCR inferiore a 2 mg/dL e a 1 mg/dL, insieme al target di LDL < 70 mg/dL, mostravano rispettivamente una riduzione del rischio CV pari al 65% e al 79% (Tabella 1) (24). Infine, un’importante meta-analisi derivata dal database VOYAGER – comprensivo dei dati 32.258 pazienti ottenuti da 37 studi differenti – afferma che, tra rosuvastatina, atorvastatina e simvastatina, rosuvastatina è la più efficace nel ridurre il colesterolo LDL e nel raggiungere i livelli lipidici target, soprattutto nei pazienti diabetici, sottolineando l’importanza di utilizzare una statina efficace alla dose appropriata per i pazienti ad alto rischio (25).
Oltre la monoterapia
Nonostante la terapia con statine sia generalmente efficace nella riduzione del rischio CV, alcuni pazienti non riescono ad ottenere un controllo sufficiente con la sola terapia statinica. In questi casi, è possibile adottare una terapia combinata, che includa l’impiego di una molecola dal meccanismo d’azione complementare per ottenere una migliore gestione del rischio CV. L’acido acetilsalicilico (ASA) è uno dei farmaci cardiovascolari più studiati nella storia della medicina. Questo farmaco ha una comprovata efficacia nella riduzione dell’incidenza di infarto miocardico, ictus o morte vascolare nei pazienti con malattia vascolare attraverso la sua azione anti-aterosclerotica (26). Nello specifico, la sua attività antiaggregante deriva dall’acetilazione della ciclossigenasi che inibisce perciò la sintesi del trombossano A2, una prostaglandina dalla potente azione pro-aggregante piastrinica e vasocostrittrice.
Dopo assunzione orale, ASA viene rapidamente assorbito nell’intestino tenue e convertito in acido salicilico per idrolisi e, successivamente, in acido glicinico e glucoronico. L’emivita di ASA è breve, equivalente a circa 15-20 minuti, mentre a dosi terapeutiche più elevate, la capacità di conversione dell’acido salicilico viene superata e la sua farmacocinetica diventa non lineare, comportando un prolungamento dell’emivita apparente di eliminazione dell’acido salicilico da poche ore a circa 24 ore. L’eliminazione avviene principalmente attraverso i reni, con l’acido salicilico che subisce un riassorbimento tubulare dipendente dal pH delle urine.
Un’importante meta-analisi ha valutato l’efficacia e i rischi di ASA a basso dosaggio (50-325 mg/die) in un totale di 9.853 pazienti affetti da malattia cardiovascolare stabile (27). Le possibili patologie cardiovascolari includevano precedente infarto miocardico, angina stabile o ictus/attacco ischemico transitorio. ASA a basso dosaggio è stata associata a una significativa riduzione del 21% del rischio di eventi cardiovascolari, del 26% del rischio di infarto miocardico non fatale, del 25% del rischio di ictus e del 13% del rischio di mortalità generale. Il trattamento di 1.000 pazienti per una durata media di 33 mesi avrebbe impedito 33 eventi cardiovascolari, 12 infarti miocardici non fatali, 25 ictus non fatali e 14 decessi, e causato 9 episodi di sanguinamento grave (27). Tutti i benefici menzionati superano i rischi di complicazioni emorragiche che possono essere associati ad ASA, rendendone l’impiego a basso dosaggio come adeguato nel contesto di prevenzione secondaria (28).
La combinazione di rosuvastatina e ASA rappresenta un’opzione terapeutica interessante per la prevenzione del rischio CV. Infatti, entrambi i farmaci hanno dimostrato un significativo effetto benefico nella riduzione del rischio aterosclerotico; la loro combinazione è indicata specificamente per la prevenzione secondaria nei soggetti che non sono adeguatamente controllati dalla monoterapia. I meccanismi d’azione dei due farmaci coinvolgono vie biochimiche distinte: l’una, rosuvastatina, riduce il principale fattore aterogeno, ossia il colesterolo contenuto nelle lipoproteine LDL e VLDL, e l’altro, ASA, interviene sull’aggregazione piastrinica, responsabile dei trombi. Inoltre, l’utilizzo delle due principi attivi in combinazione fissa semplifica lo schema terapeutico, favorendone l’aderenza di dei pazienti alla terapia che, secondo alcune stime, varia dal 50% per la prevenzione primaria della malattia CV aterosclerotica al 66% per la prevenzione secondaria (29). Alcuni dati riportano infatti un dimezzamento dell’aderenza alla terapia con statine intorno al sesto mese di trattamento (Figura 1) (30). Tra le ragioni della scarsa aderenza alla terapia statinica si annoverano la prescrizione di regimi terapeutici complessi, una mancata o scarsa comprensione della severità della malattia e una percezione di incertezza riguardo l’efficacia del trattamento (21). Secondo alcune stime, l’aumento dell’aderenza alla terapia statinica dal 50 al 75% sarebbe di per sé in grado di ridurre del doppio nuovi decessi legati alle complicanze CV (30,31). Questi dati sottolineano dunque l’importanza di un intervento terapeutico efficace che agevoli anche i pazienti più resistenti alla terapia a seguire uno schema d’uso, attraverso una sua semplificazione e un’adeguata informazione del paziente stesso.
Va sottolineato che l’aderenza e la persistenza adeguata alla terapia con ipolipemizzanti sono associati a una riduzione del rischio di eventi cardiovascolari. Il Rapporto OsMed del 2021 riporta un’analisi condotta sui nuovi utilizzatori di terapia ipolipemizzante di almeno 45 anni, seguiti per un anno, per valutare l’aderenza e la persistenza ai trattamenti cronici. È emerso che il 42,8% dei soggetti ha mostrato un’alta aderenza al trattamento, mentre il 15,1% ha mostrato una bassa aderenza (2). La bassa aderenza tende ad aumentare con l’età, con il valore più alto riscontrato negli ultra-ottantacinquenni e nelle donne. Nel complesso, meno della metà dei nuovi utilizzatori è risultata persistente al trattamento, con differenze regionali e gli uomini hanno mostrato percentuali di persistenza più elevate rispetto alle donne. L’aderenza e la persistenza alla terapia con statine risultano dunque essere importanti per ottenere i benefici attesi in termini di prevenzione cardiovascolare. Tuttavia, l’aderenza alla terapia con statine a lungo termine è limitata, il che comporta ricadute negative sulla salute pubblica e sui costi sanitari.
Il noto studio JUPITER, che ha coinvolto un vasto numero di partecipanti (n = 17.802), includeva il 16,6% di pazienti riceventi sia la terapia con rosuvastatina che ASA come anticoagulante (24). Jeffrey M. Bloom, un esperto in medicina interna con oltre 37 anni di esperienza, ha redatto un commento allo studio JUPITER pubblicato su The Lancet in cui ha discusso come si sarebbe dovuto prendere maggiormente in considerazione ASA come opzione anti-infiammatoria più economica (32). Nonostante l’elevato rischio cardiovascolare, solo una piccola percentuale dei partecipanti seguiva una terapia con ASA. È importante notare che le statine non solo riducono il colesterolo, ma hanno anche effetti antinfiammatori e antitrombotici. Bloom suggerisce che, se altri studi confermano i benefici del rosuvastatina in combinazione con ASA, si dovrebbe prendere in maggiore considerazione l’espansione di questa terapia (32).
È infine rilevante notare che la combinazione di statine e ASA ha un ruolo preventivo fondamentale nel ridurre la morbilità e la mortalità CV anche nei pazienti con infezione da HIV (33). In questa categoria di pazienti, infatti, la persistente attivazione immunitaria può accelerare l’aterosclerosi e, pertanto, l’intervento anti-infiammatorio congiunto delle due molecole fornisce un’ulteriore protezione CV. Una revisione delle evidenze in letteratura in merito ha portato gli autori a concludere che la terapia statinica vada intrapresa in tutti i pazienti con un rischio calcolato di eventi CV a 10 anni pari o superiore al 10%, suggerendo rosuvastatina come tra le prime molecole da impiegare (33). Mentre, per quanto riguarda ASA, questo dovrebbe essere sempre associata a una statina in prevenzione secondaria, mentre i clinici che si occupano di HIV dovrebbero incoraggiare fortemente la prescrizione e l’aderenza a questi farmaci (33).
In sintesi, rosuvastatina si afferma come una valida opzione terapeutica ipolipemizzante per la prevenzione di eventi CV e, nei pazienti in cui questa da sola non risulti sufficiente al controllo del rischio CV, la combinazione a dose fissa con ASA può ulteriormente ridurre il rischio aterosclerotico e agevolare lo schema terapeutico favorendo l’aderenza alla terapia.
Caso Clinico
Il signor Maurizio A., di anni 58, giunge in visita al Centro di Riferimento Ipertensione Arteriosa e Malattie Cardiovascolari della regione Marche – nonché Hypertension Excellence Centre della European Society of Hypertension (ESH) e Centro della Società Italiana dell’Ipertensione Arteriosa (SIIA) – su invio del proprio medico di medicina generale per scarso controllo dei valori pressori domiciliari nonostante terapia farmacologica. Nega angor, dispnea, sincopi, cardiopalmo e claudicatio. L’anamnesi per altri attori di rischio cardiovascolare evidenziano che si tratta di un fumatore attivo (1 pacchetto al giorno da 20 anni) e che non esercita attività fisica. Nega, inoltre, il consumo di alcolici e la presenza di apnee notturne. Dall’anamnesi familiare emerge una familiarità per ictus/infarto miocardico acuto (IMA), con il padre morto all’improvviso all’età di 77 anni e una madre ipertesa, diabetica e dislipidemica.
L’anamnesi di patologica remota indica:
- ipertensione arteriosa in trattamento farmacologico;
- ipercolesterolemia in trattamento farmacologico;
- “bronchite cronica” con spirometria negativa per broncopneumopatia cronica ostruttiva (BPCO), con storia di polmonite monolaterale nel 2019;
- ateromasia carotidea del 30/35% a livello della carotide interna sinistra;
- ipertrofia concentrica ventricolo sinistro.
Anamnesi patologica prossima
Il paziente è in corso di terapia con simvastatina 20 mg, valsartan 40 mg (1 compressa alle ore 8.00 e 20.00) e acido folico.
I valori pressori alla misurazone simultanea bilaterale risultano essere i seguenti:
- Braccio sinistro: 127/77 mmHg
- Braccio destro: 133/79 mmHg
- Frequenza cardiaca: 65 bpm
In data 4 Aprile 2022 viene eseguito l’esame strumentale ecocardiografico che rileva: ventricolo sinistro con ipertrofia concentrica, dimensioni cavitarie e funzione sistolica conservata; lieve insufficienza mitralica; fibrosclerosi valvolare aortica tricuspide con insufficienza lieve-moderata; vena cava inferiore non dilatata e normocollassante; aorta di normali dimensioni; versamento pericardico assente; bulging del setto interatriale senza evidenza di shunt.
Gli esiti degli esami biochimici sono i seguenti:
| Parametro | Esito |
| Ematocrito (HCT) | 44,20% |
| Leucociti (WBC) | 8.220/mmc |
| Conta piastrinica (PLT) | 200.000/mmc |
| Glicemia | 92 mg/dL |
| Emoglobina (Hb) | 14,9 g/dL |
| Emoglobina glicosilata (HbA1c) | 4,10% |
| Urea | 60 mg/dL |
| Creatinina | 0,88 mg/dL |
| Velocità di filtrazione glomerulare (eGFR) | 88 mL/min/1,73 mq |
| Sodio | 140 mmol/L |
| Potassio | 4,2 mmol/L |
| Aspartato Aminotransferasi (AST) | 24 U/L |
| Alanina aminotransferasi (ALT) | 28 U/L |
| Gamma-glutamil transferasi (GGT) | 38 U/L |
| Colesterolo totale | 208 mg/dL |
| Colesterolo HDL | 45 mg/dL |
| Colesterolo LDL | 127 mg/dL |
| Trigliceridi | 224 mg/dL |
Conclusioni cliniche
Il paziente presenta ipertensione arteriosa apparentemente controllata dalla blanda terapia in atto. Considerata, però, la presenza di un importante danno d’organo (ipertrofia ventricolare sinistra concentrica) e la discrepanza rispetto ai valori pressori osservati al domicilio, si deciderà di procedere allo studio della pressione arteriosa nelle 24 ore tramite monitoraggio automatico (ABPM; Ambulatory Blood Pressure Monitoring), in quanto trattasi probabilmente di ipertensione mascherata, potenzialmente con elevati livelli notturni o in alcune fasce orarie della giornata.
Si denota, inoltre, la presenza di un danno vascolare aterosclerotico con elevati livelli di colesterolemia LDL non controllati dalla terapia in corso di soli 20 mg di simvastatina, una combinazione statina/dosaggio ascrivibile ad una intensità medio-bassa. Si consiglia di potenziare la terapia passando ad associazione precostituita in singola compressa rosuvastatina+ASA 20 mg/100 mg associando anche ezetimibe 10 mg per abbassare ulteriormente i livelli di colesterolo di un altro 18-20%. Tale decisione è stata presa in considerazione di diversi fattori, tra cui la necessità di raggiungere valori plasmatici di LDL inferiori ad almeno 70 mg/dL o, idealmente, anche inferiori a 55 mg/dL per ridurre efficacemente il livello di rischio cardiovascolare (tematica oggetto di discussione nel paragrafo successivo). L’elevato rischio cardiovascolare stimato sulla base delle linee guida dell’European Atherosclerosis Society (EAS) 2019 e mediante l’algoritmo SCORE2 (Figura 2) anche facendo uso della valutazione rapida del rischio cardiovascolare con la web-app www.humtelemed.it (Figura 3). Il paziente, oltre ai fattori di rischio considerati dalle linee guida e dallo SCORE2, presenta ipertrofia concentrica del ventricolo sinistro, un fattore di rischio cardiovascolare tra i più potenti ma che non rientra “in automatico” negli algoritmi della valutazione del rischio, e ha anche familiarità positiva per patologie cardiovascolari, per quanto non con eventi precoci. Sicuramente sorprende l’apparente controllo pressorio con la blanda terapia antipertensiva che assumeva e che contrasta con il danno d’organo cardiaco, una discrepanza da indagare ulteriormente con monitoraggio pressorio delle 24 ore. L’insieme di questi fattori concorre a determinare un elevato rischio di “instabilità di placca”, ragion per cui è stato ritenuto opportuno introdurre la terapia antiaggregante con ASA 100 mg che potesse proteggere al meglio il paziente, anche in considerazione dell’assenza in anamnesi patologica remota di patologie gastrointestinali, nonché assenza di allergie a farmaci antinfiammatori non steroidei.
Discussione e considerazioni
Le indicazioni dell’antiaggregante in prevenzione primaria si sono molto ristrette negli ultimi anni a fronte delle evidenze di rischio di sanguinamento che può superare i benefici in molti pazienti. In questo paziente, fumatore attivo senza adeguato controllo dei livelli di colesterolo LDL e con documentate placche stenosanti carotidee, la valutazione rischio-beneficio è andata a favore dell’integrazione dell’antiaggregante nella terapia (3,4,29).
In clinica, la valutazione si concentra spesso sulla gravità della stenosi, considerando una stenosi del 50% o superiore come una lesione che mette il paziente a rischio molto elevato, il che richiede l’abbassamento dei livelli di LDL al di sotto dei 55 mg/dL e di almeno il 50% dei valori basali. In questo caso, è stato considerato opinabile in quanto, ad esempio, la maggior parte degli infarti derivano da placche “instabili” che stenotizzano coronarie meno del 50%. In questo paziente, non si avevano informazioni sullo stato delle coronarie e, per decidere se il rischio fosse elevato o molto elevato, si potrebbe procedere con TAC al cuore per calcium score, poiché una TAC coronarica con contrasto in paziente asintomatico non è propriamente indicata.
Ad ogni modo, anche senza svolgere ulteriori indagini, l’insieme dei fattori di rischio ci ha portati a identificare una condizione di rischio “molto elevato”, con una colesterolemia LDL con livelli più del doppio di quelli considerati “protettivi” e, di conseguenza, elevata probabilità di placche instabili potenzialmente anche a livello coronarico.
Sarebbe inoltre fondamentale che il paziente smettesse di fumare; ciononostante, non è infrequente, tra i pazienti affetti da tabagismo, che questi non riescano a liberarsi da questa abitudine, ed è quindi nostro dovere proteggerli nonostante il fumo. Se dovesse smettere di fumare, dopo circa un anno di colesterolo LDL sotto la soglia dei 55 mg/dL si potrebbe ottenere, con elevata probabilità, una “stabilizzazione” delle placche aterosclerotiche (sempre multidistrettuali), e quindi la necessità dell’antiaggregante potrebbe essere rivista dato un relativo aumento del rapporto rischio/beneficio.
Infine, al controllo del profilo lipidico, sarà anche chiesto un dosaggio delle Lipoproteina (A), altro noto fattore di rischio lipidico che potrebbe modificare le considerazioni sul rischio cardiovascolare di questa comune tipologia di pazienti.
Bibliografia
- Rippe JM. Lifestyle Strategies for Risk Factor Reduction, Prevention, and Treatment of Cardiovascular Disease. Am J Lifestyle Med. 2 dicembre 2018;13(2):204–12.
- Agenzia Italiana del Farmaco (AIFA). L’uso dei farmaci in Italia – Rapporto OsMed 2021 [Internet]. 2022. Disponibile su: https://www.aifa.gov.it/documents/20142/1740782/Rapporto-OsMed-2021.pdf
- Authors/Task Force Members, ESC Committee for Practice Guidelines (CPG), ESC National Cardiac Societies. 2019 ESC/EAS guidelines for the management of dyslipidaemias: Lipid modification to reduce cardiovascular risk. Atherosclerosis. novembre 2019;290:140–205.
- Arnett DK, Blumenthal RS, Albert MA, Buroker AB, Goldberger ZD, Hahn EJ, et al. 2019 ACC/AHA Guideline on the Primary Prevention of Cardiovascular Disease: Executive Summary: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 10 settembre 2019;140(11):e563–95.
- Cholesterol Treatment Trialists’ (CTT) Collaboration, Baigent C, Blackwell L, Emberson J, Holland LE, Reith C, et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet Lond Engl. 13 novembre 2010;376(9753):1670–81.
- Mills EJ, Rachlis B, Wu P, Devereaux PJ, Arora P, Perri D. Primary prevention of cardiovascular mortality and events with statin treatments: a network meta-analysis involving more than 65,000 patients. J Am Coll Cardiol. 25 novembre 2008;52(22):1769–81.
- Shepherd J, Cobbe SM, Ford I, Isles CG, Lorimer AR, MacFarlane PW, et al. Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. West of Scotland Coronary Prevention Study Group. N Engl J Med. 16 novembre 1995;333(20):1301–7.
- Corsini A, Ferri N, Cortellaro M. Are pleiotropic effects of statins real? Vasc Health Risk Manag. 2007;3(5):611–3.
- Krychtiuk KA, Ahrens I, Drexel H, Halvorsen S, Hassager C, Huber K, et al. Acute LDL-C reduction post ACS: strike early and strike strong: from evidence to clinical practice. A clinical consensus statement of the Association for Acute CardioVascular Care (ACVC), in collaboration with the European Association of Preventive Cardiology (EAPC) and the European Society of Cardiology Working Group on Cardiovascular Pharmacotherapy. Eur Heart J Acute Cardiovasc Care. 27 dicembre 2022;11(12):939–49.
- Cortese F, Gesualdo M, Cortese A, Carbonara S, Devito F, Zito A, et al. Rosuvastatin: Beyond the cholesterol-lowering effect. Pharmacol Res. maggio 2016;107:1–18.
- Bellosta S, Ferri N, Bernini F, Paoletti R, Corsini A. Non-lipid-related effects of statins. Ann Med. aprile 2000;32(3):164–76.
- Walter DH, Rittig K, Bahlmann FH, Kirchmair R, Silver M, Murayama T, et al. Statin therapy accelerates reendothelialization: a novel effect involving mobilization and incorporation of bone marrow-derived endothelial progenitor cells. Circulation. 25 giugno 2002;105(25):3017–24.
- Shapiro MD, Fazio S. From Lipids to Inflammation: New Approaches to Reducing Atherosclerotic Risk. Circ Res. 19 febbraio 2016;118(4):732–49.
- Davidson MH. Rosuvastatin safety: lessons from the FDA review and post-approval surveillance. Expert Opin Drug Saf. novembre 2004;3(6):547–57.
- Jones PH, Davidson MH, Stein EA, Bays HE, McKenney JM, Miller E, et al. Comparison of the efficacy and safety of rosuvastatin versus atorvastatin, simvastatin, and pravastatin across doses (STELLAR* Trial). Am J Cardiol. 15 luglio 2003;92(2):152–60.
- Schuster H, Barter PJ, Stender S, Cheung RC, Bonnet J, Morrell JM, et al. Effects of switching statins on achievement of lipid goals: Measuring Effective Reductions in Cholesterol Using Rosuvastatin Therapy (MERCURY I) study. Am Heart J. aprile 2004;147(4):705–13.
- Ballantyne CM, Bertolami M, Hernandez Garcia HR, Nul D, Stein EA, Theroux P, et al. Achieving LDL cholesterol, non-HDL cholesterol, and apolipoprotein B target levels in high-risk patients: Measuring Effective Reductions in Cholesterol Using Rosuvastatin therapY (MERCURY) II. Am Heart J. maggio 2006;151(5):975.e1-9.
- Long SB, Blaha MJ, Blumenthal RS, Michos ED. Clinical utility of rosuvastatin and other statins for cardiovascular risk reduction among the elderly. Clin Interv Aging. 2011;6:27–35.
- Bellosta S, Corsini A. Statin drug interactions and related adverse reactions: an update. Expert Opin Drug Saf. gennaio 2018;17(1):25–37.
- Nissen SE, Nicholls SJ, Sipahi I, Libby P, Raichlen JS, Ballantyne CM, et al. Effect of very high-intensity statin therapy on regression of coronary atherosclerosis: the ASTEROID trial. JAMA. 5 aprile 2006;295(13):1556–65.
- Ballantyne CM, Raichlen JS, Nicholls SJ, Erbel R, Tardif JC, Brener SJ, et al. Effect of rosuvastatin therapy on coronary artery stenoses assessed by quantitative coronary angiography: a study to evaluate the effect of rosuvastatin on intravascular ultrasound-derived coronary atheroma burden. Circulation. 13 maggio 2008;117(19):2458–66.
- Crouse JR, Raichlen JS, Riley WA, Evans GW, Palmer MK, O’Leary DH, et al. Effect of rosuvastatin on progression of carotid intima-media thickness in low-risk individuals with subclinical atherosclerosis: the METEOR Trial. JAMA. 28 marzo 2007;297(12):1344–53.
- Underhill HR, Yuan C, Zhao XQ, Kraiss LW, Parker DL, Saam T, et al. Effect of rosuvastatin therapy on carotid plaque morphology and composition in moderately hypercholesterolemic patients: a high-resolution magnetic resonance imaging trial. Am Heart J. marzo 2008;155(3):584.e1-8.
- Ridker PM, Danielson E, Fonseca FAH, Genest J, Gotto AM, Kastelein JJP, et al. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med. 20 novembre 2008;359(21):2195–207.
- Karlson BW, Barter PJ, Palmer MK, Lundman P, Nicholls SJ. Comparison of the effects of different statins and doses on lipid levels in patients with diabetes: results from VOYAGER. Nutr Metab Cardiovasc Dis NMCD. settembre 2012;22(9):697–703.
- Murphy E, Curneen JMG, McEvoy JW. Aspirin in the Modern Era of Cardiovascular Disease Prevention. Methodist DeBakey Cardiovasc J. 2021;17(4):36–47.
- Berger JS, Brown DL, Becker RC. Low-dose aspirin in patients with stable cardiovascular disease: a meta-analysis. Am J Med. gennaio 2008;121(1):43–9.
- Coccheri S. Use and Misuse of Aspirin in Primary Cardiovascular Prevention. Clin Med Insights Cardiol. 2017;11:1179546817702149.
- Visseren FLJ, Mach F, Smulders YM, Carballo D, Koskinas KC, Bäck M, et al. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice: Developed by the Task Force for cardiovascular disease prevention in clinical practice with representatives of the European Society of Cardiology and 12 medical societies With the special contribution of the European Association of Preventive Cardiology (EAPC). Eur Heart J. 7 settembre 2021;42(34):3227–337.
- Marcello Arca. L’aderenza alla terapia ipocolesterolemizzante. Rivista Società Italiana di Medicina Generale. n 2014;34–41.
- Shroufi A, Powles JW. Adherence and chemoprevention in major cardiovascular disease: a simulation study of the benefits of additional use of statins. J Epidemiol Community Health. febbraio 2010;64(2):109–13.
- Bloom JM. Rosuvastatin, C-reactive protein, LDL cholesterol, and the JUPITER trial. The Lancet. 4 luglio 2009;374(9683):25–6.
- Maggi P, De Socio GV, Cicalini S, D’Abbraccio M, Dettorre G, Di Biagio A, et al. Statins and aspirin in the prevention of cardiovascular disease among HIV-positive patients between controversies and unmet needs: review of the literature and suggestions for a friendly use. AIDS Res Ther. 24 maggio 2019;16(1):11.
- SCORE2 working group and ESC Cardiovascular risk collaboration. SCORE2 risk prediction algorithms: new models to estimate 10-year risk of cardiovascular disease in Europe. Eur Heart J. 2021 Jul 1;42(25):2439-2454. doi: 10.1093/eurheartj/ehab309.PMID: 34120177; PMCID: PMC8248998
Introduzione
Le malattie cardiovascolari (CV) rappresentano ancora oggi la principale causa di mortalità in Italia e comportano un elevato costo economico e sanitario. Per ridurre l’incidenza di eventi CV fatali e non fatali (come la coronaropatia, l’ictus ischemico e l’arteriopatia periferica), è necessario agire sui fattori di rischio modificabili, tra cui il fumo, l’attività fisica, l’alimentazione, la pressione arteriosa, il diabete di tipo 2 e la dislipidemia (1). In particolare, la dislipidemia e i livelli di colesterolo LDL – il cosiddetto “colesterolo cattivo” – rappresentano i primi obiettivi per la prevenzione delle malattie CV.
L’osservatorio nazionale sull’impiego dei medicinali (OsMed) riporta che, nel 2021, il 13,5% della popolazione italiana ha utilizzato agenti ipolipemizzanti, percentuale che aumenta al 47,9% se si considerano esclusivamente i soggetti affetti da dislipidemia (2). Le statine, in particolare rosuvastatina e atorvastatina, costituiscono la categoria terapeutica maggiormente utilizzata, indipendentemente dal tipo di dislipidemia, con una prevalenza del 39,7% (2).
La terapia statinica
Da più di 30 anni, le statine vengono impiegate come efficace strumento terapeutico ipolipemizzante al fine di ridurre l’incidenza di eventi CV; sono farmaci ampiamente studiati nella prevenzione delle malattie CV e svariati studi clinici randomizzati ne hanno dimostrato la capacità di rallentare, o addirittura invertire, la progressione dell’aterosclerosi (3–7). Le statine, oltre a ridurre il colesterolo LDL, possono avere effetti pleiotropici e antinfiammatori che potrebbero risultare utili nelle fasi iniziali del trattamento, specialmente in condizioni cliniche acute come la sindrome coronarica acuta (8,9).
Gli effetti benefici delle statine derivano dalla loro capacità di ridurre la biosintesi del colesterolo, queste agiscono infatti inibendo l’enzima 3-idrossi-3-metilglutaril coenzima A (HMG-CoA) reduttasi, responsabile della sintesi endogena del colesterolo. Questo meccanismo porta a una maggiore espressione dei recettori delle LDL sulla superficie cellulare, favorendo l’assorbimento sia del colesterolo LDL e che delle lipoproteine a bassissima densità (VLDL; Very Low Density Lipoprotein), riducendo così il livello complessivo di colesterolo nel sangue (10). Poiché la via metabolica del mevalonato – in cui l’enzima HMG-CoA reduttasi è coinvolto – produce una serie di isoprenoidi vitali per diverse funzioni cellulari, l’inibizione di HMG-CoA reduttasi può indurre svariati effetti pleiotropici indipendentemente dall’azione ipolipidemizzante (11). Alcuni di questi meccanismi hanno un’azione vascolare diretta inibendo la generazione di specie reattive dell’ossigeno, riducendo la secrezione di metalloproteinasi, aumentando l’attività fibrinolitica e favorendo l’attività dell’ossido nitrico sintetasi endoteliale (11). Alcune statine possiedono inoltre importanti proprietà immunomodulanti che contribuiscono al loro effetto benefico nell’aterosclerosi, al di là della riduzione del colesterolo (12,13). Infine, vi sono evidenze di proprietà quali l’inibizione della migrazione, proliferazione e adesione cellulare, che contribuiscono all’inibizione della crescita tumorale (11).
Rosuvastatina
Vi sono varie statine disponibili e che si differenziano per assorbimento, biodisponibilità, legame con le proteine plasmatiche, escrezione e solubilità, nonché per il loro costo per il sistema sanitario (10). Tra queste, la rosuvastatina ha dimostrato la sua efficacia in svariati trial clinici, studi in cui un basso dosaggio di questa statina è risultato essere più efficace nel ridurre i livelli di LDL rispetto ad altre statine come simvastatina, atorvastatina e pravastatina (14–17), rivelandosi essere, tra queste, l’agente più potente nella riduzione del rischio CV (10). Oltre alla riduzione dei livelli di colesterolo LDL e VLDL, la rosuvastatina agisce su altri aspetti del profilo lipidico, riducendo i livelli di trigliceridi (TG) e di apolipoproteina B (la principale proteina delle LDL). La rosuvastatina aumenta contemporaneamente la produzione delle lipoproteine ad alta densità (HDL), note come “colesterolo buono”, si presume attraverso la stimolazione della sintesi dell’apolipoproteina A (la principale proteina delle HDL) o l’inibizione del suo catabolismo e/o del trasferimento degli colesteril estere (15,18). Rosuvastatina agisce inoltre sui marcatori di infiammazione vascolare e rallenta l’ispessimento della placca aterosclerotica.
Rosuvastatina raggiunge la concentrazione plasmatica massima dopo circa 5 ore dall’assunzione orale e possiede una biodisponibilità assoluta di circa il 20% (19). Questo farmaco viene inoltre captato a livello epatico, il principale sito di sintesi del colesterolo e di eliminazione delle LDL. Nell’impiego di rosuvastatina, è importante considerare le possibili interazioni farmacologiche, in particolare, le statine possono interagire con inibitori del CYP3A4; è stato infatti osservato un aumento del rischio di rabdomiolisi nei casi di co-somministrazione di statine e alcuni farmaci (e.g. amiodarone, eritromicina, etc.). Il metabolismo delle statine può variare a seconda dell’isoenzima coinvolto; tuttavia, statine come rosuvastatina o fluvastatina presentano un vantaggio in termini di interazioni farmacologiche rispetto ad altre statine (19).
Numerosi trial clinici hanno dimostrato i benefici clinici del meccanismo d’azione della rosuvastatina. Tra questi, lo studio ASTEROID ha dimostrato come la terapia con rosuvastatina 40 mg/die porti a una significativa regressione delle stenosi vascolari (20,21). In questo studio, rosuvastatina ha consentito una riduzione del colesterolo LDL del 53,2%, riducendone i valori plasmatici medi da 130,4 mg/dL a 60,8 mg/dL, e contemporaneamente aumentando il colesterolo HDL del 14,7%, da valori plasmatici medi di 43,1 a 49,0 mg/dL (20). Inoltre, la rosuvastatina è risultata utile anche nella gestione dell’aterosclerosi carotidea, riducendo la progressione dello spessore dell’intima media e la percentuale di nucleo necrotico ricco di lipidi nell’ateroma (22,23). Un altro studio noto è lo studio JUPITER, interrotto prematuramente per via del notevole beneficio osservato nel braccio di trattamento con rosuvastatina rispetto al placebo. A circa due anni dall’inizio dello studio, rosuvastatina, somministrata alla dose di 20 mg/die, aveva comportato una riduzione del rischio di eventi CV (endpoint composito di infarto miocardico, ictus o morte per cause CV) pari al 55% nei pazienti che avevano raggiunto un livello di LDL inferiore a 70 mg/dL. Lo studio JUPITER ha inoltre preso in considerazione i livelli di proteina C reattiva (PCR), un biomarcatore dell’infiammazione e predittore del rischio CV su cui le statine agiscono riducendone i livelli. I pazienti che avevano raggiunto un valore di PCR inferiore a 2 mg/dL e a 1 mg/dL, insieme al target di LDL < 70 mg/dL, mostravano rispettivamente una riduzione del rischio CV pari al 65% e al 79% (Tabella 1) (24). Infine, un’importante meta-analisi derivata dal database VOYAGER – comprensivo dei dati 32.258 pazienti ottenuti da 37 studi differenti – afferma che, tra rosuvastatina, atorvastatina e simvastatina, rosuvastatina è la più efficace nel ridurre il colesterolo LDL e nel raggiungere i livelli lipidici target, soprattutto nei pazienti diabetici, sottolineando l’importanza di utilizzare una statina efficace alla dose appropriata per i pazienti ad alto rischio (25).
Oltre la monoterapia
Nonostante la terapia con statine sia generalmente efficace nella riduzione del rischio CV, alcuni pazienti non riescono ad ottenere un controllo sufficiente con la sola terapia statinica. In questi casi, è possibile adottare una terapia combinata, che includa l’impiego di una molecola dal meccanismo d’azione complementare per ottenere una migliore gestione del rischio CV. L’acido acetilsalicilico (ASA) è uno dei farmaci cardiovascolari più studiati nella storia della medicina. Questo farmaco ha una comprovata efficacia nella riduzione dell’incidenza di infarto miocardico, ictus o morte vascolare nei pazienti con malattia vascolare attraverso la sua azione anti-aterosclerotica (26). Nello specifico, la sua attività antiaggregante deriva dall’acetilazione della ciclossigenasi che inibisce perciò la sintesi del trombossano A2, una prostaglandina dalla potente azione pro-aggregante piastrinica e vasocostrittrice.
Dopo assunzione orale, ASA viene rapidamente assorbito nell’intestino tenue e convertito in acido salicilico per idrolisi e, successivamente, in acido glicinico e glucoronico. L’emivita di ASA è breve, equivalente a circa 15-20 minuti, mentre a dosi terapeutiche più elevate, la capacità di conversione dell’acido salicilico viene superata e la sua farmacocinetica diventa non lineare, comportando un prolungamento dell’emivita apparente di eliminazione dell’acido salicilico da poche ore a circa 24 ore. L’eliminazione avviene principalmente attraverso i reni, con l’acido salicilico che subisce un riassorbimento tubulare dipendente dal pH delle urine.
Un’importante meta-analisi ha valutato l’efficacia e i rischi di ASA a basso dosaggio (50-325 mg/die) in un totale di 9.853 pazienti affetti da malattia cardiovascolare stabile (27). Le possibili patologie cardiovascolari includevano precedente infarto miocardico, angina stabile o ictus/attacco ischemico transitorio. ASA a basso dosaggio è stata associata a una significativa riduzione del 21% del rischio di eventi cardiovascolari, del 26% del rischio di infarto miocardico non fatale, del 25% del rischio di ictus e del 13% del rischio di mortalità generale. Il trattamento di 1.000 pazienti per una durata media di 33 mesi avrebbe impedito 33 eventi cardiovascolari, 12 infarti miocardici non fatali, 25 ictus non fatali e 14 decessi, e causato 9 episodi di sanguinamento grave (27). Tutti i benefici menzionati superano i rischi di complicazioni emorragiche che possono essere associati ad ASA, rendendone l’impiego a basso dosaggio come adeguato nel contesto di prevenzione secondaria (28).
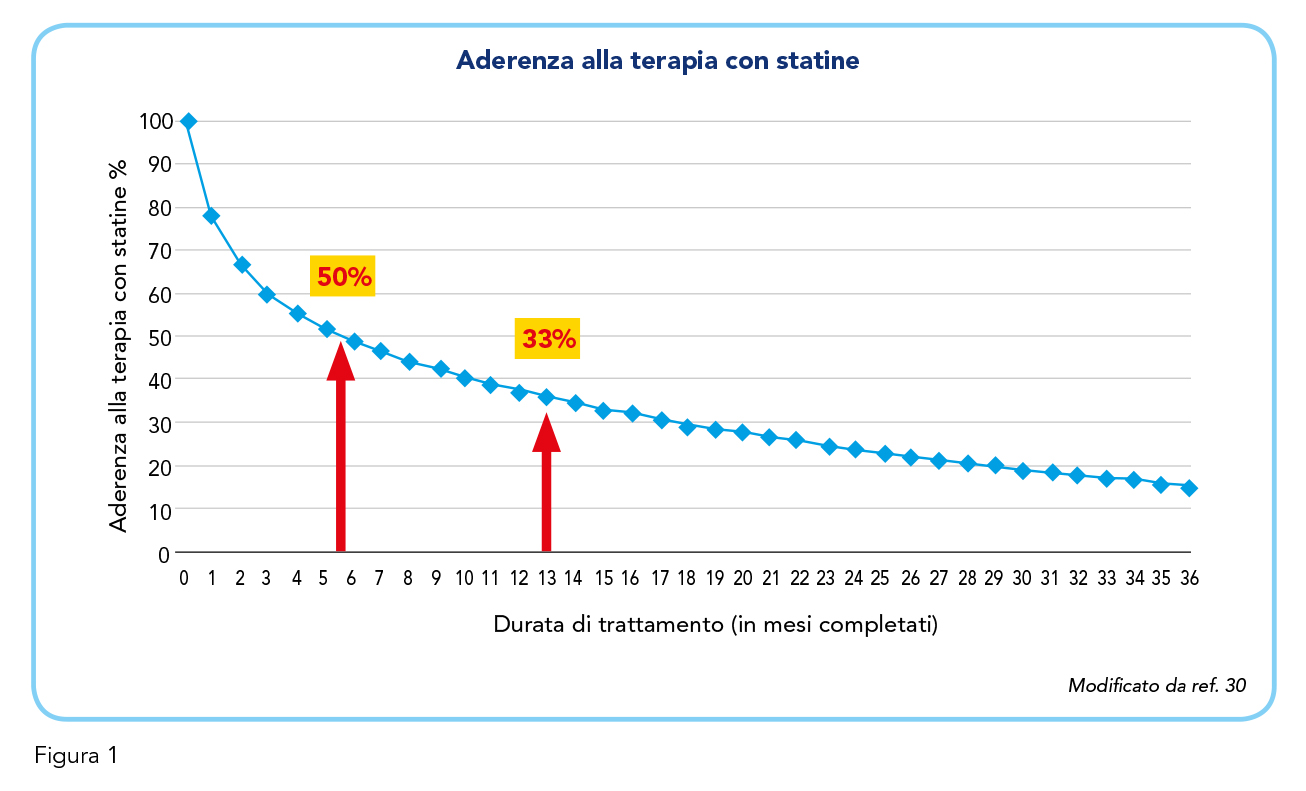
La combinazione di rosuvastatina e ASA rappresenta un’opzione terapeutica interessante per la prevenzione del rischio CV. Infatti, entrambi i farmaci hanno dimostrato un significativo effetto benefico nella riduzione del rischio aterosclerotico; la loro combinazione è indicata specificamente per la prevenzione secondaria nei soggetti che non sono adeguatamente controllati dalla monoterapia. I meccanismi d’azione dei due farmaci coinvolgono vie biochimiche distinte: l’una, rosuvastatina, riduce il principale fattore aterogeno, ossia il colesterolo contenuto nelle lipoproteine LDL e VLDL, e l’altro, ASA, interviene sull’aggregazione piastrinica, responsabile dei trombi. Inoltre, l’utilizzo delle due principi attivi in combinazione fissa semplifica lo schema terapeutico, favorendone l’aderenza di dei pazienti alla terapia che, secondo alcune stime, varia dal 50% per la prevenzione primaria della malattia CV aterosclerotica al 66% per la prevenzione secondaria (29). Alcuni dati riportano infatti un dimezzamento dell’aderenza alla terapia con statine intorno al sesto mese di trattamento (Figura 1) (30). Tra le ragioni della scarsa aderenza alla terapia statinica si annoverano la prescrizione di regimi terapeutici complessi, una mancata o scarsa comprensione della severità della malattia e una percezione di incertezza riguardo l’efficacia del trattamento (21). Secondo alcune stime, l’aumento dell’aderenza alla terapia statinica dal 50 al 75% sarebbe di per sé in grado di ridurre del doppio nuovi decessi legati alle complicanze CV (30,31). Questi dati sottolineano dunque l’importanza di un intervento terapeutico efficace che agevoli anche i pazienti più resistenti alla terapia a seguire uno schema d’uso, attraverso una sua semplificazione e un’adeguata informazione del paziente stesso.
Va sottolineato che l’aderenza e la persistenza adeguata alla terapia con ipolipemizzanti sono associati a una riduzione del rischio di eventi cardiovascolari. Il Rapporto OsMed del 2021 riporta un’analisi condotta sui nuovi utilizzatori di terapia ipolipemizzante di almeno 45 anni, seguiti per un anno, per valutare l’aderenza e la persistenza ai trattamenti cronici. È emerso che il 42,8% dei soggetti ha mostrato un’alta aderenza al trattamento, mentre il 15,1% ha mostrato una bassa aderenza (2). La bassa aderenza tende ad aumentare con l’età, con il valore più alto riscontrato negli ultra-ottantacinquenni e nelle donne. Nel complesso, meno della metà dei nuovi utilizzatori è risultata persistente al trattamento, con differenze regionali e gli uomini hanno mostrato percentuali di persistenza più elevate rispetto alle donne. L’aderenza e la persistenza alla terapia con statine risultano dunque essere importanti per ottenere i benefici attesi in termini di prevenzione cardiovascolare. Tuttavia, l’aderenza alla terapia con statine a lungo termine è limitata, il che comporta ricadute negative sulla salute pubblica e sui costi sanitari.
Il noto studio JUPITER, che ha coinvolto un vasto numero di partecipanti (n = 17.802), includeva il 16,6% di pazienti riceventi sia la terapia con rosuvastatina che ASA come anticoagulante (24). Jeffrey M. Bloom, un esperto in medicina interna con oltre 37 anni di esperienza, ha redatto un commento allo studio JUPITER pubblicato su The Lancet in cui ha discusso come si sarebbe dovuto prendere maggiormente in considerazione ASA come opzione anti-infiammatoria più economica (32). Nonostante l’elevato rischio cardiovascolare, solo una piccola percentuale dei partecipanti seguiva una terapia con ASA. È importante notare che le statine non solo riducono il colesterolo, ma hanno anche effetti antinfiammatori e antitrombotici. Bloom suggerisce che, se altri studi confermano i benefici del rosuvastatina in combinazione con ASA, si dovrebbe prendere in maggiore considerazione l’espansione di questa terapia (32).
È infine rilevante notare che la combinazione di statine e ASA ha un ruolo preventivo fondamentale nel ridurre la morbilità e la mortalità CV anche nei pazienti con infezione da HIV (33). In questa categoria di pazienti, infatti, la persistente attivazione immunitaria può accelerare l’aterosclerosi e, pertanto, l’intervento anti-infiammatorio congiunto delle due molecole fornisce un’ulteriore protezione CV. Una revisione delle evidenze in letteratura in merito ha portato gli autori a concludere che la terapia statinica vada intrapresa in tutti i pazienti con un rischio calcolato di eventi CV a 10 anni pari o superiore al 10%, suggerendo rosuvastatina come tra le prime molecole da impiegare (33). Mentre, per quanto riguarda ASA, questo dovrebbe essere sempre associata a una statina in prevenzione secondaria, mentre i clinici che si occupano di HIV dovrebbero incoraggiare fortemente la prescrizione e l’aderenza a questi farmaci (33).
In sintesi, rosuvastatina si afferma come una valida opzione terapeutica ipolipemizzante per la prevenzione di eventi CV e, nei pazienti in cui questa da sola non risulti sufficiente al controllo del rischio CV, la combinazione a dose fissa con ASA può ulteriormente ridurre il rischio aterosclerotico e agevolare lo schema terapeutico favorendo l’aderenza alla terapia.
Caso Clinico
Il signor Maurizio A., di anni 58, giunge in visita al Centro di Riferimento Ipertensione Arteriosa e Malattie Cardiovascolari della regione Marche – nonché Hypertension Excellence Centre della European Society of Hypertension (ESH) e Centro della Società Italiana dell’Ipertensione Arteriosa (SIIA) – su invio del proprio medico di medicina generale per scarso controllo dei valori pressori domiciliari nonostante terapia farmacologica. Nega angor, dispnea, sincopi, cardiopalmo e claudicatio. L’anamnesi per altri attori di rischio cardiovascolare evidenziano che si tratta di un fumatore attivo (1 pacchetto al giorno da 20 anni) e che non esercita attività fisica. Nega, inoltre, il consumo di alcolici e la presenza di apnee notturne. Dall’anamnesi familiare emerge una familiarità per ictus/infarto miocardico acuto (IMA), con il padre morto all’improvviso all’età di 77 anni e una madre ipertesa, diabetica e dislipidemica.
L’anamnesi di patologica remota indica:
- ipertensione arteriosa in trattamento farmacologico;
- ipercolesterolemia in trattamento farmacologico;
- “bronchite cronica” con spirometria negativa per broncopneumopatia cronica ostruttiva (BPCO), con storia di polmonite monolaterale nel 2019;
- ateromasia carotidea del 30/35% a livello della carotide interna sinistra;
- ipertrofia concentrica ventricolo sinistro.
Anamnesi patologica prossima
Il paziente è in corso di terapia con simvastatina 20 mg, valsartan 40 mg (1 compressa alle ore 8.00 e 20.00) e acido folico.
I valori pressori alla misurazone simultanea bilaterale risultano essere i seguenti:
- Braccio sinistro: 127/77 mmHg
- Braccio destro: 133/79 mmHg
- Frequenza cardiaca: 65 bpm
In data 4 Aprile 2022 viene eseguito l’esame strumentale ecocardiografico che rileva: ventricolo sinistro con ipertrofia concentrica, dimensioni cavitarie e funzione sistolica conservata; lieve insufficienza mitralica; fibrosclerosi valvolare aortica tricuspide con insufficienza lieve-moderata; vena cava inferiore non dilatata e normocollassante; aorta di normali dimensioni; versamento pericardico assente; bulging del setto interatriale senza evidenza di shunt.
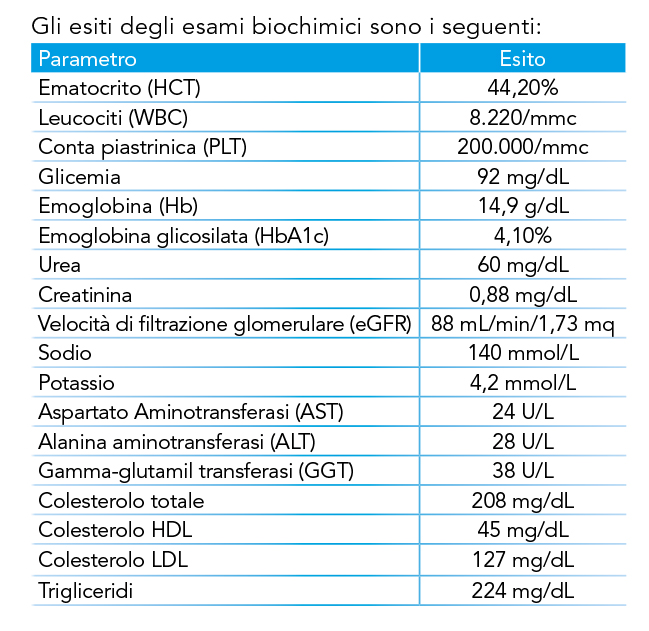
Gli esiti degli esami biochimici sono i seguenti:
| Parametro | Esito |
| Ematocrito (HCT) | 44,20% |
| Leucociti (WBC) | 8.220/mmc |
| Conta piastrinica (PLT) | 200.000/mmc |
| Glicemia | 92 mg/dL |
| Emoglobina (Hb) | 14,9 g/dL |
| Emoglobina glicosilata (HbA1c) | 4,10% |
| Urea | 60 mg/dL |
| Creatinina | 0,88 mg/dL |
| Velocità di filtrazione glomerulare (eGFR) | 88 mL/min/1,73 mq |
| Sodio | 140 mmol/L |
| Potassio | 4,2 mmol/L |
| Aspartato Aminotransferasi (AST) | 24 U/L |
| Alanina aminotransferasi (ALT) | 28 U/L |
| Gamma-glutamil transferasi (GGT) | 38 U/L |
| Colesterolo totale | 208 mg/dL |
| Colesterolo HDL | 45 mg/dL |
| Colesterolo LDL | 127 mg/dL |
| Trigliceridi | 224 mg/dL |
Conclusioni cliniche
Il paziente presenta ipertensione arteriosa apparentemente controllata dalla blanda terapia in atto. Considerata, però, la presenza di un importante danno d’organo (ipertrofia ventricolare sinistra concentrica) e la discrepanza rispetto ai valori pressori osservati al domicilio, si deciderà di procedere allo studio della pressione arteriosa nelle 24 ore tramite monitoraggio automatico (ABPM; Ambulatory Blood Pressure Monitoring), in quanto trattasi probabilmente di ipertensione mascherata, potenzialmente con elevati livelli notturni o in alcune fasce orarie della giornata.
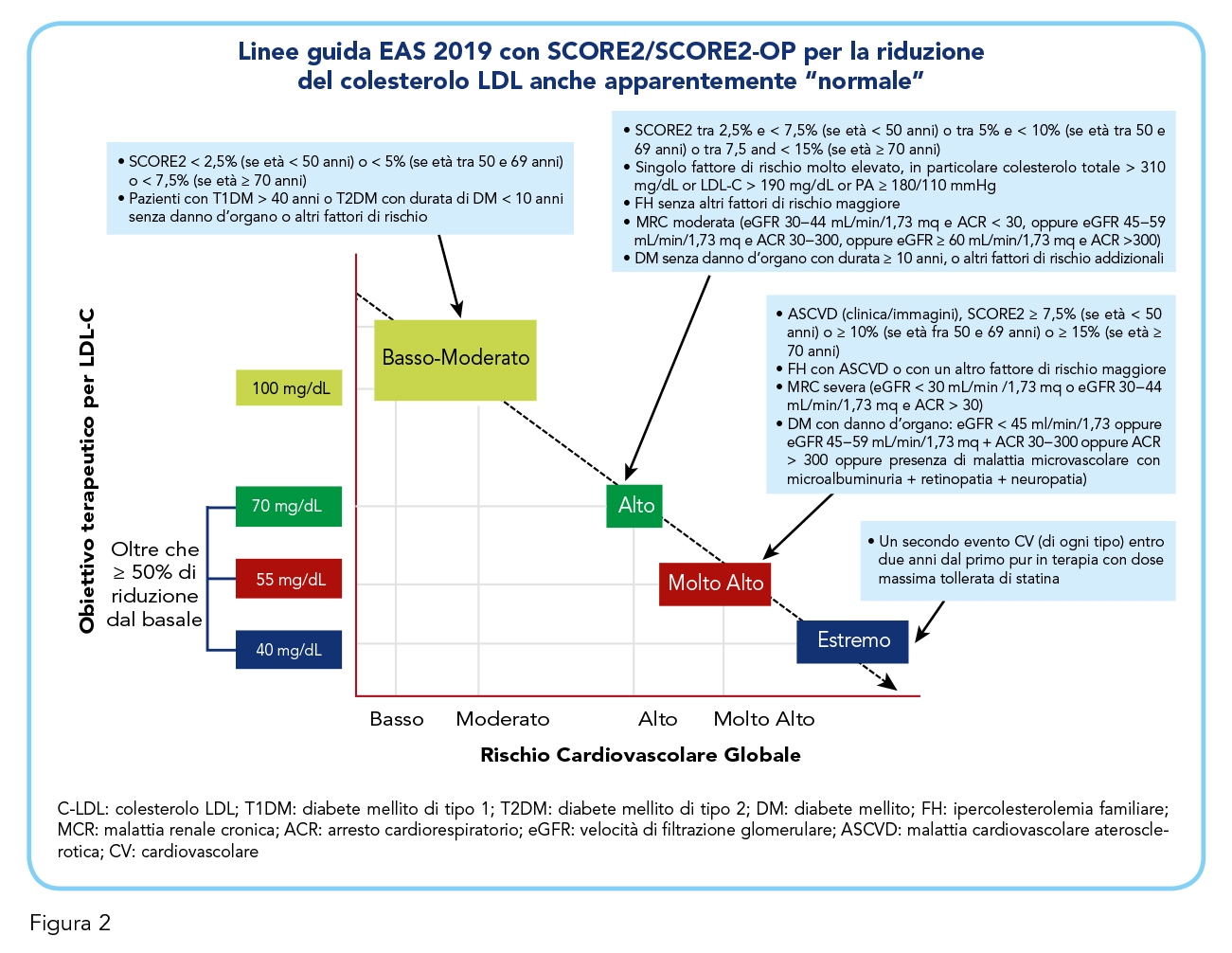
Si denota, inoltre, la presenza di un danno vascolare aterosclerotico con elevati livelli di colesterolemia LDL non controllati dalla terapia in corso di soli 20 mg di simvastatina, una combinazione statina/dosaggio ascrivibile ad una intensità medio-bassa. Si consiglia di potenziare la terapia passando ad associazione precostituita in singola compressa rosuvastatina+ASA 20 mg/100 mg associando anche ezetimibe 10 mg per abbassare ulteriormente i livelli di colesterolo di un altro 18-20%. Tale decisione è stata presa in considerazione di diversi fattori, tra cui la necessità di raggiungere valori plasmatici di LDL inferiori ad almeno 70 mg/dL o, idealmente, anche inferiori a 55 mg/dL per ridurre efficacemente il livello di rischio cardiovascolare (tematica oggetto di discussione nel paragrafo successivo). L’elevato rischio cardiovascolare stimato sulla base delle linee guida dell’European Atherosclerosis Society (EAS) 2019 e mediante l’algoritmo SCORE2 (Figura 2) anche facendo uso della valutazione rapida del rischio cardiovascolare con la web-app www.humtelemed.it (Figura 3). Il paziente, oltre ai fattori di rischio considerati dalle linee guida e dallo SCORE2, presenta ipertrofia concentrica del ventricolo sinistro, un fattore di rischio cardiovascolare tra i più potenti ma che non rientra “in automatico” negli algoritmi della valutazione del rischio, e ha anche familiarità positiva per patologie cardiovascolari, per quanto non con eventi precoci. Sicuramente sorprende l’apparente controllo pressorio con la blanda terapia antipertensiva che assumeva e che contrasta con il danno d’organo cardiaco, una discrepanza da indagare ulteriormente con monitoraggio pressorio delle 24 ore. L’insieme di questi fattori concorre a determinare un elevato rischio di “instabilità di placca”, ragion per cui è stato ritenuto opportuno introdurre la terapia antiaggregante con ASA 100 mg che potesse proteggere al meglio il paziente, anche in considerazione dell’assenza in anamnesi patologica remota di patologie gastrointestinali, nonché assenza di allergie a farmaci antinfiammatori non steroidei.
Discussione e considerazioni
Le indicazioni dell’antiaggregante in prevenzione primaria si sono molto ristrette negli ultimi anni a fronte delle evidenze di rischio di sanguinamento che può superare i benefici in molti pazienti. In questo paziente, fumatore attivo senza adeguato controllo dei livelli di colesterolo LDL e con documentate placche stenosanti carotidee, la valutazione rischio-beneficio è andata a favore dell’integrazione dell’antiaggregante nella terapia (3,4,29).
In clinica, la valutazione si concentra spesso sulla gravità della stenosi, considerando una stenosi del 50% o superiore come una lesione che mette il paziente a rischio molto elevato, il che richiede l’abbassamento dei livelli di LDL al di sotto dei 55 mg/dL e di almeno il 50% dei valori basali. In questo caso, è stato considerato opinabile in quanto, ad esempio, la maggior parte degli infarti derivano da placche “instabili” che stenotizzano coronarie meno del 50%. In questo paziente, non si avevano informazioni sullo stato delle coronarie e, per decidere se il rischio fosse elevato o molto elevato, si potrebbe procedere con TAC al cuore per calcium score, poiché una TAC coronarica con contrasto in paziente asintomatico non è propriamente indicata.
Ad ogni modo, anche senza svolgere ulteriori indagini, l’insieme dei fattori di rischio ci ha portati a identificare una condizione di rischio “molto elevato”, con una colesterolemia LDL con livelli più del doppio di quelli considerati “protettivi” e, di conseguenza, elevata probabilità di placche instabili potenzialmente anche a livello coronarico.
Sarebbe inoltre fondamentale che il paziente smettesse di fumare; ciononostante, non è infrequente, tra i pazienti affetti da tabagismo, che questi non riescano a liberarsi da questa abitudine, ed è quindi nostro dovere proteggerli nonostante il fumo. Se dovesse smettere di fumare, dopo circa un anno di colesterolo LDL sotto la soglia dei 55 mg/dL si potrebbe ottenere, con elevata probabilità, una “stabilizzazione” delle placche aterosclerotiche (sempre multidistrettuali), e quindi la necessità dell’antiaggregante potrebbe essere rivista dato un relativo aumento del rapporto rischio/beneficio.
Infine, al controllo del profilo lipidico, sarà anche chiesto un dosaggio delle Lipoproteina (A), altro noto fattore di rischio lipidico che potrebbe modificare le considerazioni sul rischio cardiovascolare di questa comune tipologia di pazienti.
Bibliografia
- Rippe JM. Lifestyle Strategies for Risk Factor Reduction, Prevention, and Treatment of Cardiovascular Disease. Am J Lifestyle Med. 2 dicembre 2018;13(2):204–12.
- Agenzia Italiana del Farmaco (AIFA). L’uso dei farmaci in Italia – Rapporto OsMed 2021 [Internet]. 2022. Disponibile su: https://www.aifa.gov.it/documents/20142/1740782/Rapporto-OsMed-2021.pdf
- Authors/Task Force Members, ESC Committee for Practice Guidelines (CPG), ESC National Cardiac Societies. 2019 ESC/EAS guidelines for the management of dyslipidaemias: Lipid modification to reduce cardiovascular risk. Atherosclerosis. novembre 2019;290:140–205.
- Arnett DK, Blumenthal RS, Albert MA, Buroker AB, Goldberger ZD, Hahn EJ, et al. 2019 ACC/AHA Guideline on the Primary Prevention of Cardiovascular Disease: Executive Summary: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 10 settembre 2019;140(11):e563–95.
- Cholesterol Treatment Trialists’ (CTT) Collaboration, Baigent C, Blackwell L, Emberson J, Holland LE, Reith C, et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet Lond Engl. 13 novembre 2010;376(9753):1670–81.
- Mills EJ, Rachlis B, Wu P, Devereaux PJ, Arora P, Perri D. Primary prevention of cardiovascular mortality and events with statin treatments: a network meta-analysis involving more than 65,000 patients. J Am Coll Cardiol. 25 novembre 2008;52(22):1769–81.
- Shepherd J, Cobbe SM, Ford I, Isles CG, Lorimer AR, MacFarlane PW, et al. Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. West of Scotland Coronary Prevention Study Group. N Engl J Med. 16 novembre 1995;333(20):1301–7.
- Corsini A, Ferri N, Cortellaro M. Are pleiotropic effects of statins real? Vasc Health Risk Manag. 2007;3(5):611–3.
- Krychtiuk KA, Ahrens I, Drexel H, Halvorsen S, Hassager C, Huber K, et al. Acute LDL-C reduction post ACS: strike early and strike strong: from evidence to clinical practice. A clinical consensus statement of the Association for Acute CardioVascular Care (ACVC), in collaboration with the European Association of Preventive Cardiology (EAPC) and the European Society of Cardiology Working Group on Cardiovascular Pharmacotherapy. Eur Heart J Acute Cardiovasc Care. 27 dicembre 2022;11(12):939–49.
- Cortese F, Gesualdo M, Cortese A, Carbonara S, Devito F, Zito A, et al. Rosuvastatin: Beyond the cholesterol-lowering effect. Pharmacol Res. maggio 2016;107:1–18.
- Bellosta S, Ferri N, Bernini F, Paoletti R, Corsini A. Non-lipid-related effects of statins. Ann Med. aprile 2000;32(3):164–76.
- Walter DH, Rittig K, Bahlmann FH, Kirchmair R, Silver M, Murayama T, et al. Statin therapy accelerates reendothelialization: a novel effect involving mobilization and incorporation of bone marrow-derived endothelial progenitor cells. Circulation. 25 giugno 2002;105(25):3017–24.
- Shapiro MD, Fazio S. From Lipids to Inflammation: New Approaches to Reducing Atherosclerotic Risk. Circ Res. 19 febbraio 2016;118(4):732–49.
- Davidson MH. Rosuvastatin safety: lessons from the FDA review and post-approval surveillance. Expert Opin Drug Saf. novembre 2004;3(6):547–57.
- Jones PH, Davidson MH, Stein EA, Bays HE, McKenney JM, Miller E, et al. Comparison of the efficacy and safety of rosuvastatin versus atorvastatin, simvastatin, and pravastatin across doses (STELLAR* Trial). Am J Cardiol. 15 luglio 2003;92(2):152–60.
- Schuster H, Barter PJ, Stender S, Cheung RC, Bonnet J, Morrell JM, et al. Effects of switching statins on achievement of lipid goals: Measuring Effective Reductions in Cholesterol Using Rosuvastatin Therapy (MERCURY I) study. Am Heart J. aprile 2004;147(4):705–13.
- Ballantyne CM, Bertolami M, Hernandez Garcia HR, Nul D, Stein EA, Theroux P, et al. Achieving LDL cholesterol, non-HDL cholesterol, and apolipoprotein B target levels in high-risk patients: Measuring Effective Reductions in Cholesterol Using Rosuvastatin therapY (MERCURY) II. Am Heart J. maggio 2006;151(5):975.e1-9.
- Long SB, Blaha MJ, Blumenthal RS, Michos ED. Clinical utility of rosuvastatin and other statins for cardiovascular risk reduction among the elderly. Clin Interv Aging. 2011;6:27–35.
- Bellosta S, Corsini A. Statin drug interactions and related adverse reactions: an update. Expert Opin Drug Saf. gennaio 2018;17(1):25–37.
- Nissen SE, Nicholls SJ, Sipahi I, Libby P, Raichlen JS, Ballantyne CM, et al. Effect of very high-intensity statin therapy on regression of coronary atherosclerosis: the ASTEROID trial. JAMA. 5 aprile 2006;295(13):1556–65.
- Ballantyne CM, Raichlen JS, Nicholls SJ, Erbel R, Tardif JC, Brener SJ, et al. Effect of rosuvastatin therapy on coronary artery stenoses assessed by quantitative coronary angiography: a study to evaluate the effect of rosuvastatin on intravascular ultrasound-derived coronary atheroma burden. Circulation. 13 maggio 2008;117(19):2458–66.
- Crouse JR, Raichlen JS, Riley WA, Evans GW, Palmer MK, O’Leary DH, et al. Effect of rosuvastatin on progression of carotid intima-media thickness in low-risk individuals with subclinical atherosclerosis: the METEOR Trial. JAMA. 28 marzo 2007;297(12):1344–53.
- Underhill HR, Yuan C, Zhao XQ, Kraiss LW, Parker DL, Saam T, et al. Effect of rosuvastatin therapy on carotid plaque morphology and composition in moderately hypercholesterolemic patients: a high-resolution magnetic resonance imaging trial. Am Heart J. marzo 2008;155(3):584.e1-8.
- Ridker PM, Danielson E, Fonseca FAH, Genest J, Gotto AM, Kastelein JJP, et al. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med. 20 novembre 2008;359(21):2195–207.
- Karlson BW, Barter PJ, Palmer MK, Lundman P, Nicholls SJ. Comparison of the effects of different statins and doses on lipid levels in patients with diabetes: results from VOYAGER. Nutr Metab Cardiovasc Dis NMCD. settembre 2012;22(9):697–703.
- Murphy E, Curneen JMG, McEvoy JW. Aspirin in the Modern Era of Cardiovascular Disease Prevention. Methodist DeBakey Cardiovasc J. 2021;17(4):36–47.
- Berger JS, Brown DL, Becker RC. Low-dose aspirin in patients with stable cardiovascular disease: a meta-analysis. Am J Med. gennaio 2008;121(1):43–9.
- Coccheri S. Use and Misuse of Aspirin in Primary Cardiovascular Prevention. Clin Med Insights Cardiol. 2017;11:1179546817702149.
- Visseren FLJ, Mach F, Smulders YM, Carballo D, Koskinas KC, Bäck M, et al. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice: Developed by the Task Force for cardiovascular disease prevention in clinical practice with representatives of the European Society of Cardiology and 12 medical societies With the special contribution of the European Association of Preventive Cardiology (EAPC). Eur Heart J. 7 settembre 2021;42(34):3227–337.
- Marcello Arca. L’aderenza alla terapia ipocolesterolemizzante. Rivista Società Italiana di Medicina Generale. n 2014;34–41.
- Shroufi A, Powles JW. Adherence and chemoprevention in major cardiovascular disease: a simulation study of the benefits of additional use of statins. J Epidemiol Community Health. febbraio 2010;64(2):109–13.
- Bloom JM. Rosuvastatin, C-reactive protein, LDL cholesterol, and the JUPITER trial. The Lancet. 4 luglio 2009;374(9683):25–6.
- Maggi P, De Socio GV, Cicalini S, D’Abbraccio M, Dettorre G, Di Biagio A, et al. Statins and aspirin in the prevention of cardiovascular disease among HIV-positive patients between controversies and unmet needs: review of the literature and suggestions for a friendly use. AIDS Res Ther. 24 maggio 2019;16(1):11.
- SCORE2 working group and ESC Cardiovascular risk collaboration. SCORE2 risk prediction algorithms: new models to estimate 10-year risk of cardiovascular disease in Europe. Eur Heart J. 2021 Jul 1;42(25):2439-2454. doi: 10.1093/eurheartj/ehab309.PMID: 34120177; PMCID: PMC8248998
Related papers
La pubblicazione recente di alcuni lavori scientifici basati sulle risultanze di alcuni osservatori epidemiologi mondiali, ha riportato alla ribalta il ruolo chiave delle malattie cardiovascolari come prima causa di morte e disabilità, non solo nel presente, ma anche nel futuro proiettato oggi al 2050 con un incremento più o meno equamente distribuito tra le malattie [more info]
1) Lipoproteine ed aterosclerosi Le lipoproteine sono particelle composte da un nucleo ricco in esteri del colesterolo e trigliceridi (TG) circondati da colesterolo libero, fosfolipidi e apolipoproteine. Le lipoproteine plasmatiche vengono suddivise in varie classi (VLDL, IDL, LDL, HDL e chilomicroni) in base alle dimensioni, alla composizione lipidica e alle apolipoproteine presenti (Tabella 1). I [more info]
Introduzione Le malattie cardiovascolari rappresentano la principale causa di morbilità e mortalità a livello globale, nonostante i progressi nella prevenzione e nel trattamento farmacologico. In questo contesto, l’adozione di strategie terapeutiche efficaci per la gestione dei fattori di rischio cardiovascolare è fondamentale. La combinazione farmacologica di farmaci con meccanismi d’azione complementari è diventata una pratica [more info]