BOARD SCIENTIFICO
Claudio Borghi, in qualità di responsabile scientifico
Professore Ordinario di Medicina Interna, Università di Bologna, Direttore Unità Operativa di Medicina Interna, Policlinico S. Orsola-Malpighi, Bologna
Stefano Carugo
Professore Associato Malattie dell’Apparato Cardiovascolare, Università degli Studi di Milano, Direttore UOC Cardiologia, Ospedale Maggiore Policlinico, Milano
Santina Cottone
Professore Ordinario di Nefrologia, Direttore UOSD di Nefrologia e Dialisi, AOUP Palermo, Palermo
Giovambattista Desideri
Professore Ordinario di Medicina Interna, Università degli Studi dell’Aquila, L’Aquila
Claudio Ferri
Direttore Scuola di Specialità in Medicina Interna, Università degli Studi dell’Aquila, L’Aquila
Vincenzo Montemurro
Responsabile Ambulatorio di Cardiologia, Presidio “Scillesi d’America” – Scilla ASP Reggio Calabria, Reggio Calabria
Maria Lorenza Muiesan
Professore Ordinario di Medicina Interna Università di Brescia, Brescia
Pasquale Perrone Filardi
Professore Ordinario di Cardiologia Università degli Studi Federico II, Napoli
Roberto Pontremoli
Professore Ordinario di Medicina Interna, Università degli Studi di Genova, Genova
Leonardo Punzi
Direttore Unità Operativa Complessa di Reumatologia, Azienda Ospedale Università di Padova, Padova
Giorgio Sesti
Professore ordinario di Medicina Interna presso l’Università La Sapienza di Roma, Roma
Pierfranco Terrosu
Responsabile Unità Operativa Complessa di Cardiologia, Asl Sassari, Sassari
SPECIALISTI PARTECIPANTI
Francesco Annunziata, Nola (NA)
Antonietta Baruffo, Napoli
Mario Armando Battista, Roma
Antonio Bonelli, Matera
Gesualdo Campolo, Prato
Caterina Carollo, Palermo
Valeria Cernaro, Messina
Rosa Paola Cerra, Catanzaro
Maria Elisabetta Cianchetti, Cagliari
Mario Cordoni, Piombino (LI)
Nicolò Dasseni, Brescia
Giovanni D’Avola, Catania
Giovanni Demicheli, Alessandria
Paolo Di Giosia, Ascoli Piceno
Elisabetta Di Meglio, Ischia (NA)
Salvatore Evola, Palermo
Oriana Fabrazzo, Pisa
Alessandra Fagnani, Monza (MB)
Anna Maria Ferrigno, Milano
Giovanni Gaudio, Somma Lombardo (VA)
Andrea Giorgi, Roma
Marco Giuggia, Settimo Torinese (TO)
Xhulia Gjoni, Monza (MB)
Alessandro Graziani, Ravenna
Patrizia Grimaldi, Messina
Kapya Kikonde, Santorso (VI)
Lucia La Mura, Angri (SA)
Salvatore Lenti, Andria (BT)
Paolo Lentini, Bassano Del Grappa (VI)
Alessandro Lo Nigro, Treviso
Alessandro Locatelli, Bergamo
Cristina Lovello, Roma
Alessandro Marchi, Pavia
Roberta Marcialis, Rivoli (TO)
Guido Mariani, Ascoli Piceno
Annamaria Masu, Lodi
Matilde Menchelli, Pisa
Giuseppe Mennella, Padova
Xenia Metcalf, Udine
Francesco Mingione, Caserta
Manuela Morini, Gubbio (PG)
Matteo Nardin, Vercelli
Giada Panascia, Catania
Alice Parisi, Pinerolo (TO)
Monica Peralta, Cagliari
Carlotta Perego, Agrate Brianza (MB)
Federica Piani, Bologna
Domenico Pontoriero, Tropea (VV)
Federica Portolan, Trento
Pasquale Predotti, Salerno
Giuseppe Restivo, Enna
Matteo Righini, Bologna e Ravenna
Stefano Rizza, Roma
Mario Rizzo, Enna
Calogero Rodofili, Roma
Mattia Rossi, Verona
Salvatore Ruosi, Caserta
Federico Ruosi, Caserta
Massimo Sainaghi, Milano
Anita Scarsella, Avezzano (AQ)
Alberto Sentimentale, Roma
Antonello Silvestri, Rocca Priora (RM)
Marco Simone, Milano
Pierangelo Tedesco, Foggia
Massimiliano Tosto, Palmanova (UD)
Antonella Ventresca, L’Aquila
- Contesto
Nel corso dell’ultimo decennio, l’interesse nei confronti del dismetabolismo dell’acido urico è cresciuto in maniera esponenziale. Tale attenzione emerge sia dalla crescente incidenza della malattia da deposito di urato che dalla recente individuazione di uno stretto nesso fisiopatologico tra dismetabolismo dell’acido urico e problematiche cardio-nefro-metaboliche. A differenza del recente passato in cui l’attenzione del clinico si soffermava solo sulla nefropatia da calcoli di acido urico e sulla gotta, osservando così solo la “punta dell’iceberg” del problema, sappiamo oggi che l’iperuricemia cronica con deposito di urato è associata a ipertensione, obesità, diabete mellito, malattie renali e cardiovascolari, oltre che a un’aumentata mortalità (1-3). Alla luce delle più recenti solide evidenze, inoltre, le linee guida ESC/ESH hanno incluso la valutazione dei livelli di uricemia tra le raccomandazioni per l’inquadramento clinico del paziente iperteso (4). Tuttavia, sebbene l’iperuricemia cronica con deposito di urato sia pienamente curabile, meno del 50% dei pazienti iperuricemici viene portato al target raccomandato dalle linee guida (5). La gestione terapeutica delle problematiche cliniche del dismetabolismo dell’acido urico è, infatti, ancora largamente inadeguata e subottimale, sia in termini di identificazione dei pazienti da trattare che di target terapeutici da raggiungere e di gestione farmacologica. Molti pazienti ricevono non di rado un trattamento solo “cosmetico”, inefficace al raggiungimento del target, peraltro mantenuto per un periodo di tempo limitato. Il problema è fin troppo spesso affrontato in maniera monodisciplinare − la più rilevante tra le criticità − e si fatica a raggiungere e mantenere i valori di uricemia al di sotto della soglia minima dei 6 mg/dL raccomandata dalle linee guida EULAR (5). A questo concorre spesso l’impiego di molecole non adeguatamente potenti e/o sottodosate rispetto al target da raggiungere.
Le conoscenze attuali possono consentire di giungere a una “quadratura del cerchio” nel dibattito sulla gestione adeguata del dismetabolismo dell’acido urico attraverso un confronto culturale e un dibattito scientifico partecipato che rappresentano ad oggi gli strumenti più adeguati all’acquisizione del consenso scientifico sul tema.
- Presentazione del progetto
In questo contesto si inscrive il progetto “Iperuricemia, depositi di urato e malattia cardio-nefro-metabolica: la quadratura del cerchio”, nato nel 2022 da MEDIABOUT S.r.l. Editore Scientifico e da un board scientifico costituito da esperti di riconosciuta competenza nell’ambito del dismetabolismo dell’acido urico. Il progetto si è delineato in tre fasi successive, di cui la prima, propedeutica allo sviluppo della progettualità, ha previsto un incontro del board scientifico durante il quale sono state definite le tematiche d’interesse ed è stato delineato il profilo degli specialisti che avrebbero preso parte al progetto. Nello specifico, sulla base delle molteplici evidenze disponibili e della ormai chiara e indispensabile necessità di un momento di riflessione multidisciplinare tra le figure professionali maggiormente coinvolte nella gestione del dismetabolismo dell’acido urico, sono stati identificati come target privilegiati del progetto gli specialisti di area cardio-nefro-metabolica e reumatologica con comprovata esperienza nella gestione del dismetabolismo dell’acido urico. Durante il primo confronto scientifico, il board ha anche elaborato un questionario in forma di survey online volto a fotografare la percezione del “problema iperuricemia” nella pratica clinica quotidiana degli specialisti partecipanti, allo scopo di identificare le aree di incertezza gestionale, in ragione di ciò maggiormente meritevoli di approfondimenti e chiarificazioni.
Nella seconda fase, attraverso la partecipazione attiva del gruppo di specialisti coinvolti, le risposte alla survey sono state elaborate statisticamente e analizzate dal punto di vista clinico da parte del board scientifico, al fine di evidenziare gli output oggetto di discussione nelle successive attività d’incontro sul territorio. Gli eventi realizzati a Bologna e Napoli hanno visto la partecipazione del board scientifico e degli 80 specialisti sia ospedalieri che ambulatoriali selezionati uniformemente in tutta Italia. Attraverso un confronto attivo ed articolato sui dati emersi dalla survey analizzati in relazione alle evidenze dalla letteratura, si è giunti alla definizione di statement per la gestione delle problematiche cliniche connesse al dismetabolismo dell’acido urico, oggetto della presente pubblicazione, ultimo step previsto dalla progettualità. Lo scopo ultimo era quello di sensibilizzare l’attenzione del medico nei confronti dell’iperuricemia cronica con deposito di urato, promuovere la ricerca intorno a questa problematica clinica e favorire una sua gestione patient-oriented più che disease-oriented, in linea con i dettami della medicina della complessità.
- Survey
In generale, gli esiti della survey hanno descritto una visione moderna sul tema dell’iperuricemia cronica con deposito di urato, in cui i frutti della diffusione delle conoscenze in tempi recenti riguardanti le implicazioni cardio-nefro-metaboliche sono divenuti temi di gestione pratica. Il campione dei medici partecipanti ha mostrato un’elevata attenzione e consapevolezza sul tema, e la valutazione dei livelli di acido urico – anche al di là della condizione di gotta – sembra essere ormai divenuto un aspetto di rilievo nella pratica clinica.
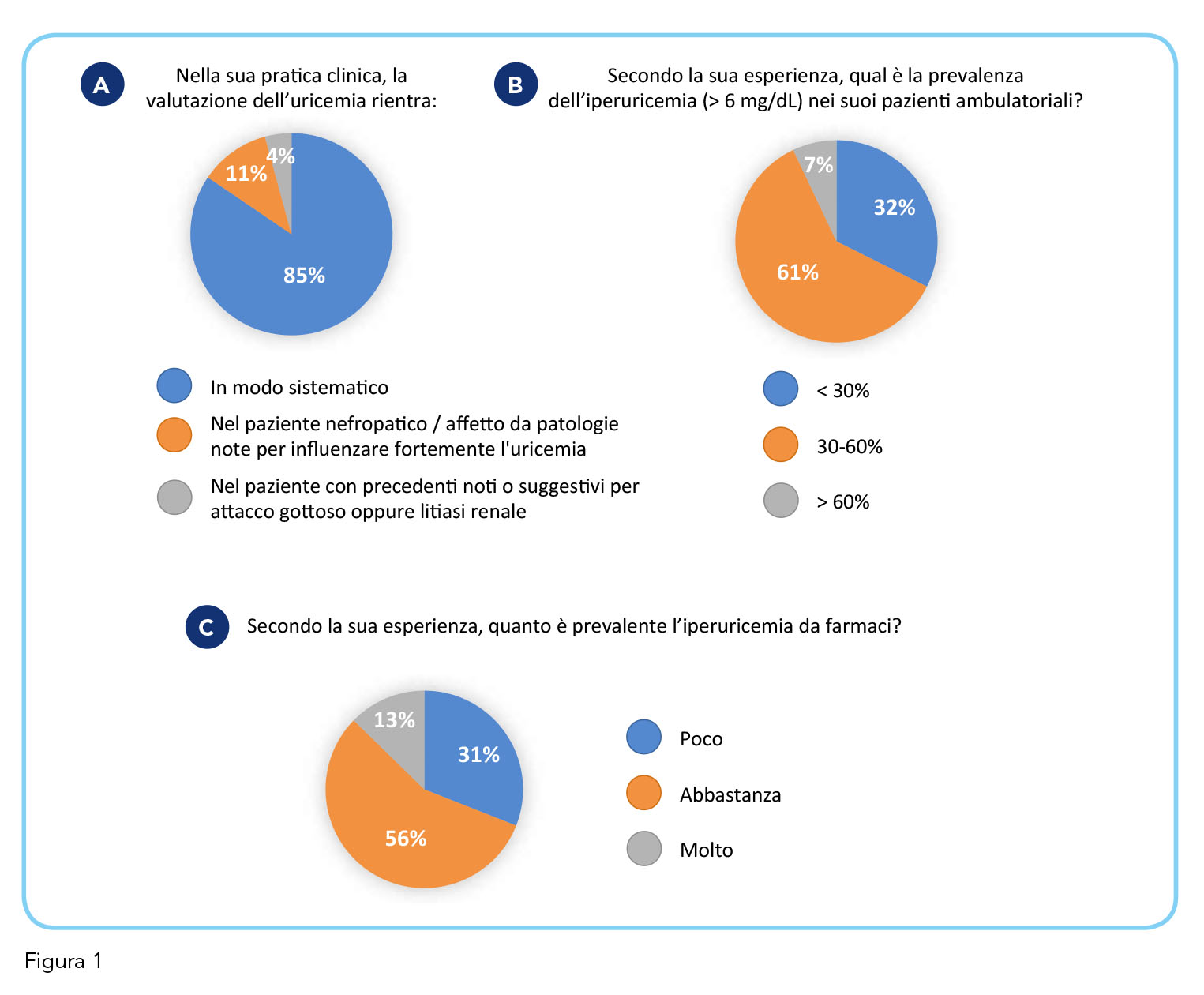
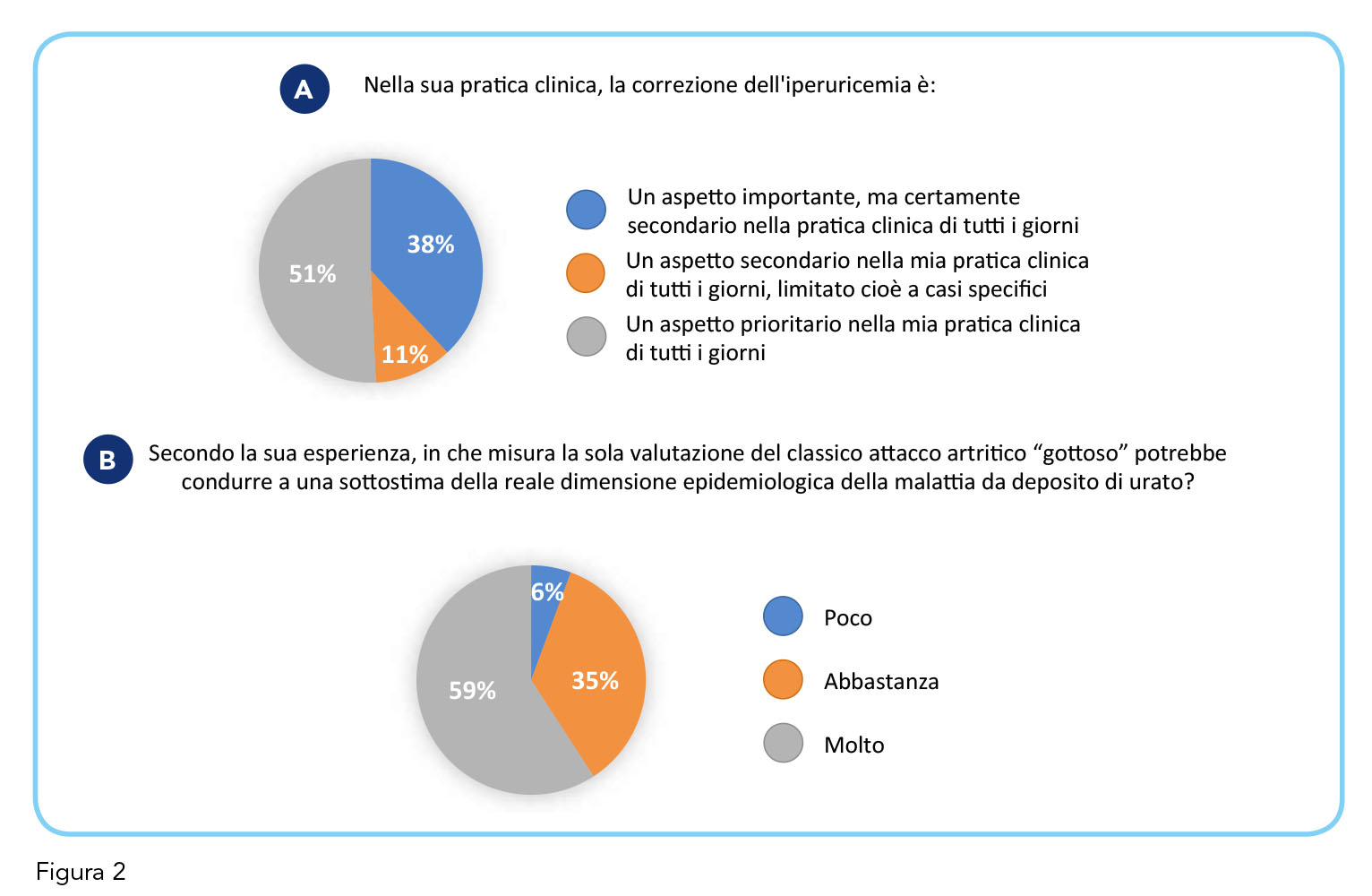
Secondo quanto emerso dalla survey, la valutazione dell’uricemia rientra in modo sistematico nella pratica clinica dell’85% dei medici, i quali nel 61% dei casi stimano la prevalenza dell’iperuricemia nei loro pazienti compresa tra il 30 e il 60%, con una non trascurabile rilevanza delle forme iatrogene nell’opinione del 56% dei medici (Figura 1, pannelli A, B, C). I dati epidemiologici invero confermano una prevalenza vicina al 61% dell’iperuricemia cronica in entrambi i sessi, soprattutto negli ultra 75enni (6). Rilevante è l’osservazione che la correzione del dismetabolismo dell’acido urico è ritenuto un aspetto prioritario dal 51% dei medici (Figura 2, pannello A). Inoltre, il 59% dei medici ritiene che la reale dimensione epidemiologica dell’iperuricemia cronica con deposito di urato sia sottostimata, poiché troppo spesso erroneamente identificata esclusivamente con il classico attacco artritico gottoso (Figura 2, pannello B). I dati di letteratura mostrano, invero, che tali depositi possono evidenziarsi in pazienti con livelli di acido urico > 6 mg/dL senza che questi presentino alcun segno clinico di gotta (6).
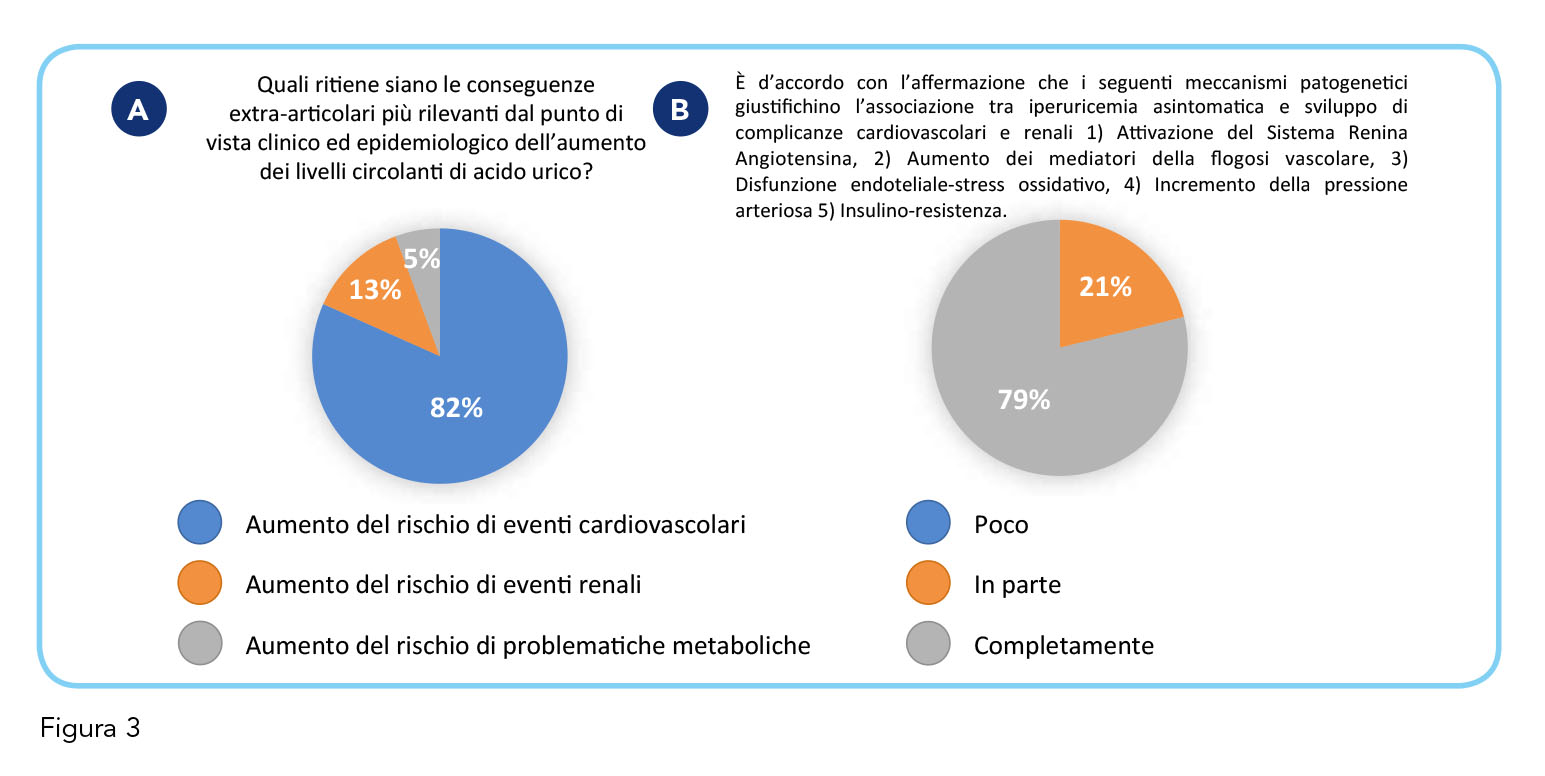
Il percepito delle implicazioni extra-articolari – e dei meccanismi fisiopatologici a esse sottostanti – da parte dei medici appare anch’esso al passo con le evidenze scientifiche, soprattutto per quanto riguarda le complicanze cardiovascolari, seguite da quelle renali e metaboliche. Circa l’80% dei medici ritiene che l’iperuricemia aumenti il rischio di eventi cardiovascolari ed è d’accordo che l’attivazione del sistema renina-angiotensina, l’aumento dei mediatori della flogosi vascolare, la disfunzione endoteliale-stress ossidativo, l’incremento della pressione arteriosa e l’insulino-resistenza siano tra i meccanismi responsabili dell’associazione tra iperuricemia cronica con e senza deposito di urato e complicanze cardiovascolari e renali (Figura 3, pannelli A e B).
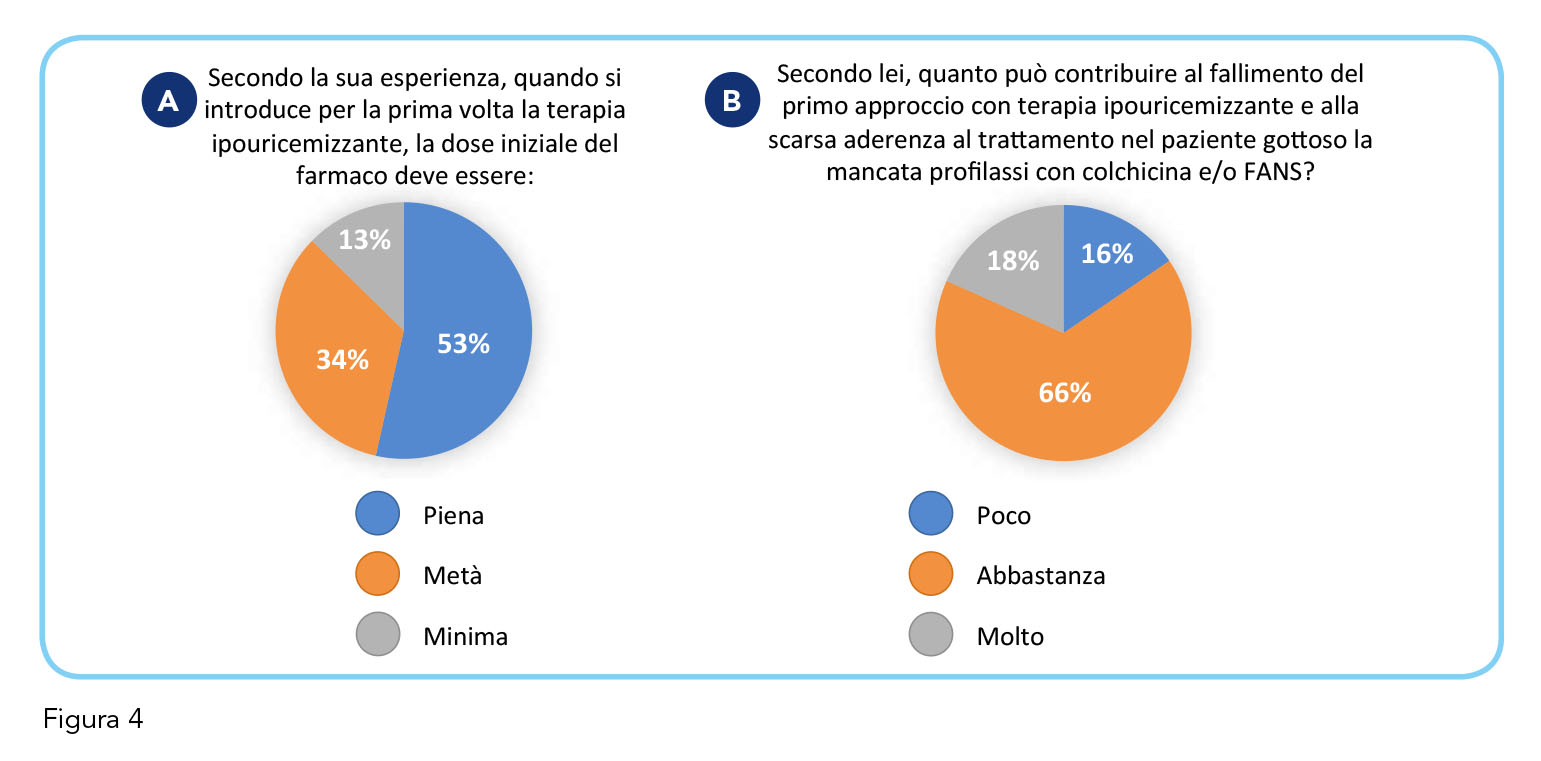
Come primo approccio al paziente, il 53% dei medici somministrerebbe la terapia ipouricemizzante a pieno dosaggio (come da indicazioni per ciascun farmaco); il 66% ritiene che il fallimento della terapia e la scarsa aderenza al trattamento siano dovuti alla mancata profilassi antinfiammatoria con colchicina e/o FANS (Figura 4, pannelli A e B).
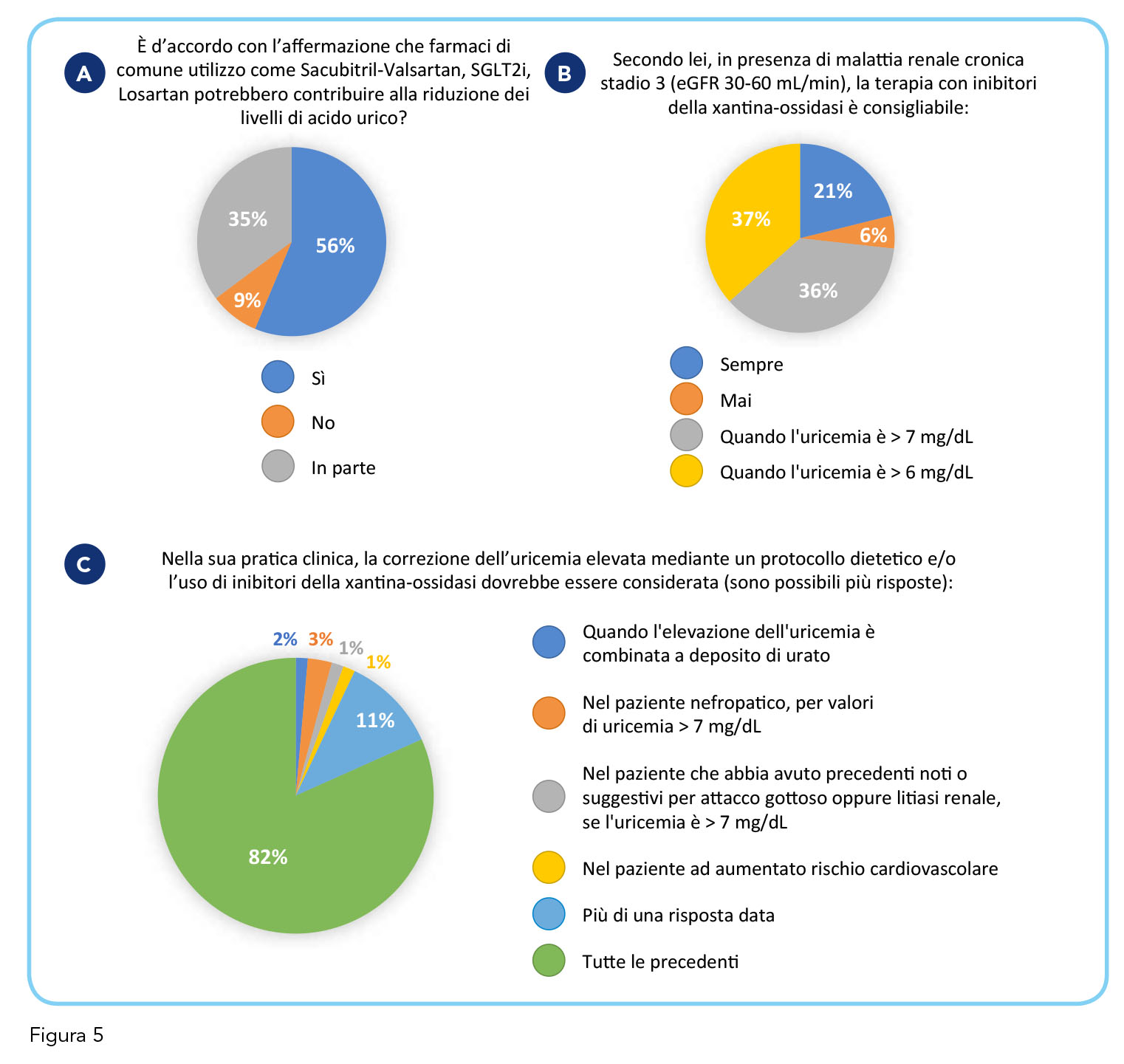
Sul tema dei farmaci cardiovascolari che hanno anche un documentato effetto sui livelli di uricemia, il 56% dei medici ritiene che farmaci quali sacubitril-valsartan, SGLT2 inibitori e losartan possono contribuire in modo non trascurabile a ridurre i livelli di acido urico, in linea con i dati della letteratura (7) (Figura 5, pannello A). Per quanto riguarda, invece, la presenza di malattia renale cronica di stadio 3, la maggior parte dei medici somministrerebbe inibitori della xantina-ossidasi (XO) per valori di uricemia > 6 mg/dL (37%) o > 7 mg/dL (36%) mentre il 21% degli intervistati li userebbero sempre (Figura 5, pannello B). Infine, la maggior parte dei medici sostiene che un protocollo dietetico e/o l’uso di inibitori della XO vadano considerati quando l’elevazione dell’uricemia è combinata a deposito di urato, quando un paziente nefropatico mostra valori di uricemia > 7,0 mg/dL, quando il paziente ha precedenti noti o suggestivi di attacco gottoso o litiasi renale e uricemia > 7,0 mg/dL o quando presenta un aumentato rischio cardiovascolare (Figura 5, pannello C).
Questa survey evidenzia, dunque, un approccio terapeutico moderno che contempla l’impiego di farmaci ad azione uricosurica indiretta per la gestione del paziente con comorbidità. Anche nel contesto della malattia renale cronica si denota un orientamento verso un intervento precoce che non attende l’instaurarsi di valori estremi di uricemia. Questi risultati ben fotografano l’opinione degli specialisti partecipanti nei riguardi di una condizione clinica che racchiude nei livelli plasmatici di un semplice prodotto del metabolismo un universo di conoscenze complesse che possono trovare la loro interpretazione solo in un contesto di collaborazione multidisciplinare. Ciononostante, esiste ancora una porzione rilevante di medici (il 15%, ossia 1 medico su 7) che non valuta sistematicamente l’uricemia nella sua pratica clinica e un 49% che ritiene la correzione dei suoi livelli un aspetto secondario e non prioritario. Sebbene si sia comunque evidenziata un’evoluzione nell’approccio gestionale dell’uricemia tra gli specialisti partecipanti rispetto a quello di un recente passato, rimangono dunque sia aree grigie di conoscenza da affrontare che nozioni da consolidare. è a partire da queste basi che sono state costruite le relazioni tenutesi nel corso degli eventi di Bologna e Napoli del progetto “Iperuricemia, depositi di urato e malattia cardio-nefro-metabolica: la quadratura del cerchio”.
- Iperuricemia cronica con deposito di urato
L’iperuricemia cronica con deposito di urato oggi rappresenta una delle problematiche dismetaboliche più diffuse nel mondo occidentale (6,8). Nel nostro Paese la prevalenza dell’iperuricemia, definita da livelli circolanti di acido urico > 6,0 mg/dL (9), è aumentata di circa il 40% nell’arco di un solo quinquennio, passando dall’8,5% nel 2005 all’11,9% nel 2009 (6). Il valore medio dell’uricemia nelle popolazioni occidentali è sostanzialmente raddoppiato dagli inizi del ‘900 ai giorni nostri, passando nella popolazione maschile americana da meno di 3,5 mg/dL negli anni ‘20 (10) a 6,25 mg/dL negli anni ‘70, con un trend verso un ulteriore aumento (11). Le principali cause di questa diffusione epidemica dell’iperuricemia sono da ricercare soprattutto nella enorme frequenza dell’eccedenza ponderale e della franca obesità in tutte le fasce di età (12) e nell’aumentato consumo di cibi ricchi in purine (13), di birra e superalcolici (14) e di bevande edulcorate con fruttosio di sintesi (15,16). Il progressivo invecchiamento della popolazione e, quindi, l’espansione di quelle fasce di età in cui la prevalenza dell’iperuricemia cronica è maggiore (6), anche a causa della riduzione della funzionalità renale e, quindi, della capacità del rene di eliminare urati, rappresenta un ulteriore determinante della notevole diffusione di questa condizione nel nostro Paese. Questa rilevante diffusione dell’iperuricemia cronica con e senza deposito di urato giustifica il crescente interesse che la letteratura scientifica sta rivolgendo da alcuni anni al dismetabolismo dell’acido urico anche in ragione della sua stretta relazione con le problematiche cardio-nefro-metaboliche (9,17).
Nel recente passato, le uniche patologie fisiopatologicamente ricondotte ad un aumento dei livelli circolanti di questo metabolita erano la gotta, fondamentalmente nella sua classica estrinsecazione clinica in forma di “podagra”, e la nefrolitiasi uratica. La precipitazione di cristalli di urato monosodico a livello articolare è il determinante fisiopatologico dell’iperuricemia cronica con deposito di urato. Quando i cristalli precipitano per eccesso di soluto, o si staccano da depositi articolari preformati, innescano i diversi meccanismi sottesi alla flogosi articolare acuta che caratterizza l’iperuricemia cronica con deposito di urato (5,9,18). Questi meccanismi fisiopatologici non necessariamente si attivano in forma tumultuosa per determinare la classica estrinsecazione clinica magistralmente descritta da Thomas Sydenham (19). Studi basati sull’uso dell’ecografia articolare dimostrano, infatti, come la deposizione articolare di cristalli di urato monosodico si riscontri nei pazienti con iperuricemia cronica con deposito di urato in circa il 9% delle articolazioni esenti da segni clinici di flogosi. Ancora più interessante è l’evidenza di segni ecografici di deposito articolare di cristalli di urato monosodico nel 25% dei soggetti iperuricemici clinicamente asintomatici e senza storia di artrite acuta (5).
Le evidenze scientifiche degli ultimi anni suggeriscono, invero, da un lato l’esistenza di un non trascurabile sommerso di danno articolare da acido urico clinicamente silente e dall’altro un’ampia lesività extra-articolare di acido urico che comincia a estrinsecarsi per livelli di uricemia inferiori al limite di solubilità della molecola (5,9,18). L’iperuricemia cronica con deposito di urato, infatti, si associa frequentemente ad ipertensione, obesità, diabete mellito, malattie renali e cardiovascolari e ad un’aumentata mortalità (1-3).
- Dismetabolismo dell’acido urico e patologie cardio-nefro-metaboliche
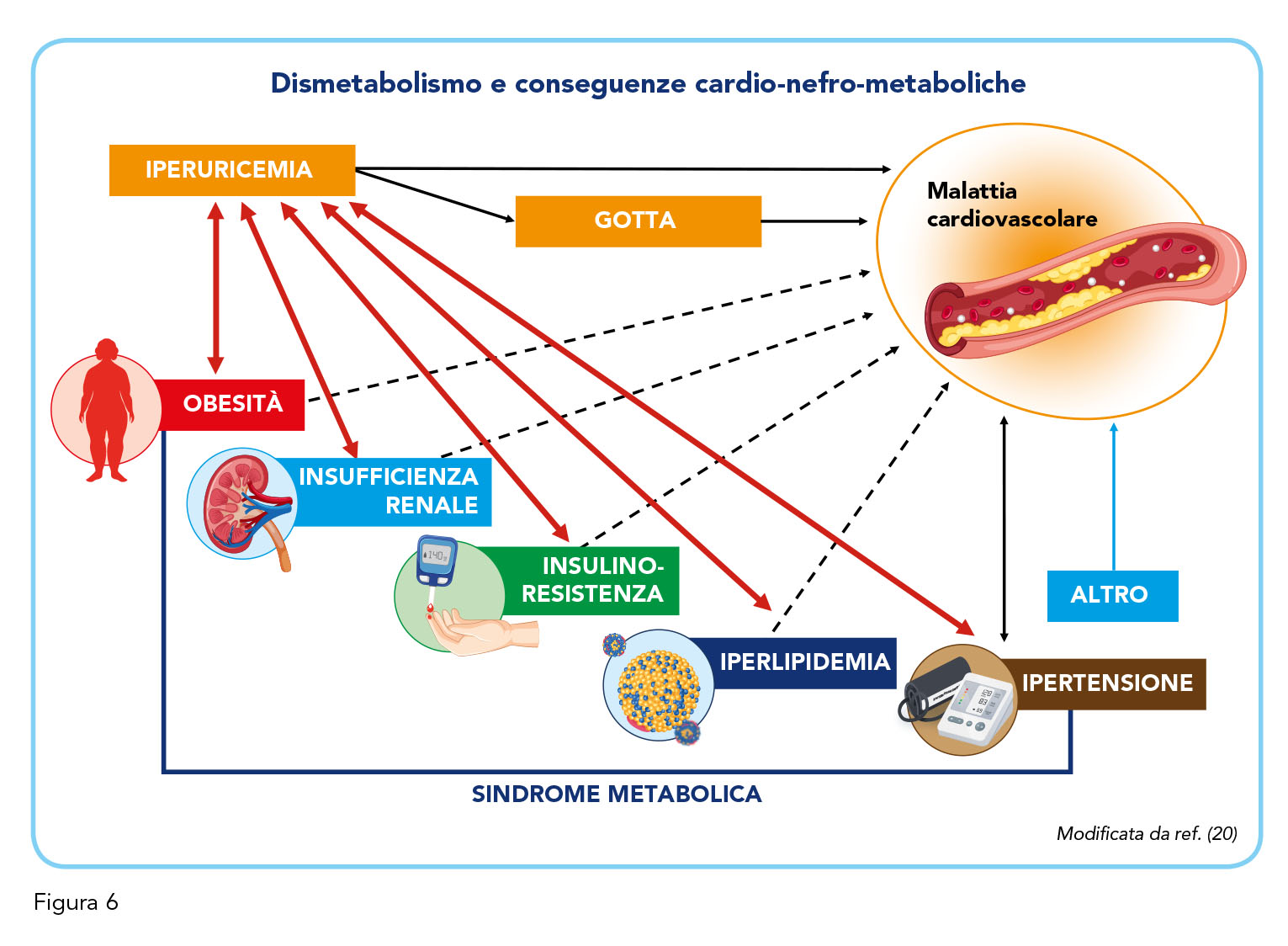
Al fine di contestualizzare la condizione di iperuricemia cronica con deposito di urato, è stato presentato un caso clinico esemplificativo di questa categoria di pazienti: un individuo anziano (> 80 anni), con scarsa aderenza alla terapia ipouricemizzante − nonostante i sintomi articolari di iperuricemia − senza sintomatologia grave ma caratterizzato da varie comorbidità tra cui ipertensione, ridotta funzionalità renale, ipercolesterolemia, alti livelli di glicata ed elevato indice di massa corporea. Appaiono immediatamente evidenti le tre componenti principali del dismetabolismo dell’acido urico, ossia cuore, rene e metabolismo (Figura 6) (20). I dati che emergono dalla letteratura vanno identificando l’iperuricemia, anche asintomatica, come un vero e proprio predittore di danno cardiovascolare e renale e non solo come un mero marcatore di rischio (21,22). L’accumularsi nel corso del tempo di un numero impressionante di pubblicazioni scientifiche a conferma di questa osservazione ha suscitato un progressivo interesse non solo da parte della comunità scientifica ma anche della stampa laica che ha cominciato a chiedersi perché mai un paziente affetto da iperuricemia cronica con deposito di urato dovesse morire di malattie cardiovascolari e quale fosse il nesso fisiopatologico che potesse giustificare l’aumentata incidenza delle malattie cardiovascolari, renali e metaboliche. Il quesito chiave, scientificamente inappuntabile, che emerge è, dunque, se venga prima l’uovo (l’iperuricemia cronica) o la gallina (le comorbidità cardio-nefro-metaboliche), ossia quale delle due condizioni determini l’altra.
Nel contesto cardiovascolare, la faculty ha approfondito le principali comorbidità cardiovascolari associate all’aumento dei livelli di acido urico. L’iperuricemia sembra, infatti, favorire l’insorgenza e lo sviluppo di malattie cardiovascolari attraverso la modulazione di diversi meccanismi, quali la risposta infiammatoria, lo stress ossidativo, l’insulino-resistenza/diabete, lo stress del reticolo endoplasmatico e la disfunzione endoteliale (23). Tra le patologie correlate all’iperuricemia si annoverano la cardiopatia coronarica, l’ictus, l’insufficienza cardiaca congestizia, l’ipertensione arteriosa e la fibrillazione atriale, nonché un aumento del rischio di mortalità per malattia cardiovascolare nella popolazione generale e nei soggetti con cardiopatia coronarica confermata (24). È stato osservato, inoltre, come l’incremento del rischio di ipertensione associato a iperuricemia sia proporzionale all’elevazione dei livelli di uricemia (25). L’iperuricemia è un forte fattore di rischio per l’infarto del miocardio e l’ictus, soprattutto di tipo ischemico (26) e, a conferma di ciò, alcuni studi hanno rilevato un’aumentata insorgenza di infarto miocardico acuto, ictus e insufficienza cardiaca in soggetti di mezza età con aumentati livelli circolanti di acido urico senza storia di malattie cardiovascolari (27). Nei pazienti con diabete di tipo 2, l’elevata variabilità dei livelli di acido urico è stata associata a un aumento del rischio di malattia cardiovascolare sintomatica di nuova insorgenza, con conseguente necessità di intervento di rivascolarizzazione coronarica percutanea (28). Sono di particolare rilevanza, a questo proposito, le evidenze tratte dal progetto URRAH, uno studio di coorte osservazionale multicentrico basato su un ampio database di 23.475 soggetti, di età compresa tra 18 e 95 anni, di cui erano disponibili la misurazione dei livelli sierici di uricemia (mediamente 5 mg/dL; ≃ 1% con gotta) e informazioni cliniche complete su parametri metabolici, funzionalità cardiaca e renale (21). Lo studio URRAH ha avuto il merito di far emergere i livelli di acido urico < 6 mg/dL come predittori di mortalità cardiovascolare e per tutte le cause, anche indipendentemente dalla riduzione della funzionalità renale (21,29).
Alcuni studi hanno, inoltre, investigato la correlazione tra uricemia ed eventi cardiovascolari nella popolazione femminile in fase post-menopausale, tipicamente associata a un incremento nei livelli di questo prodotto del metabolismo purinico. Indipendentemente da altri fattori di rischio cardiovascolare e dalla durata della menopausa, elevati livelli di acido urico correlano con un aumento del rischio di morte ed eventi cardiovascolari maggiori, in particolare di eventi cerebrovascolari (30), oltre che con un incremento dello spessore medio-intimale carotideo, anche nei soggetti senza sindrome metabolica (31). Anche nella popolazione di Framingham e in altri studi è stata descritta una correlazione tra l’iperuricemia e il rischio coronarico nella popolazione femminile (32-34). Durante il dibattito è stato, inoltre, sottolineato come non sia solo l’aumento dei livelli di acido urico oltre le soglie di rischio identificate (> 5-6 mg/dL, in base alla popolazione considerata (21)) a determinare le malattie cardiovascolari, ma che anche le eccessive oscillazioni della sua concentrazione plasmatica siano associate all’insorgenza di eventi cardiovascolari.
Nel contesto renale, molti studi nel corso degli ultimi anni hanno dato consistenza all’ipotesi che l’iperuricemia cronica possa esercitare un effetto nefrolesivo indipendentemente dalla formazione di depositi renali di cristalli di urato monosodico (35), con un meccanismo di danno renale correlato soprattutto allo sviluppo di una malattia arteriolare pre-glomerulare che altera la risposta di autoregolazione renale del flusso ematico e causa ipertensione glomerulare (35). Molti studi epidemiologici indicano, infatti, l’esistenza di una relazione tra livelli circolanti di acido urico e declino della funzione renale, declino che inizia a concretizzarsi ancora una volta per valori di uricemia inferiori al limite di solubilità della molecola (36). In linea con queste evidenze è la dimostrazione, ottenuta dall’analisi di un ampio database amministrativo, di un significativo aumento del rischio di ospedalizzazione per malattie cardiovascolari e renali e dei relativi costi assistenziali al crescere dei livelli circolanti di acido urico già a partire da livelli di uricemia < 6 mg/dL (37). Il follow-up a lungo termine di individui non affetti da problematiche renali ha rivelato che elevati livelli di acido urico sierico (> 7,0 mg/dL negli uomini o > 6,0 mg/dL nelle donne) comportano un aumento del rischio di sviluppo di disfunzione renale cronica (CKD) (38). Questa osservazione è stata confermata da un altro studio, effettuato questa volta su soggetti diabetici di tipo 2 con funzione renale conservata, ove l’iperuricemia si è rivelata essere un fattore di rischio indipendente per lo sviluppo di CKD incidente (39). Infine, elevati livelli di acido urico sono associati a un aumento significativo del rischio di mortalità cardiovascolare nei pazienti con CKD: confrontando gli esiti di 10 studi (n = 26.660), una metanalisi ha rilevato che ogni aumento di 1 mg/dL dei livelli di acido urico sierico, analizzato come variabile continua su tutta la popolazione disponibile, comporta un aumento del rischio di mortalità cardiovascolare del 12% (40).
Per quanto riguarda il rischio di diabete di tipo 2, numerose evidenze correlano l’iperuricemia all’aumento del rischio di diabete di nuova insorgenza (41,42). I livelli sierici di acido urico sembrano peraltro agire da indicatore del destino metabolico nei soggetti con alterata tolleranza al glucosio (43). In ultimo, alcune evidenze dimostrano che l’acido urico è fortemente in grado di influenzare la glicemia post-carico in pazienti con normale tolleranza agli idrati di carbonio ed ipertensione essenziale, analogamente a quanto osservato nei soggetti con ridotta tolleranza al glucosio e nei pazienti diabetici (44).
In sintesi, l’iperuricemia cronica appare essere un marcatore integrato e indipendente di rischio cardio-nefro-metabolico. La sua riduzione per via farmacologica potrebbe, quindi, fornire una significativa protezione d’organo. Nel corso del dibattito scientifico sono stati poi approfonditi i possibili meccanismi fisiopatologici che rendono ragione delle diverse scelte terapeutiche che il clinico può implementare per la gestione di questa condizione cronica e delle comorbidità correlate.
- Caratterizzazione fenotipica dei pazienti con dismetabolismo dell’acido urico
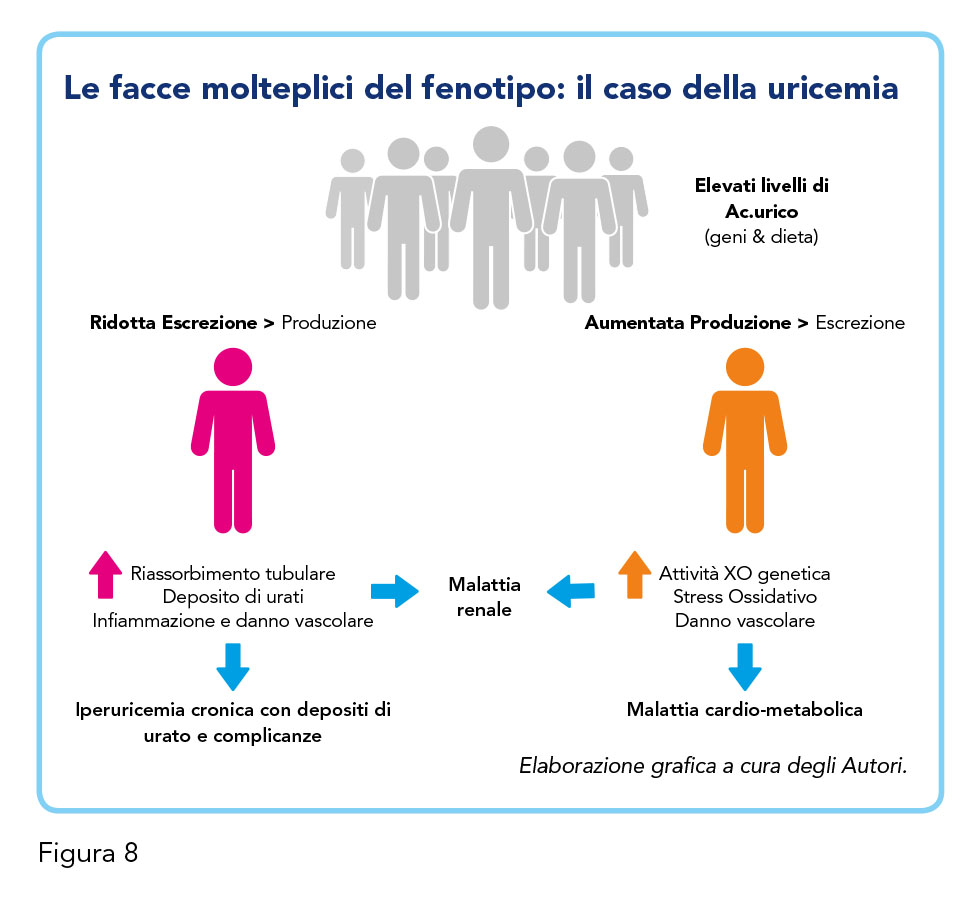
La prevalenza dell’iperuricemia cronica con e senza deposito di urato è considerevolmente aumentata, negli uomini più che nelle donne, nel corso degli ultimi anni, a dimostrazione che ci si trova di fronte a un fenomeno epidemiologico in progressiva espansione. La prevalenza maggiore dell’iperuricemia si ha, soprattutto negli uomini, intorno ai 75-84 anni (6). È possibile identificare due fenotipi diversi di pazienti con elevati livelli di acido urico: gli “iperproduttori” (20%), con determinante genetica legata alla XO o a causa di una sovralimentazione con alimenti ricchi di purine e fruttosio di sintesi, e gli “ipoescretori” (80%) (45). È bene considerare differentemente l’iperuricemia provocata da un’eccessiva produzione o da una ridotta escrezione per attuare un’adeguata scelta terapeutica con inibitori della XO o farmaci uricosurici.
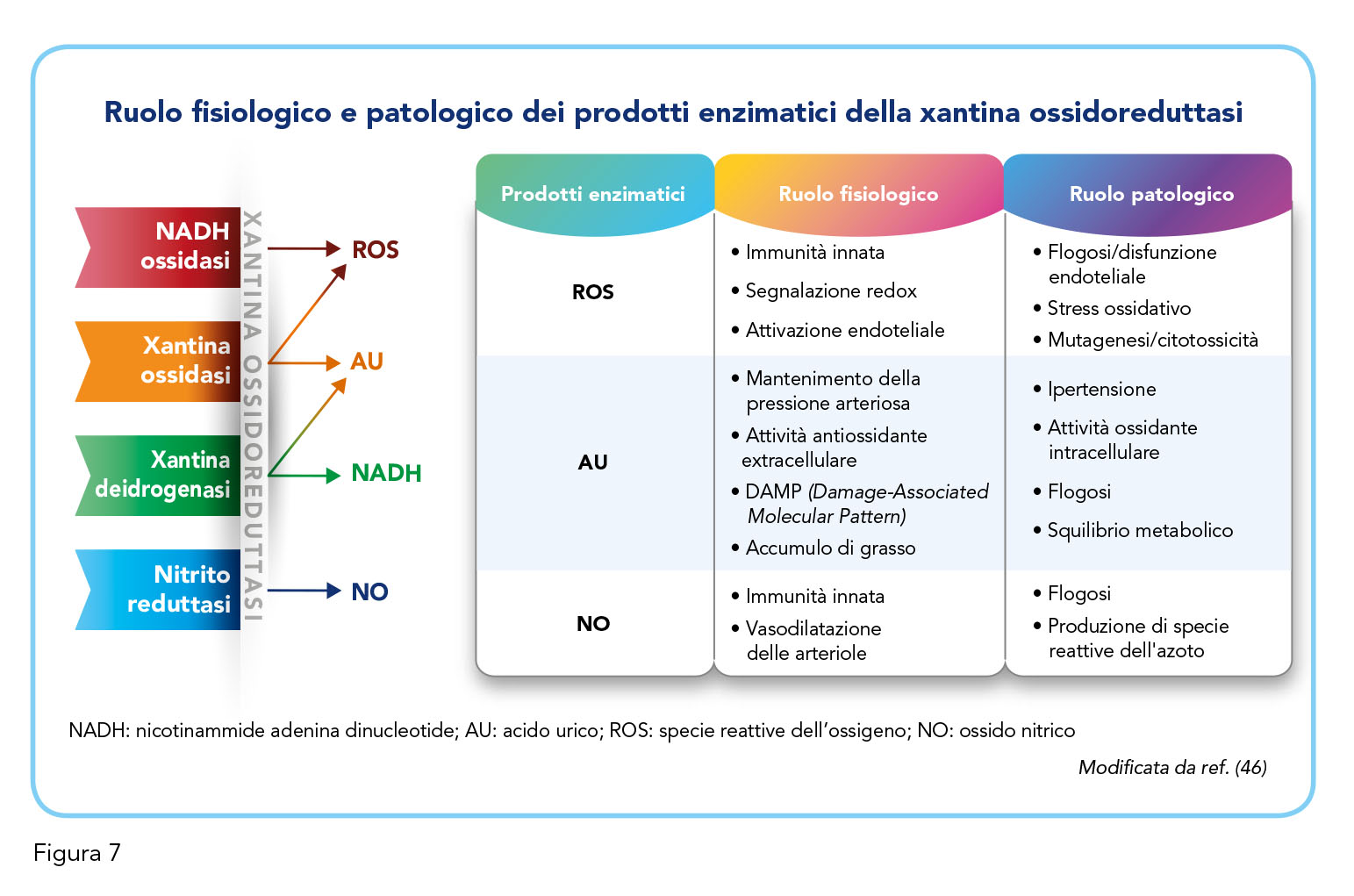
Le tappe centrali del metabolismo dell’acido urico sono rappresentate dalla conversione della ipoxantina a xantina e di quest’ultima ad acido urico ad opera dell’enzima xantina ossidoreduttasi. Questo enzima, isolato per la prima volta nel latte oltre cento anni fa, si compone di due forme tra loro interconvertibili, la XO e la xantina deidrogenasi (46). Queste due forme catalizzano le reazioni finali della via metabolica di degradazione delle purine convertendo l’ipoxantina in xantina e la xantina in acido urico. Oltre al suo ruolo nel catabolismo delle purine, la xantina ossidoreduttasi possiede un’attività di nitrito reduttasi, che genera ossido nitrico (NO), e un’attività di NADH ossidasi, che libera specie reattive dell’ossigeno (ROS). Ciascuno dei prodotti biochimici della xantina ossidoreduttasi può svolgere un ruolo fisiologico o patologico sulla base dell’entità della sua produzione (Figura 7). ROS e NO svolgono infatti un ruolo essenziale nell’immunità innata e contribuiscono a modulare il tono vascolare locale (e dunque la pressione sanguigna); tuttavia, un loro eccesso causa stress ossidativo, flogosi sistemica o disfunzione endoteliale, inducendo anche mutagenesi o citotossicità (46). Per quanto riguarda invece l’acido urico, in condizioni fisiologiche, questo favorisce un adeguato livello pressorio attraverso l’attivazione del sistema renina-angiotensina, svolge un ruolo di scavenger dei radicali liberi nei fluidi biologici e stimola i macrofagi favorendo la risposta immunitaria (46). Per contro, l’iperuricemia favorisce l’ipertensione, induce stress ossidativo a livello intracellulare e contribuisce all’infiammazione sistemica (46). Questo meccanismo comporta la produzione di IL-1b a seguito dell’assemblaggio del complesso proteico definito “inflammasoma” da parte dei macrofagi (46). IL-1b induce l’espressione di citochine proinfiammatorie, riduce l’espressione dei marcatori delle cellule muscolari lisce e promuove un cambiamento fenotipico proaterogeno; agisce dunque da “direttore d’orchestra” non solo del processo infiammatorio ma anche della conseguente aterosclerosi (47). Va inoltre menzionato che, nel corso dell’evoluzione, la specie umana ha perso l’enzima uricasi responsabile della degradazione dell’acido urico (48). Oltre ai benefici sovramenzionati, originariamente l’acido urico svolgeva probabilmente anche un ruolo di neuroprotezione, manteneva stabile la pressione arteriosa in posizione eretta e favoriva l’accumulo di grasso viscerale, tutti meccanismi che mostrano i loro risvolti negativi nell’uomo moderno che subisce, dunque, gli effetti deleteri degli elevati livelli circolanti di questa molecola (49).
6.1 Acido urico, xantina ossidasi e possibili meccanismi fisiopatologici
I livelli di uricemia possono essere determinati da un eccesso di produzione o da una ridotta escrezione di acido urico ed esistono elementi per immaginare che questo aspetto debba essere preso in considerazione nell’ambito delle scelte terapeutiche (Figura 8). Infatti, mentre l’eccesso di produzione potrebbe giovarsi di un intervento indirizzato a inibire i meccanismi di trasformazione biochimica incentrati sulla XO, i limiti della escrezione potrebbero essere superati mediante l’impiego di farmaci uricosurici. Nell’ambito del rischio cardiovascolare sono ipotizzabili tre principali meccanismi fisiopatologici alla base della lesività cardio-nefro-metabolica del dismetabolismo dell’acido urico, meccanismi che possono variamente embricarsi nei diversi pazienti.
In primo luogo, va considerato lo stato infiammatorio cronico legato alla malattia con deposito di urato, patologia troppo spesso erroneamente interpretata come confinata agli attacchi artritici acuti. L’iperuricemia cronica con deposito di urato, invero, è una malattia cronica nella quale gli accessi acuti rappresentano solo la “punta dell’iceberg” di un processo infiammatorio cronico che, in quanto tale, condiziona un aumentato rischio di eventi cardiovascolari (50,51). A conferma di ciò anche la presenza di depositi subclinici di urato a livello articolare nel paziente iperuricemico è associato a una maggiore estensione della patologia aterosclerotica (52).
In secondo luogo, va considerata la possibilità di una lesività diretta dell’acido urico, indipendente dalla precipitazione di cristalli di urato monosodico a livello articolare e tissutale, come suggerito dall’evidenza che la relazione tra livelli circolanti di acido urico e problematiche cardio-nefro-metaboliche si delinea a partire da livelli di uricemia inferiori al limite di solubilità della molecola nei fluidi biologici (9,17,53,54). A tale riguardo non appare inutile sottolineare come le funzioni fisiologiche o, all’opposto, fisiopatologiche dell’acido urico siano condizionate dai suoi livelli raggiunti nei liquidi biologici e dal contesto biochimico in cui si trova (55). Questa interpretazione fisiopatologica, pur supportata da robuste evidenze scientifiche, non giustifica l’uso della terapia farmacologica ipouricemizzante che è attualmente raccomandata solo per i pazienti con iperuricemia cronica con deposito di urato.
Da ultimo, va considerato il complesso ruolo biologico dell’enzima chiave nella sintesi di acido urico, la XO, enzima capace di esercitare effetti ora favorevoli ora lesivi condizionati principalmente dal suo livello di attività (46). Invero, il meccanismo prevalente potrebbe essere proprio quello della sintesi eccessiva di acido urico e, quindi, la sua identificazione potrebbe rappresentare il presupposto essenziale per identificare correttamente i pazienti iperuricemici passibili di un intervento terapeutico indirizzato anche alla prevenzione cardiovascolare.
La xantina ossidoreduttasi mostra una certa attività ossidasica in presenza di una ridotta biodisponibilità di NAD+, ad esempio in quelle condizioni di ischemia/ipossia che si osservano nella flogosi vascolare aterogenica (46). In queste condizioni, peraltro, si osserva anche un aumento dell’espressione di XO e, conseguentemente, un aumento della generazione di ROS che finiscono per influenzare profondamente la fisiologia vascolare. Questo rende ragione del miglioramento della funzione vascolare che è stato descritto in diversi contesti clinici, quali il diabete mellito e lo scompenso cardiaco, in corso di trattamento con inibitori della XO (56-59). L’attività enzimatica della xantina ossidoreduttasi, soprattutto quando esageratamente aumentata, può influenzare negativamente la fisiologia vascolare perché le specie reattive dell’ossigeno − in particolare superossido e perossido di idrogeno − sono in grado di reagire con l’ossido nitrico per formare perossinitrito, una specie ossidante di natura non radicalica. Questa reazione porta a un duplice effetto negativo: da un lato la degradazione dell’ossido nitrico si accompagna a uno sbilanciamento della funzione endoteliale in senso proaterogeno, protrombotico, vasocostrittore; dall’altra il perossinitrito di per sé è una specie altamente reattiva che amplifica gli effetti dello stress ossidativo (46). Considerando il ruolo svolto da NO a livello dell’albero circolatorio − controllo del tono della parete vasale, prevenzione nell’adesione leucocitaria, inibizione dell’adesione ed aggregazione piastrinica, inibizione della proliferazione dell’intima − ben si comprende come i processi che comportano la riduzione della sua biodisponibilità causino inevitabilmente un’alterazione dell’omeostasi a livello vascolare. A conferma del coinvolgimento fisiopatologico della XO nella genesi del danno vascolare, è stato descritto un incremento dell’attività di questo enzima in sezioni di tessuto proveniente da placche aterosclerotiche ma non da tessuto vascolare di soggetti sani (60).
I ROS derivati dalla XO possono essere responsabili di una serie di processi dannosi alla base della fisiopatologia dell’insufficienza cardiaca, come l’ipertrofia cardiaca, la fibrosi miocardica, il rimodellamento del ventricolo sinistro e l’alterazione della contrattilità (61). Di conseguenza, la riduzione dell’uricemia mediante l’inibizione della XO ha mostrato effetti benefici sui marcatori di malattia in pazienti affetti da insufficienza cardiaca, come la disfunzione endoteliale e il flusso sanguigno periferico, lo squilibrio metabolico e la mortalità (62). Un recente studio ha mostrato che la riduzione dell’acido urico sierico senza l’inibizione della XO può non avere alcun effetto sulla compromissione emodinamica nell’insufficienza cardiaca, suggerendo così che sia prevalentemente l’iperattività della XO – piuttosto che l’acido urico – ad essere coinvolta nella compromissione emodinamica dell’insufficienza cardiaca (63). L’azione benefica degli inibitori della XO potrebbe essere dovuta prevalentemente alla loro capacità di migliorare indirettamente la disfunzione endoteliale riducendo lo stress ossidativo, piuttosto che alla riduzione dell’uricemia (64).
- Livelli desiderabili di uricemia e approccio non farmacologico
Come detto in precedenza, i livelli di uricemia sono determinati dal metabolismo delle purine e, in particolare, dal loro catabolismo, di cui l’acido urico è il prodotto terminale. Un aumento dei livelli di acido urico nel sangue può essere dettato da un disequilibrio tra la sua produzione endogena/assunzione e la sua escrezione che avviene sia per uricolisi batterica nell’intestino che per filtrazione glomerulare (55). Quando si parla di riduzione dei livelli circolanti di acido urico non si può prescindere dal menzionare lo stile di vita, importante determinante capace di influenzare tali valori; approfondiremo questo argomento nella sezione 7.2.
L’approccio farmacologico deve essere necessariamente accompagnato da un intervento non farmacologico. Rilevante menzionare come tale intervento non farmacologico in un paziente in cui sia importante attenzionare i livelli di acido urico possa essere implementato anche in via preventiva.
7.1 Valori di riferimento dell’uricemia
I valori di riferimento di una grandezza biologica vengono stabiliti in base a criteri arbitrari e convenzionali, nella generalità dei casi facendo riferimento ai valori più frequentemente riscontrati negli individui sani della specie umana. Si può, infatti, ragionevolmente supporre che l’organismo vivente, come organismo e come specie, tenda a mantenere costanti i valori dei suoi parametri biochimici entro certi limiti che definiscono, appunto, l’intervallo di riferimento. Per questo motivo il dato di laboratorio generalmente viene confrontato con un determinato intervallo di valori definiti “valori normali”, o più correttamente “valori di riferimento”, ovvero come valori riscontrati nella popolazione costituita dagli individui sani. Questo tipo di approccio all’individuazione degli “intervalli di riferimento” evidentemente ha come momento centrale, di rilevanza fondamentale, la corretta individuazione della popolazione dei soggetti che vengono utilizzati per ottenerli.
Utilizzando questo tipo di approccio sono stati identificati per la popolazione italiana due distinti intervalli di riferimento per l’uricemia: 3,5-7,2 mg/dL nei maschi adulti e nelle donne in postmenopausa e 2,6-6,0 mg/dL nelle donne in età premenopausale (9). Questa differenziazione dipende dal fatto che nelle donne in età fertile l’uricemia tende ad essere più bassa per l’effetto uricosurico degli estrogeni. I valori medi di acido urico sono, inoltre, dipendenti da variabili come peso, altezza, pressione arteriosa, funzionalità renale e assunzione di alcolici. È ragionevole pensare che il limite superiore dell’intervallo di riferimento dell’uricemia negli esseri umani possa coincidere con il limite di solubilità della molecola che nel plasma è pari a circa 6,8 mg/dL a 37°C (65), in quanto la sua lesività articolare di acido urico dipende proprio dalla precipitazione dell’urato monosodico con formazione di cristalli. In vitro, è stato peraltro osservato che il processo di deposizione possa avvenire anche a concentrazioni inferiori a livelli di pH più bassi e a una temperatura tissutale più bassa nelle articolazioni periferiche (limite di solubilità: 6,0 mg/dL a 35°C e pH 7,0) (66). Il processo opposto, ossia quello di risoluzione dei depositi tofacei avviene, invece, a livelli di acido urico < 5 mg/dL (66-68). A conferma di ciò, le linee guida internazionali per la gestione della iperuricemia cronica con deposito di urato raccomandano di mantenere i livelli circolanti di acido urico al limite minimo di 6 mg/dL (o < 5mg/dL nelle forme più severe di iperuricemia cronica con deposito di urato) al fine di prevenire la formazione di depositi di urato, promuovere la dissoluzione dei depositi già presenti e prevenire le riacutizzazioni artritiche (5). È interessante notare che l’influenza dell’acido urico sulla fisiopatologia cardiovascolare sembra iniziare ad estrinsecarsi per livelli circolanti di 5,0-5,5 mg/dL, inferiori al limite di solubilità della molecola e, quindi, largamente indipendenti dalla precipitazione di cristalli di urato monosodico, essenza fisiopatologica dell’iperuricemia cronica con deposito di urato (9,53,54). Anche la relazione tra uricemia, dismetabolismo glucidico (69) e sindrome metabolica (70) sembra concretizzarsi per valori di uricemia inferiori, o al massimo prossimi, al limite di solubilità della molecola.
Alla luce di queste evidenze appare opportuna una rivisitazione del concetto di normalità dell’uricemia in quanto l’approccio che ha portato alla identificazione degli attuali intervalli di riferimento, differenziati in base al genere, appare oggi minato nella sua solidità sostanzialmente da due aspetti critici, uno di ordine epidemiologico e uno di ordine scientifico. Per quanto attiene il primo, il progressivo aumento dei livelli di uricemia media nella popolazione generale fa sì che gli attuali valori di riferimento non siano in linea con quanto si osserva oggi nella popolazione generale. Questo aspetto dovrebbe condurre, in linea teorica, addirittura ad una paradossale revisione verso l’alto dei valori di riferimento attuali se l’approccio seguito per definirli dovesse continuare a essere quello statistico, basato sulla distribuzione dei valori nella popolazione generale sana. Per quanto attiene, invece, il secondo elemento di criticità, il progresso della conoscenza scientifica ha ormai attribuito incontrovertibilmente all’acido urico un ruolo fisiopatologico molto ampio, ben al di là di quanto ipotizzabile quando è stata individuata quella coorte di soggetti sani da cui il suddetto intervallo di riferimento è stato derivato con metodo statistico. Alla luce delle attuali evidenze scientifiche, in attesa di una revisione delle linee guida possibilmente centrate sul paziente, la soglia di normalità per l’uricemia non può che corrispondere a quei 6 mg/dL che le raccomandazioni internazionali già suggeriscono come obiettivo da raggiungere per il paziente con iperuricemia cronica con deposito di urato. Questo livello desiderabile è senza dubbio quello che ha le maggiori possibilità di intercettare la totalità della lesività dell’acido urico, obiettivo che sempre ci si dovrebbe prefiggere nella definizione di ogni intervallo di normalità (9).
7.2 Approccio non farmacologico
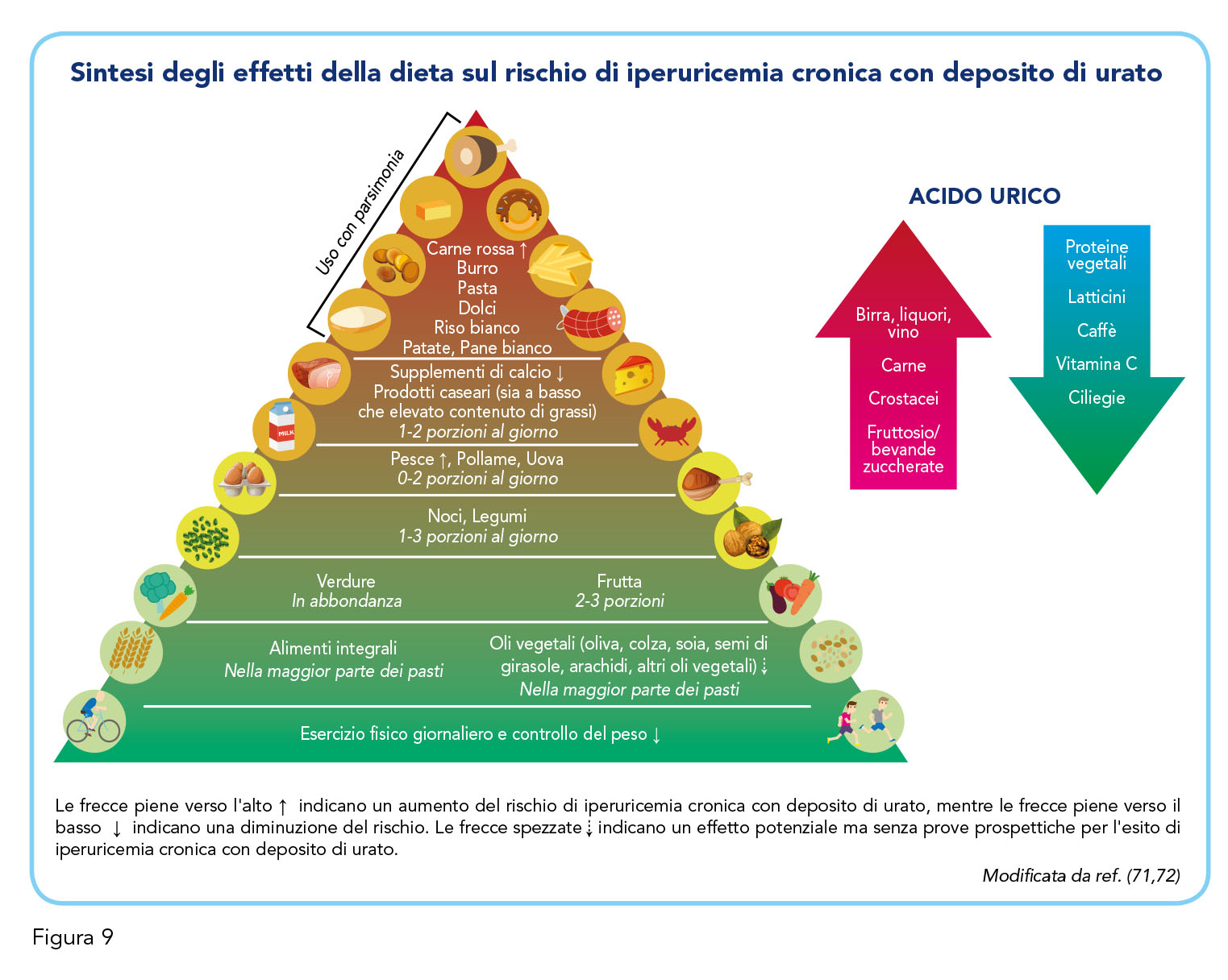
A questo proposito viene discusso come l’approccio “vincente” consista nell’agire contemporaneamente con un trattamento farmacologico e un cambiamento dello stile di vita e delle abitudini alimentari, e in particolare sull’assunzione di purine, tramite la dieta, che può determinare un incremento dei livelli di acido urico (Figura 9) (71,72). Nel valutare gli effetti della dieta in pazienti con elevati livelli di uricemia, uno studio che ha confrontato tre regimi dietetici (dieta a basso apporto di grassi, dieta mediterranea e dieta a basso contenuto di carboidrati) ha dimostrato, dopo 6 mesi, una riduzione consistente dei livelli di uricemia per tutti e tre (73). Un altro studio ha invece osservato un aumentato rischio di iperuricemia cronica e, parallelamente, cardiovascolare in soggetti maschi, seguiti per oltre 20 anni, che assumevano una dieta “Western” − ricca di carni rosse, zuccheri e grassi − rispetto a coloro che assumevano, invece, una dieta “DASH” (Dietary Approaches to Stop Hypertension) − basata soprattutto sull’apporto di frutta e verdura (74). Un terzo studio, ha trovato infine che, nelle donne, la dieta “DASH”, seguita nel corso degli anni, era la migliore in termini di outcome di uricemia, tenendo conto di obesità, uso di diuretici e consumo di alcolici. Il risultato peggiore, ancora una volta, derivava dalla dieta “Western” (75).
Sulla base di queste e altre evidenze si sconsiglia, dunque, un’alimentazione ricca di carne rossa, crostacei, frutti di mare, alcuni pesci e prodotti di origine vegetale (tra cui asparagi e lenticchie), si raccomanda di evitare l’apporto di fruttosio di sintesi tramite bevande zuccherate, di limitare l’assunzione di alcolici (in particolare di birra), di non eccedere nel consumo di uova (massimo due porzioni al giorno) e di utilizzare metodi di cottura che richiedono pochi grassi (in particolare il burro) (13-16). Alcuni di questi alimenti aumentano, infatti, il substrato purinico, favorendo la produzione di acido urico come prodotto terminale del loro metabolismo (13). Per contro, un effetto positivo della dieta in termini di riduzione dell’acido urico viene attribuito al caffè (13-16). È inoltre importante assicurare la giusta idratazione − 2L d’acqua quotidiani − e di svolgere attività fisica regolare (76). Lo stesso ragionamento vale per il decremento ponderale, che riduce in via indiretta l’insulino-resistenza e ha, quindi, un impatto notevole sui livelli circolanti di acido urico (12). Infine, è necessario prestare attenzione all’utilizzo concomitante di farmaci che possono aumentare i livelli di uricemia, come ad esempio i diuretici (17). Tutti i pazienti devono ricevere informazioni precise sulla modifica dello stile di vita richiesto, sulla dieta, sulla necessità di perdere peso (ove opportuno) e sulla stretta aderenza al trattamento raccomandato. A tal proposito, la faculty discute di come, spesso, introdurre sistematicamente tutte queste modifiche nel proprio stile di vita incontri le resistenze di molti pazienti, in particolar modo di quelli più anziani, che si vedono privati di un’ampia selezione di alimenti (magari di uso quotidiano fino a poco tempo prima). Questo sfocia dunque in una scarsissima aderenza alla terapia non farmacologica, che rende ancora più indispensabile l’attuazione di una terapia, invece, farmacologica. I due approcci sono complementari, e forse imprescindibili, per raggiungere un adeguato controllo dei livelli di uricemia e dunque la prevenzione delle conseguenze cardio-nefro-metaboliche derivanti dal suo dismetabolismo.
- La terapia farmacologica dell’iperuricemia
Poiché i livelli di uricemia possono essere determinati o da un eccesso di produzione o da una ridotta escrezione, esistono elementi per immaginare che questo aspetto debba essere preso in considerazione nell’ambito delle scelte terapeutiche. Infatti, mentre l’eccesso di produzione potrebbe giovarsi di un intervento indirizzato a inibire i meccanismi di trasformazione biochimica incentrati sulla XO, i limiti della escrezione potrebbero essere superati mediante l’impiego di farmaci uricosurici. La discussione che segue prende spunto dalle raccomandazioni fornite dalle linee guida e integra le più recenti evidenze in letteratura con gli spunti clinici pratici emersi dal confronto scientifico.
8.1 Raccomandazioni farmacologiche fornite delle linee guida
Una prima problematica che si incontra nel trattamento dell’iperuricemia cronica con deposito di urato è dunque l’aderenza alla terapia che è solo di circa il 20% poiché molti pazienti abbandonano il trattamento una volta risolto l’attacco artritico acuto (77-80). L’iperuricemia cronica con deposito di urato è la patologia reumatica più curabile e meglio conosciuta ma, paradossalmente, è la peggio curata, anche a causa della presenza di un non trascurabile grado di inerzia terapeutica da parte del medico (81).
Sebbene non vi sia stata una vera e propria innovazione farmaceutica, c’è grande fermento attorno alle linee guida nazionali ed internazionali per la gestione dell’iperuricemia cronica con deposito di urato (82). Nel corso della discussione, vengono, dunque, messe a confronto queste linee guida, in particolar modo quelle EULAR (5), quelle francesi (83,84) e quelle americane (85). L’utilizzo di colchicina, FANS o corticosteroidi è raccomandato come intervento di prima linea negli attacchi acuti, seguiti dall’impiego degli inibitori di interleuchina nei casi non responsivi alla terapia ipouricemizzante (82). La colchicina ha una valida efficacia polivalente sia a basse che alte dosi, seppur con un proporzionale aumento di effetti avversi (es. diarrea). La colchicina è inoltre raccomandata per la profilassi degli attacchi artritici acuti quando si inizia una terapia ipouricemizzante, per una durata di circa 6 mesi.
Il valore soglia d’inizio per il trattamento dell’iperuricemia definito da EULAR è di 6 mg/dL e per portare il paziente al di sotto di questi livelli bisogna intraprendere la terapia ipouricemizzante il prima possibile. La faculty discute dell’eventualità di intervenire già durante l’attacco acuto: sebbene su questo punto vi siano divergenze tra le raccomandazioni fornite dalle varie linee guida prese in considerazione, l’intervento farmacologico ipouricemizzante immediato può avere il beneficio pratico di non perdere l’occasione di curare un paziente che, al termine dell’attacco, potrebbe non ripresentarsi dal medico per cominciare la terapia. A questo si associa, peraltro, una scarsa sensibilità da parte di molti clinici sul tema dell’iperuricemia cronica con deposito di urato e delle sue conseguenze cardio-nefro-metaboliche, riducendo ulteriormente la possibilità di ricevere una terapia ipouricemizzante, soprattutto nelle donne. Si discute, inoltre, di come sia consigliabile mettere in atto una titolazione progressiva del farmaco al fine di evitare reazioni avverse dose-dipendenti. La terapia ipouricemizzante di riferimento è rappresentata dagli inibitori della XO, allopurinolo e febuxostat (5), approfonditi nel paragrafo 8.2.
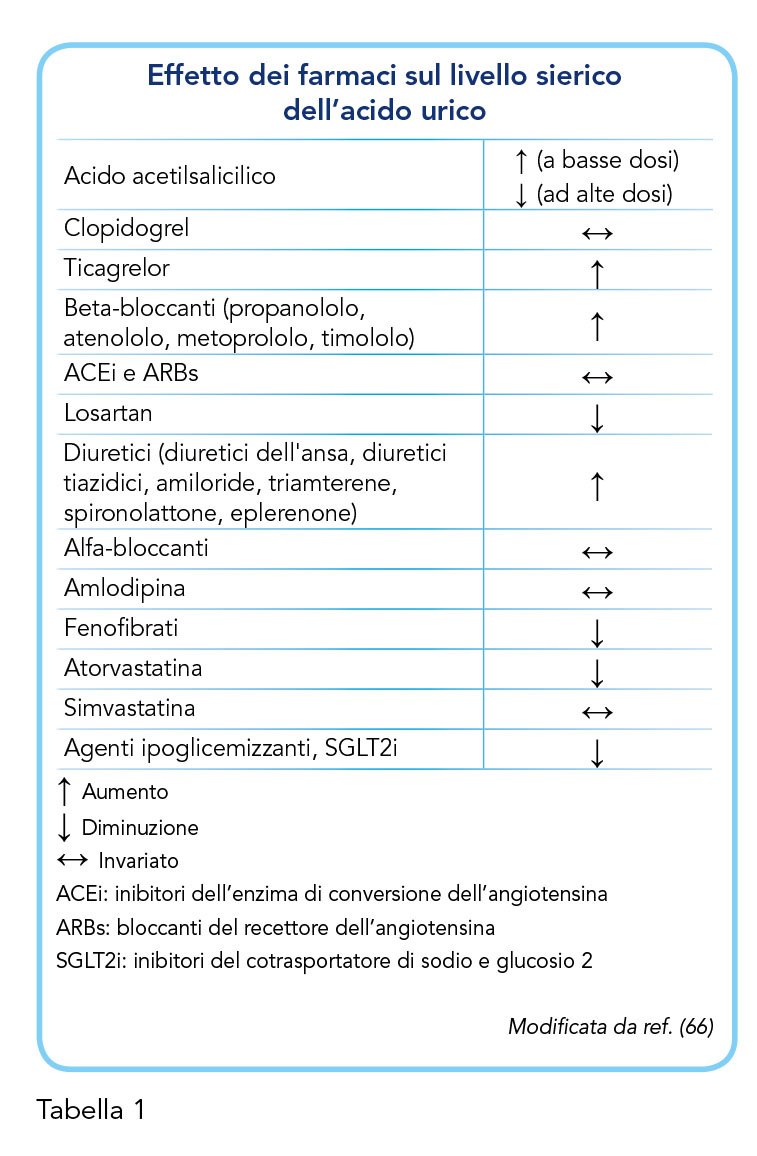
Infine, l’Italia è il solo Paese a non avere un farmaco uricosurico: probenecid è permesso solo per uso ospedaliero, mentre sulfinpirazone è indicato solo nel trattamento del post-infarto. Alcuni farmaci cardiovascolari hanno un discreto effetto uricosurico indiretto (Tabella 1); è il caso delle gliflozine, di losartan e di sacubitril-valsartan che hanno un effetto sulle concentrazioni plasmatiche di acido urico, riducendole (86-91). Questi farmaci possono costituire un valido strumento per ottimizzare la strategia di gestione dell’iperuricemia e dei fattori di rischio concomitanti. Allo stesso modo, occorre prestare grande attenzione ai farmaci che possono invece modulare in direzione opposta i livelli di acido urico, aumentandone i livelli ed esacerbando la patologia, quali l’acido acetilsalicilico a basso dosaggio, molti diuretici e beta-bloccanti (Tabella 1) (66).
8.2 Gli inibitori della xantina ossidasi
Allopurinolo è chimicamente un analogo purinico, originariamente sintetizzato nell’ambito di un programma di sviluppo di farmaci antibatterici e chemioterapici (92). Questo farmaco è un inibitore non selettivo relativamente debole della XO che a basse dosi agisce come substrato per questo enzima (“inibitore suicida”), mentre ad alte dosi si comporta come un inibitore non competitivo (93,94). Allopurinolo viene metabolizzato ad ossipurinolo, metabolita attivo che viene eliminato dal rene. È un farmaco mediamente sicuro e ben tollerato, che riduce l’uricemia in maniera dose-dipendente. Il suo utilizzo per il trattamento dell’iperuricemia cronica con deposito di urato è stato approvato dalla Food and Drug Administration (FDA) nel 1996 e rappresenta il farmaco attualmente di maggior utilizzo per ridurre l’uricemia, raccomandato come prima linea di intervento dalle linee guida alla dose iniziale di 50-100 mg (80). Il largo impiego è dettato da un lato dalla sua efficacia terapeutica, quando utilizzato a dosaggi adeguati (fino a 800 mg/die), e dall’altro in ragione della indisponibilità fino a un passato relativamente recente di altri inibitori della XO efficaci e ben tollerati (93,95).
L’uso di febuxostat come trattamento ipouricemizzante è invece relativamente più recente, approvato da FDA e da European Medicines Agency (EMA) da circa 10 anni. Invero, nonostante febuxostat sia andato a colmare un importante gap terapeutico nella gestione di una patologia, la sua introduzione in commercio è stata inizialmente rallentata dall’evidenza di un aumento nominale dei decessi per cause cardiovascolari rispetto ad allopurinolo osservato in alcuni studi pilota (96-99). Dopo varie revisioni delle evidenze scientifiche EMA ha approvato l’uso di febuxostat alla dose di 80 e 120 mg/die mentre FDA ne ha approvato l’introduzione in commercio alle dosi di 40 e 80 mg sulla scorta dei risultati di un ulteriore trattamento randomizzato controllato su 2.269 pazienti con iperuricemia cronica con deposito di urato – lo studio CONFIRMS – che aveva evidenziato una simile frequenza di eventi cardiovascolari nei pazienti trattati con febuxostat o allopurinolo, in assenza di decessi per cause cardiovascolari nei pazienti trattati con febuxostat (100).
A differenza di allopurinolo e del suo metabolita attivo ossipurinolo, febuxostat non è un composto purino-simile ma è un derivato dell’acido tiazolidin-carbossilico che ha la peculiare capacità di inibire selettivamente sia la forma ridotta che la forma ossidata della XO (101-103) con una potenza da 10 a 30 volte superiore rispetto a quella di allopurinolo (96) e la cui efficacia è dose dipendente. Paragonato ad allopurinolo, febuxostat si è rivelato più efficace alle dosi comunemente utilizzate nel ridurre i livelli di acido urico nei pazienti affetti da iperuricemia con deposito di urato, con il 56,9% dei pazienti naïve al trattamento che ha raggiunto livelli di acido urico < 6,0 mg/dL (vs. 44,8% con allopurinolo; P < 0,001) e il 35,5% che ha raggiunto livelli di acido urico < 5,0 mg/dL (vs. 19,2% con allopurinolo; P < 0,001) (104). Inoltre, febuxostat presenta una doppia via di eliminazione, epatica e renale, ragione per cui non ne è richiesto alcun aggiustamento posologico nei pazienti con insufficienza renale di grado I-III (97), condizione non infrequente nei pazienti con iperuricemia cronica con deposito di urato (9). Inoltre, a differenza di allopurinolo, febuxostat non richiede l’aggiustamento posologico di warfarin quando somministrati contemporaneamente, in quanto non interferisce con la sua farmacocinetica (si veda paragrafo 9.1). Queste caratteristiche di febuxostat ne rendono particolarmente vantaggioso l’uso nei pazienti che non raggiungono il target terapeutico in corso di trattamento con allopurinolo o che non tollerano questo farmaco, invero non scevro di effetti indesiderati.
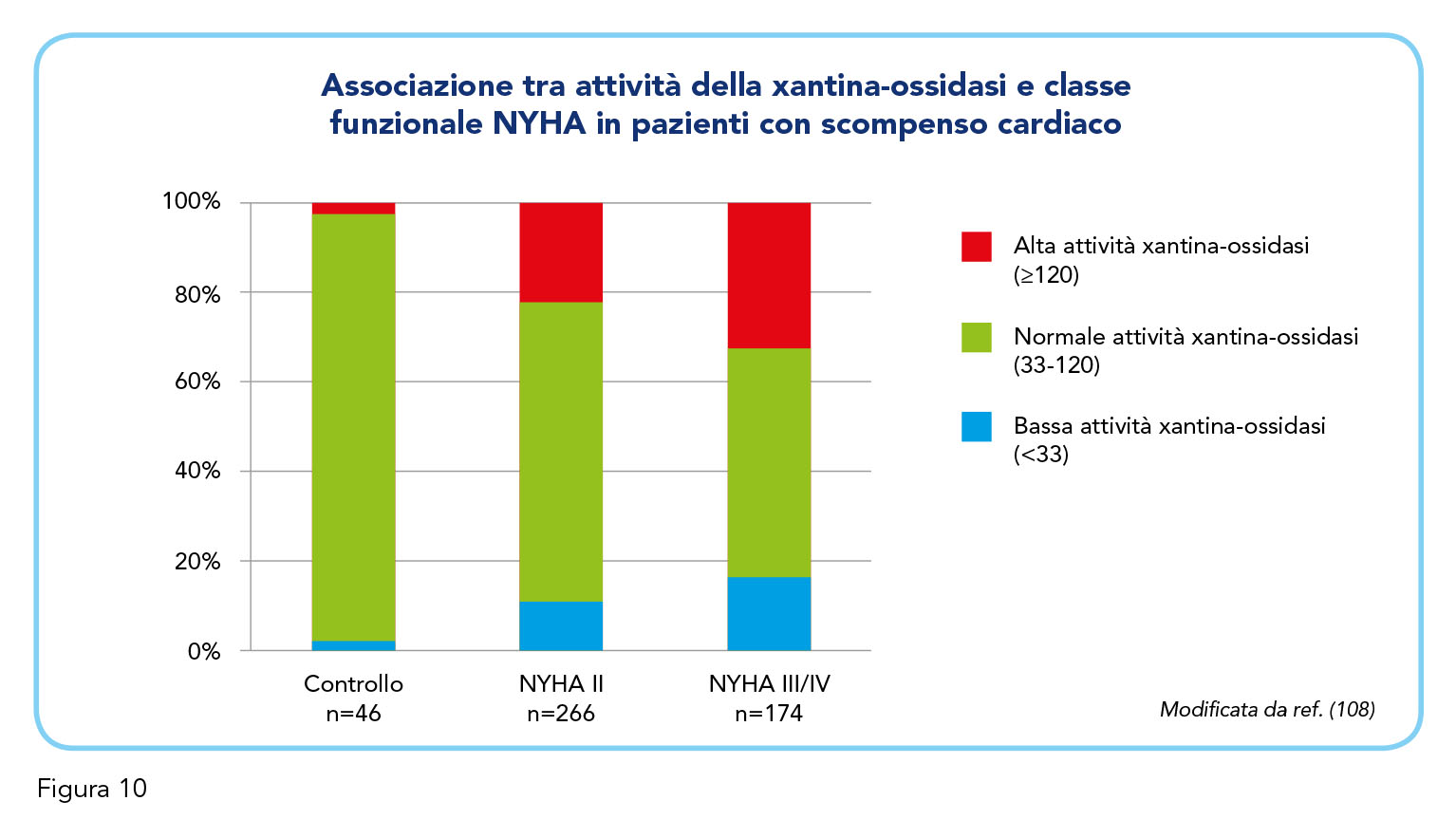
L’evidenza di un profondo coinvolgimento fisiopatologico della XO nella genesi del danno vascolare derivante da studi di fisiopatologia sperimentale e clinica ha trovato conferma nella dimostrazione di effetti favorevoli sulla fisiopatologia cardiovascolare derivante dall’inibizione della XO: miglioramento della funzione endoteliale e della funzione contrattile miocardica, riduzione dello stress ossidativo (105). In ambito trialistico, lo studio OPT-CHF (Oxypurinol Therapy for Congestive Heart Failure), che ha arruolato 405 pazienti con scompenso cardiaco moderato-severo a ridotta frazione di eiezione (classe NYHA III/IV), ha evidenziato un miglioramento clinico in corso di trattamento con ossipurinolo, metabolita attivo di allopurinolo, nei pazienti con aumentati livelli circolanti di acido urico (106). In controtendenza con queste evidenze, lo studio EXACT-HF (Xanthine Oxidase Inhibition for Hyperuricemic Heart Failure Patients), che ha arruolato 253 pazienti iperuricemici (uricemia > 9,5 mg/dL), con scompenso cardiaco sintomatico a ridotta frazione di eiezione, randomizzati al trattamento con allopurinolo 600 mg/die o placebo per 24 settimane, non ha dimostrato differenze significative nei due bracci di trattamento relativamente all’outcome primario (sopravvivenza, peggioramento dello scompenso cardiaco e stato funzionale globale) (107). Invero, nel considerare il possibile utilizzo di un inibitore della XO nel paziente con scompenso cardiaco va debitamente tenuto conto di alcune evidenze che suggeriscono come il livello di attività della XO possa variare in funzione dello stadio clinico della patologia (108). Nei pazienti in classe NYHA II una iperattività della XO si osserva in circa il 20% dei casi mentre nel 10% dei casi si osserva un basso livello di attività di questo enzima. Nei pazienti con scompenso cardiaco in classe III/IV queste percentuali salgono a circa il 35% e a circa il 18%, rispettivamente (Figura 10) (108).
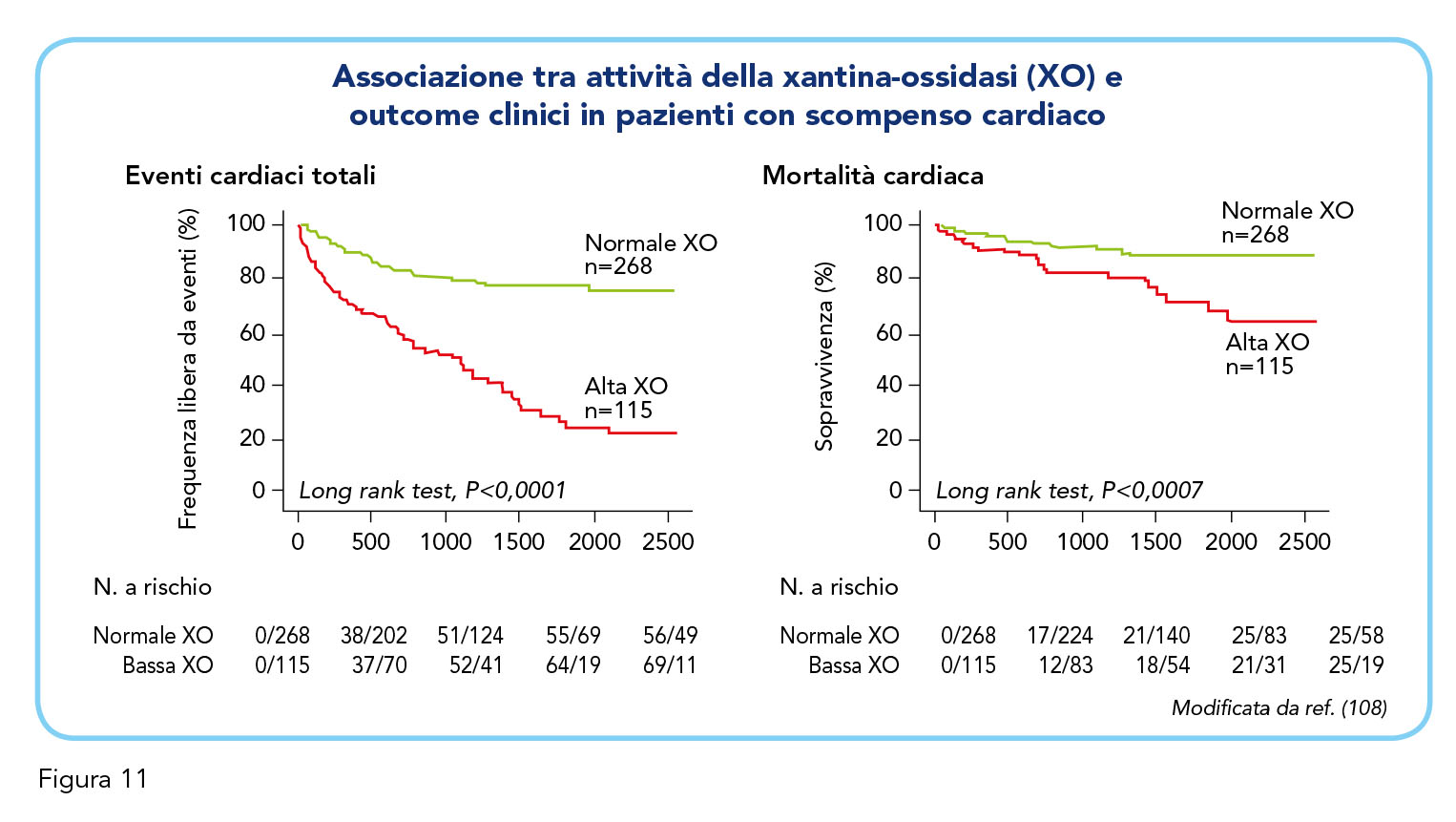
È interessante notare come sia l’aumentata attività che la ridotta attività della XO siano associate ad un aumentato rischio di eventi cardiovascolari e ad una aumentata mortalità (108) (Figura 11). Sulla base di queste evidenze è lecito ipotizzare che i soggetti che maggiormente possano trarre il maggiore beneficio dell’inibizione della XO siano quelli nei quali i livelli di attività sono aumentati (o quantomeno normali) ma non quelli con bassi livelli di attività della XO. In questa ottica si potrebbe arrivare ad ipotizzare, ovviamente in un contesto squisitamente speculativo, che l’inefficacia dell’inibizione della XO nel ridurre l’outcome primario nello studio EXACT-HF possa, nella realtà dei fatti, nascondere la reciproca elisione del possibile vantaggio nei pazienti scompensati con alti livelli di attività della XO e del possibile svantaggio nei pazienti con bassi livelli di attività della XO (107). Il naturale derivato di questa ipotesi è rappresentato dalla necessità di individuare un indice semplice ed affidabile di attività della XO che potrebbe guidare la scelta del clinico nell’identificazione dei pazienti con iperuricemia cronica con deposito di urato nei quali è ipotizzabile che la riduzione dell’uricemia con inibitori della XO possa tradursi anche in un beneficio a livello cardiovascolare. Nelle donne in età fertile, ad esempio, l’effetto uricosurico degli estrogeni (109) può mascherare un’aumentata attività della XO che, pur inefficace nel condizionare un aumento dei livelli circolanti di acido urico avrebbe, comunque, tutte le potenzialità per favorire lo sviluppo della patologia aterosclerotica. A conferma di questa ipotesi, la predittività dei livelli circolanti di acido urico nei confronti degli eventi cardiovascolari è soprattutto evidente nelle donne in età fertile (21,110) nelle quali livelli di acido urico anche solo ai limiti alti della norma esprimono verosimilmente una aumenta attività della XO. Lo studio FEATHER (Febuxostat Versus Placebo Randomized Controlled Trial Regarding Reduced Renal Function in Patients With Hyperuricemia Complicated by Chronic Kidney Disease Stage 3) il trattamento con febuxostat è risultato associato ad un numero di problematiche cardiovascolari e cerebrali, riportate nello studio nell’ambito degli eventi avversi, simili a quelle osservate nel gruppo placebo (111). Del tutto recentemente sono stati pubblicati i risultati dello studio ALL-HEART (Allopurinol versus usual care in UK patients with ischaemic heart disease) disegnato con lo scopo di verificare se la terapia con allopurinolo migliorasse i principali outcome cardiovascolari nei pazienti con cardiopatia ischemica cronica (112). Lo studio ha incluso una popolazione intention-to-treat composta da 5.721 pazienti di età pari o superiore a 60 anni con ischemia cardiaca ma senza storia di iperuricemia cronica con deposito di urato (età media 72 anni, 76% di sesso maschile). I pazienti sono stati randomizzati 1:1 a ricevere allopurinolo titolato fino a una dose di 600 mg al giorno in aggiunta alle terapie cardiovascolari abituali (n= 2.853) o le sole terapie abituali (n= 2.868). L’outcome primario era un composito di infarto miocardico non fatale, ictus non fatale o morte cardiovascolare. Outcome secondari erano il tempo all’insorgenza di svariati eventi cardiovascolari, che includevano infarto miocardico non fatale, ictus non fatale, morte cardiovascolare, mortalità per tutte le cause, ricovero per sindrome coronarica acuta, rivascolarizzazione coronarica o rivascolarizzazione coronarica, ricovero per insufficienza cardiaca e tutti i ricoveri cardiovascolari (112). A un follow-up medio di 4,8 anni non è emersa alcuna differenza tra i gruppi nel tasso dell’endpoint primario, che si è verificato in 314 (11,0%) partecipanti nel braccio allopurinolo (2,47 eventi per 100 anni-paziente) e 325 (11,3%) nel braccio con terapia abituale (2,37 eventi per 100 anni-paziente), con un hazard ratio di 1,04 (intervallo di confidenza al 95% compreso tra 0,89 e 1,21; p=0,65). Non sono emerse differenze in nessuno degli outcome secondari (112). La conclusione degli autori dello studio appare perentoria “sulla base dei risultati della studio ALL-HEART, il trattamento con allopurinolo non dovrebbe essere raccomandato per la prevenzione secondaria degli eventi cardiovascolari nei pazienti con malattia coronarica” è forse un po’ troppo precipitosa (112). Il livello medio dell’uricemia nella popolazione arruolata nello studio ALL-HEART e randomizzata al trattamento con allopurinolo, infatti, era 0,35±0,08 mmol/L (5,9±1,34 mg/dL), valori suggestivi del fatto che una larga quota dei pazienti trattati non presentava iperattività della XO (112).
- Efficacia e sicurezza dei farmaci inibitori della xantina ossidasi
Nel contesto delle terapie ipouricemizzanti, la faculty entra nel merito delle caratteristiche specifiche degli inibitori della XO, molecole che, come esposto in precedenza, impediscono la conversione delle purine endogene in acido urico.
9.1 Tollerabilità degli inibitori della xantino ossidasi
Allopurinolo è un profarmaco convertito in ossipurinolo, metabolita attivo ad azione non selettiva sulla XO e che riduce i livelli di urato con una modalità dose-dipendente (113,114). A causa della sua azione aspecifica, allopurinolo può causare diversi tipi di effetti avversi con rischio proporzionale al crescere della dose; tra questi va considerata la reazione da ipersensibilità che, sebbene sia una manifestazione rara, comporta un serio rischio di ospedalizzazione e mortalità. Le gravi reazioni cutanee avverse correlate ad allopurinolo sono associate, inoltre, all’insorgenza di cardiopatie, con rischio direttamente proporzionale al dosaggio iniziale (115-117). A questo proposito, si dibatte se questo dato sia stato adeguatamente preso in considerazione dalle linee guida EULAR. La maggior parte dei pazienti riceve 300 mg di allopurinolo al giorno, ma questa dose è spesso inadeguata per raggiungere i livelli target di urato (102,118). Dosi giornaliere fino a 800 mg possono essere utilizzate in pazienti con funzione renale normale, mentre nei pazienti con insufficienza renale la posologia di allopurinolo deve essere ridotta a causa dell’aumentato rischio di ipersensibilità in tali pazienti (119). Per l’impiego di allopurinolo vanno valutate possibili interazioni con farmaci concomitanti come il warfarin, ove è opportuno monitorare attentamente il paziente, e i diuretici tiazidici, che possono richiedere una riduzione del dosaggio di allopurinolo quando è presente una diminuzione della funzionalità renale (anche in assenza di insufficienza renale è opportuno monitorare la funzionalità renale dei pazienti in terapia con allopurinolo).
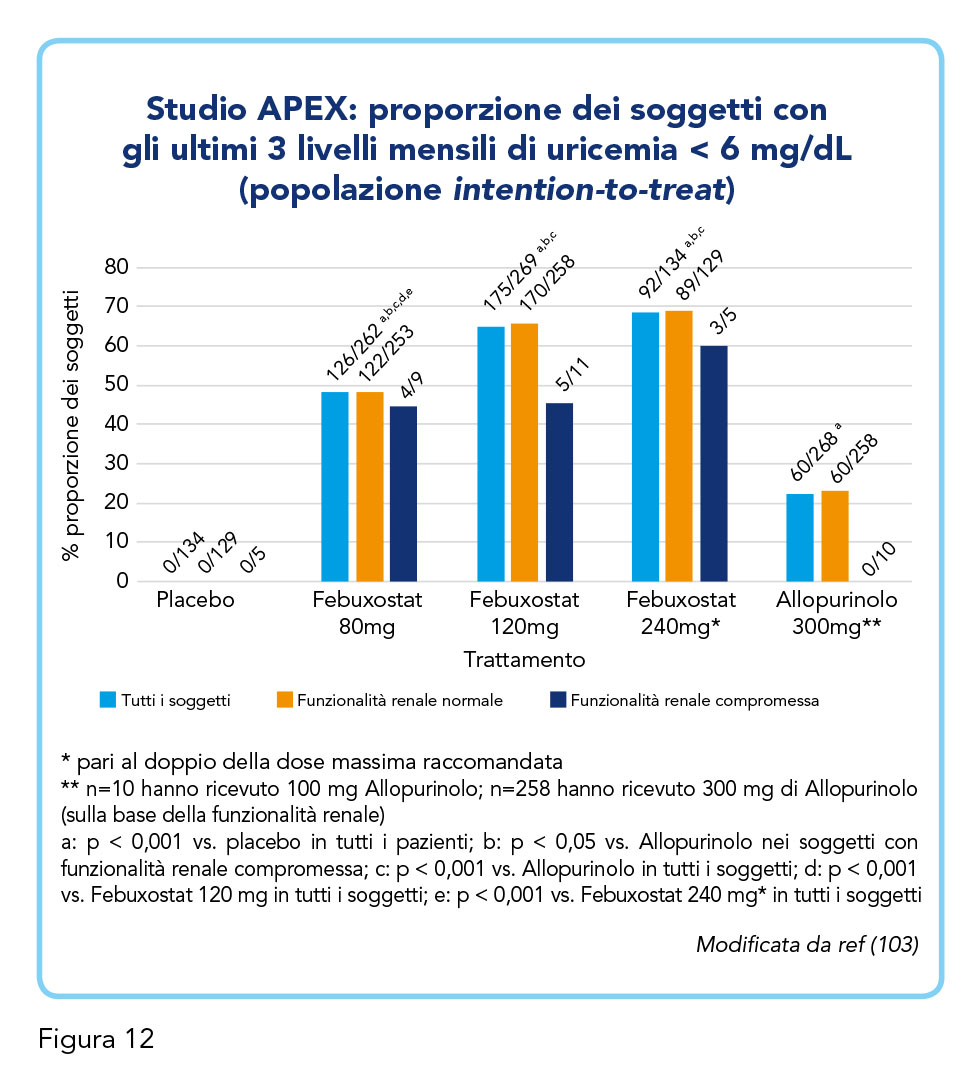
Febuxostat svolge, invece, un’inibizione selettiva della XO e presenta scarse interferenze farmacologiche (113,120). Ad esempio, nel caso specifico del warfarin, questo non richiede aggiustamenti di dosaggio quando co-somministrato a febuxostat e anche nei casi di assunzione concomitante di idroclorotiazide e febuxostat, quest’ultimo non richiede aggiustamenti del dosaggio. Febuxostat si è rivelato superiore ad allopurinolo in termini di regolarità graduale e costante della riduzione di acido urico: alla dose giornaliera di 80 mg o 120 mg, febuxostat riduce più efficacemente i livelli di acido urico sierico rispetto ad allopurinolo alla dose giornaliera fissa comunemente utilizzata di 300 mg (102). L’efficacia di febuxostat rispetto ad allopurinolo è stata valutata da numerosi studi – tra cui gli studi FACT, APEX e FOCUS – che hanno mostrato ottime curve di riduzione dell’iperuricemia nei pazienti con iperuricemia cronica con deposito di urato e la riduzione del rischio di nuovi attacchi acuti in corso di trattamento con febuxostat (99,102,103). Febuxostat riduce e mantiene più efficacemente i livelli di urato sierico < 6,0 mg/dL rispetto ad allopurinolo (300 o 100 mg) in soggetti con iperuricemia e deposito di urato, compresi quelli con funzionalità renale da lieve a moderatamente compromessa (Figura 12) (103). Lo studio FOCUS (Febuxostat Open-label Clinical trial of Urate-lowering efficacy and Safety), in particolare, ha riportato un’efficace riduzione dell’iperuricemia da parte di febuxostat al follow-up di 5 anni, e il verificarsi di poche reazioni collaterali (99). Nei pazienti con CKD, la monoterapia con febuxostat ha mostrato un miglior controllo dei valori di uricemia. In pazienti > 65 anni con iperuricemia asintomatica febuxostat (40-80 mg) è risultato superiore rispetto a un approccio terapeutico basato su modifiche dello stile di vita (dieta e attività fisica) e, nei due terzi dei casi, sull’uso di basse dosi di allopurinolo (121). Negli studi FACT (Febuxostat versus Allopurinol Control Trial in subjects with gout) e APEX (Phase III, Febuxostat, Allopurinol and Placebo-Controlled Study in Gout Subjects), il trattamento con febuxostat fino a 52 settimane ha dimostrato di portare a target la maggioranza della popolazione trattata, e la sua tollerabilità si è rivelata molto elevata anche nei pazienti > 65 anni con iperuricemia con deposito di urato (102,103,121). Nel paziente anziano, per definizione pluripatologico, febuxostat risulta efficace e tollerato, come anche nel paziente con CKD, modulando la dose in base alla clearance della creatinina.
9.2 Studi CARES e FAST
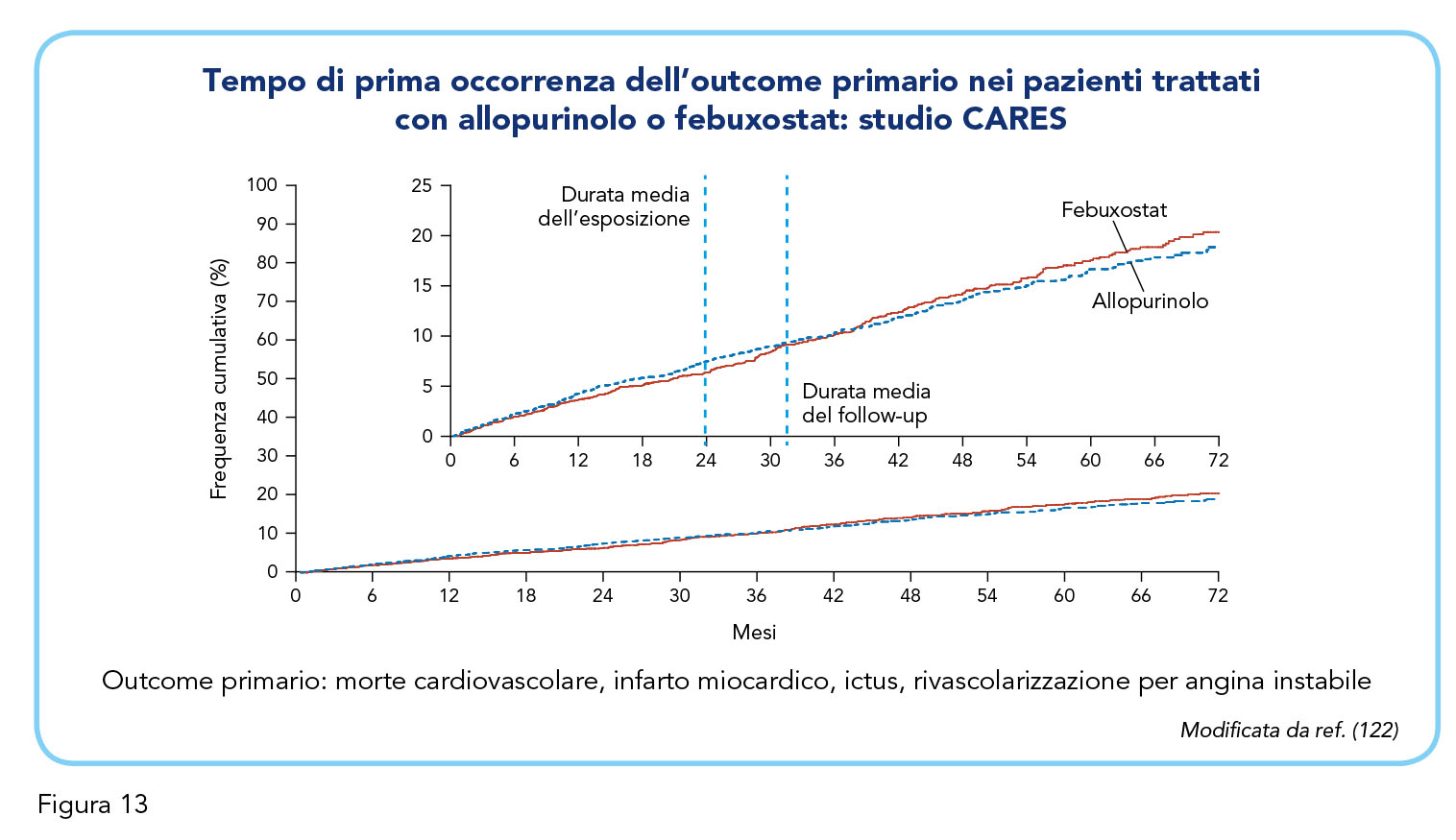
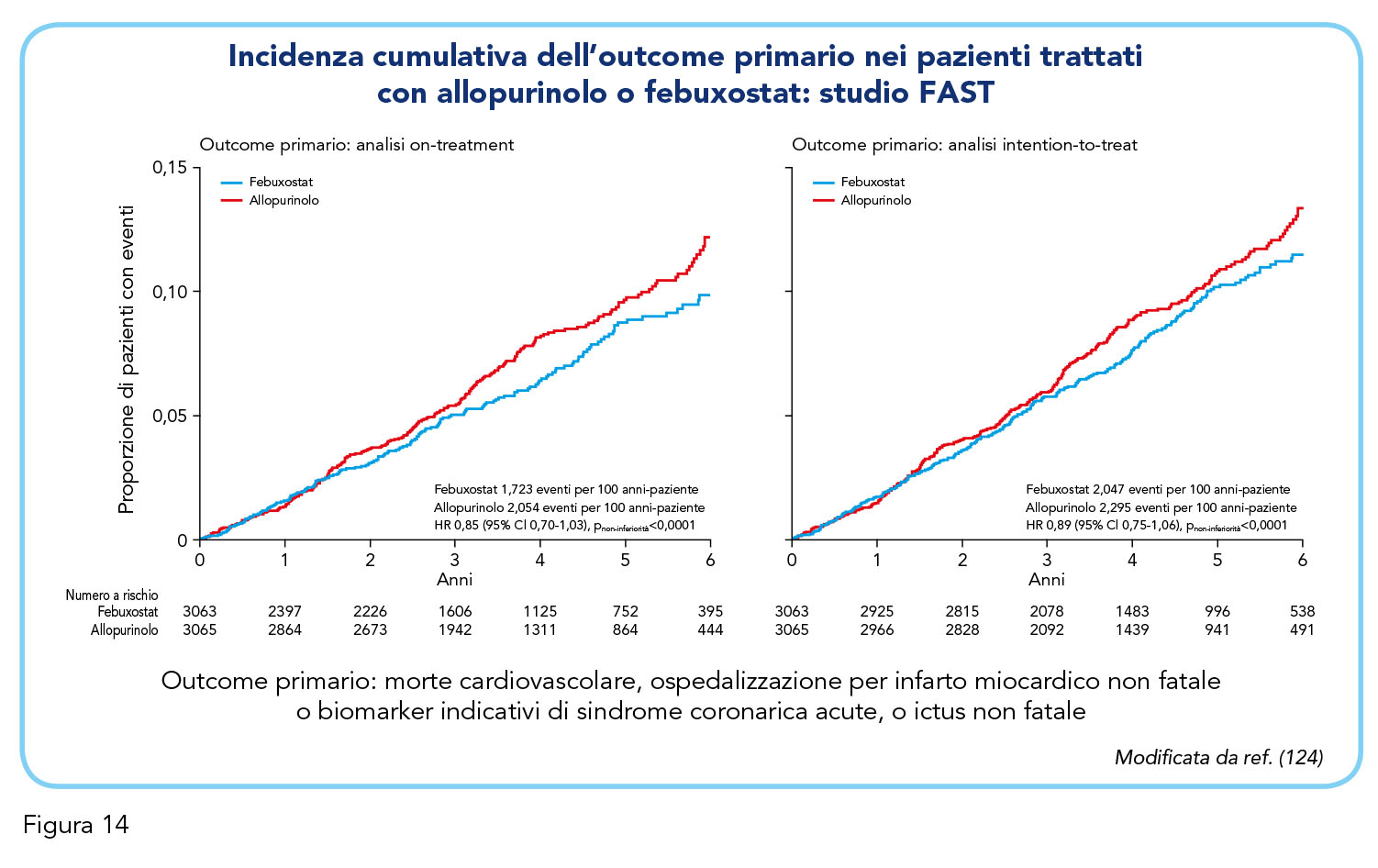
Lo studio CARES (Cardiovascular Safety of Febuxostat and Allopurinol in Patients with Gout and Cardiovascular Morbidities) è stato specificatamente disegnato per rispondere al quesito di sicurezza cardiovascolare di febuxostat formulato da FDA (122). Tuttavia, lo studio CARES non aveva portato a posizioni certe al riguardo, poiché presentava alcune non trascurabili e importanti limiti metodologici (123). Nello specifico, erano stati confrontati gli esiti cardiovascolari di molti pazienti che avevano sospeso il farmaco assegnato, lo studio aveva una durata ridotta, non forniva informazioni sul tipo di trattamento ipouricemizzante prescritto dopo il ritiro dal trattamento randomizzato e, con disegno di non inferiorità, non prevedeva un braccio placebo. La frequenza di eventi cardiovascolari è risultata simile nei due bracci di trattamento (Figura 13) ma nei pazienti trattati con febuxostat l’analisi intention-to-treat ha evidenziato un rischio di mortalità cardiovascolare e totale significativamente più alto rispetto ai pazienti trattati con allopurinolo. Per i limiti metodologici sopramenzionati, i risultati dello studio CARES devono essere interpretati con cautela e, conseguentemente, la succitata differente frequenza di mortalità nei due bracci di trattamento poteva esprimere, al massimo, una minore efficacia di febuxostat nei confronti di allopurinolo (123). I risultati dello studio FAST (Febuxostat versus Allopurinol Streamlined Trial), recentemente pubblicato, consentono di definire meglio il profilo di sicurezza di febuxostat (124). Lo studio è stato specificatamente richiesto dal European Union Risk Management Plan per verificare la sicurezza cardiovascolare di febuxostat rispetto al trattamento standard con allopurinolo. Lo studio, prospettico, randomizzato, in aperto con valutazione in cieco degli endpoint, ha confrontato febuxostat (80-120 mg/die) e allopurinolo con disegno di non-inferiorità. Sono stati arruolati 6.128 pazienti con iperuricemia cronica con deposito di urato (85,3% di sesso maschile) ed almeno un fattore di rischio cardiovascolare addizionali, precedentemente trattati con allopurinolo (124).
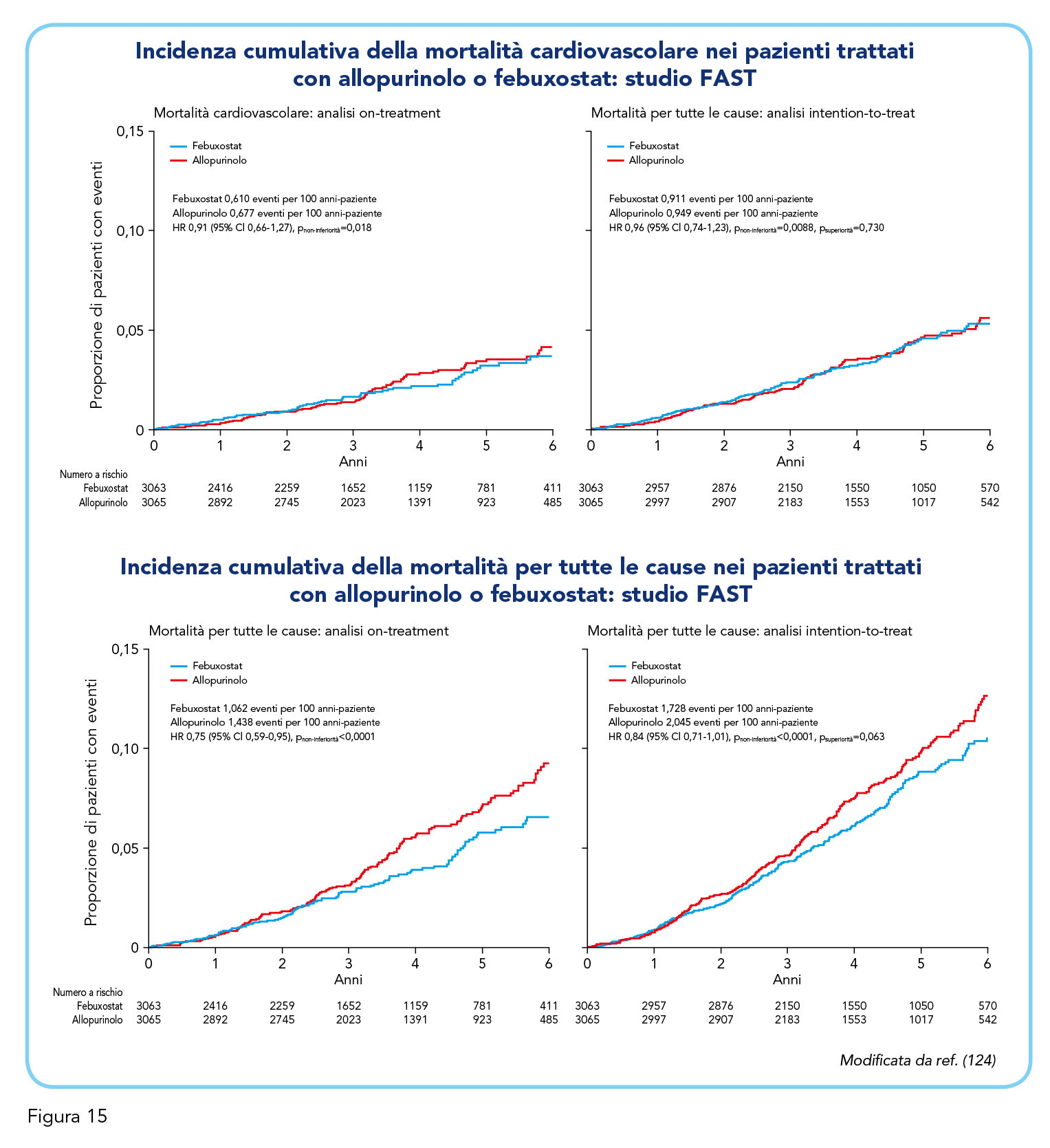
Febuxostat è risultato non inferiore ad allopurinolo per l’endpoint primario (un composito di ospedalizzazione per infarto miocardico non fatale o riscontro di un aumento dei biomarker indicativi di sindrome coronarica acuta, ictus non fatale o morte cardiovascolare) nell’analisi on-treatment (hazard ratio aggiustato pari a 0,85, intervallo di confidenza al 95% compreso tra 0,70 e 1,03, limite di non inferiorità pari a 1,3), risultato confermato nell’analisi intention-to-treat (Figura 14). La non inferiorità di febuxostat rispetto ad allopurinolo è risultata evidente anche per vari outcome secondari compresa la morte per cause cardiovascolari (hazard ratio aggiustato pari a 0,91, intervallo di confidenza al 95% compreso tra 0,66 e 1,27) e per tutte le cause (hazard ratio aggiustato pari a 0,75, intervallo di confidenza al 95% compreso tra 0,59 e 0,95) (Figura 15).
I risultati dello studio FAST appaiono robusti e rassicuranti in merito alla sicurezza cardiovascolare di febuxostat nella larga maggioranza dei pazienti con iperuricemia cronica con deposito di urato, anche se non consentono di trarre conclusioni definitive relativamente ai pazienti con malattia cardiovascolare più severa (124). Questi nuovi dati hanno dunque portato alla revisione delle indicazioni sulla sicurezza cardiovascolare di febuxostat riportate nel riassunto delle caratteristiche del prodotto (RCP), a tutto vantaggio di una gestione ottimale dell’iperuricemia cronica con deposito di urato.
In sintesi, lo studio FAST ha dimostrato che febuxostat non è inferiore ad allopurinolo per quanto riguarda l’incidenza dell’endpoint cardiovascolare primario e il suo uso a lungo termine non è associato a un aumento del rischio di mortalità o di eventi avversi gravi, confutando così gli esiti dello studio CARES.
Inoltre, appare meritevole di menzione una recente metaanalisi di studi che hanno confrontato la sicurezza cardiovascolare di febuxostat e allopurinolo che ha dimostrato un migliore profilo di sicurezza cardiovascolare di febuxostat rispetto ad allopurinolo (125).
- Inibizione della xantina ossidasi e protezione cardiovascolare
In conclusione, si discute del dualismo della condizione iperuricemica: da una parte le problematiche osteoarticolari, dall’altra le complicanze cardiovascolari, renali e metaboliche. La condizione di iperuricemia cronica, specie se non controllata, determina un elevato rischio di mortalità sia cardiovascolare che per tutte le cause. Elevati livelli di acido urico non debbono più essere associati soltanto all’iperuricemia cronica con deposito di urato, ma riflettono una problematica più estesa con ripercussioni cardio-nefro-metaboliche. I depositi subclinici di urato possono aumentare il rischio cardiovascolare, ad esempio, destabilizzando le placche aterosclerotiche e aumentando il rischio di cardiomiopatia ischemica (126). È ormai evidente come l’iperuricemia cronica aumenti progressivamente il rischio di ipertensione sintomatica e determini un peggioramento prognostico di varie patologie cardiovascolari (1-3). Lo studio Rotterdam riporta preoccupanti proiezioni circa i danni coronarici e cerebrovascolari in presenza di iperuricemia (26), mentre lo studio URRAH descrive un aumento della mortalità cardiovascolare e per tutte le cause in vari setting (tra cui scompenso e CKD), già a livelli di acido urico di 4,5-5 mg/dL in pazienti senza iperuricemia (21,29). Poiché il rischio nasce a livelli di acido urico < 6 mg/dL, si invita a ragionare diversamente: la precipitazione di acido urico non è la causa primaria e il processo inizia prima. Di conseguenza, l’iperuricemia asintomatica va sistematicamente ricercata. Di fatti, le linee guida della Società Internazionale dell’Ipertensione 2020 raccomandano di monitorare i livelli circolanti di acido urico (127). Bisogna inoltre tener conto sia della produzione che dell’escrezione dell’acido urico, oltre che la predisposizione genetica (es. se un soggetto è iperproduttore di acido urico, mangiare fruttosio di sintesi aumenterà il suo rischio di iperuricemia), quando si decide quale terapia implementare. Poiché la lesività da dismetabolismo dell’acido urico è da ricondurre ai depositi di urato monosodico, ai livelli di acido urico per sé e all’iperattività della XO, bisogna modulare la XO (17).
A livello di sicurezza cardiovascolare, allopurinolo e febuxostat si equivalgono, ma febuxostat risulta più stabile a dosi elevate e, quindi, più efficace nell’attenuare le oscillazioni dei livelli di acido urico (a cui è stato attribuito un significato prognostico sfavorevole). Il rischio di problematiche cardiovascolari, renali e metaboliche connesse al dismetabolismo dell’acido urico sembra dipendente principalmente dal livello di attività della XO che può favorire la formazione di placche, l’infiammazione endoteliale e l’attivazione del sistema renina-angiotensina. L’inibizione della XO rappresenta, quindi, il trattamento ipouricemizzante di riferimento sia nei soggetti iperproduttori che nei soggetti ipoescretori. A conferma di ciò, il trattamento con inibitori della XO è associato ad una riduzione dell’ipertrofia ventricolare sinistra e ad un miglioramento del controllo della pressione arteriosa, della funzione renale e dell’assetto metabolico. Nel confronto allopurinolo vs febuxostat, lo studio FAST ha dimostrato un’equivalenza tra i due farmaci in termini di sicurezza cardiovascolare e una tendenza verso un miglior outcome cardiovascolare con febuxostat (122-124). Lo studio FEATHER descrive, inoltre, un effetto nefroprotettivo da parte di febuxostat nei pazienti con CKD (108). Infine, i trial clinici DAPA-HF, PARADIGM-HF, SOCRATES-Reduced, LIFE/REENAL, EMPA-REG e EMPEROR-REDUCED mostrano una significativa riduzione dell’acido urico e un significativo miglioramento dell’outcome clinico con farmaci cardiovascolari dotati anche di un effetto uricosurico (86-91). Nell’ottimizzare la strategia di gestione dell’iperuricemia cronica con deposito di urato, occorre dunque anche prestare grande attenzione ai farmaci prescritti a causa delle comorbidità e che possono influenzare in modo sostanziale i livelli di acido urico (vedi Tabella 1).
- Conclusioni
Il progetto “Iperuricemia, depositi di urato e malattia cardio-nefro-metabolica: la quadratura del cerchio” è nato dall’esigenza di un dibattito scientifico tra le figure professionali maggiormente coinvolte nella gestione del dismetabolismo dell’acido urico. Specialisti di area cardio-nefro-metabolica e reumatologica con comprovata esperienza nella gestione del dismetabolismo dell’acido urico hanno contribuito, attraverso l’interazione con il board scientifico, a identificare le aree grigie di conoscenza ed evidenziare e risolvere problematiche di orientamento gestionale nel contesto dell’iperuricemia cronica con deposito di urato.
Il ruolo dell’acido urico, dei suoi livelli plasmatici e dei suoi depositi articolari e tissutali come fattore di rischio cardiovascolare è oggi oggetto di attivo dibattito scientifico con un numero crescente di studi che ne suggeriscono un ruolo importante nelle patologie cardio-nefro-metaboliche. Questa “relazione pericolosa” tra acido urico e malattie extra-articolari, peraltro, sembra che cominci a delinearsi già per valori di uricemia al di sotto della soglia di 6 mg/dL che le raccomandazioni internazionali dei reumatologi suggeriscono come target terapeutico per i pazienti con iperuricemia cronica con deposito di urato. Inoltre, esiste la possibilità che ciò che si vede, i livelli di acido urico, siano solo la parte emersa di un più ampio meccanismo di danno vascolare che potrebbe risiedere nella produzione esagerata o nella mancata clearance di alcuni prodotti intermedi della sintesi dello stesso, con attività pro-ossidante la cui capacità di nuocere sarebbe proporzionale allo stato ossidativo di base del soggetto o alla efficienza del sistema anti-ossidante. È possibile, quindi, che analoghi livelli di acido urico circolante possano svolgere una diversa azione nociva in ragione della labilità del substrato vascolare nei confronti degli stessi o del meccanismo biochimico che ha contributo a generarli. In luce di tutto ciò e dalle discussioni emerse nel corso degli eventi di Napoli e Bologna, sono stati stilati 6 statement conclusivi, riportati nella Figura 16.
Spicca, in primis, l’esigenza di effettuare una valutazione sistematica dei livelli di acido urico nei propri pazienti, anche in assenza di evidente sintomatologia articolare o manifestazioni gottose acute, altresì in considerazione della comprovata correlazione tra iperuricemia e danno cardio-nefro-metabolico (statement 1). A partire da ciò, scaturisce la necessità di sviluppare, nel paziente iperuricemico, una strategia terapeutica a tutto tondo, che tenga in considerazione comorbidità, terapie concomitanti e fenotipo eziologico, sviluppando i dettami della medicina di complessità che promulga un approccio patient-oriented, in opposizione a quello disease-oriented (statement 2). Inoltre, bisogna considerare la crescente letteratura che dimostra l’influenza positiva o negativa sui valori di uricemia di medicinali prescritti per condizioni patologiche pregresse e concomitanti, rivelandosi perciò o potenziali strumenti fruibili a beneficio del paziente o ostacoli al raggiungimento del target terapeutico. Tale approccio gestionale di complessità, non potrà poi esimersi dall’informare il paziente sull’importanza di una trasformazione dello stile di vita − in termini di dieta, calo ponderale e attività fisica − e dell’aderenza sia a queste modifiche che alla terapia farmacologica (statement 3). L’assunzione di purine attraverso carni rosse, fruttosio di sintesi, birra e altri alimenti, promuove la biogenesi di acido urico, diventando altamente nociva se non tenuta sotto controllo, soprattutto nei pazienti “iperproduttori”. Il fine ultimo, dunque, sarà quello di condurre i pazienti al di sotto delle soglie di rischio definite dalle linee guida e dagli studi sul tema (< 6,0 mg/dL nei pazienti con malattia da deposito di urato o < 5,0 mg/dL nella forma più severa di malattia). A questo scopo, gli esperti concordano su un intervento precoce con terapia ipouricemizzante tramite l’impiego di inibitori della XO (statement 4). La XO si viene sempre più configurando come una protagonista nella patogenesi del danno vascolare soprattutto in quelle condizioni in cui la sua attività viene esageratamente aumentata per effetto di uno stimolo ipossico/ischemico o infiammatorio cronico, quale quello rappresentato dalla flogosi vascolare aterogenica. Le evidenze della letteratura trialistica sembrano suggerire la possibilità che il blocco della XO, sia nei pazienti “iperproduttori” che “ipoescretori”, possa configurarsi come un prezioso strumento di protezione cardiovascolare in molti ma non in tutti i pazienti ad aumentato rischio cardiovascolare (statement 5). Il naturale derivato di questa ipotesi interpretativa è rappresentato dalla necessità di poter disporre di misure affidabili e riproducibili del grado di attività della XO per individuare al meglio quegli individui, probabilmente molti, che possono maggiormente beneficiare di un blocco potente e selettivo della XO. Nelle more che vengano definiti strumenti biochimici adeguatamente semplici e riproducibili per identificare soggetti idealmente candidabili a strategie di prevenzione cardiovascolare basate sul possibile uso di inibitori della XO. Non appare inutile ricordare come attualmente l’indicazione all’uso degli inibitori della XO sia rappresentata dal trattamento dell’iperuricemia cronica con deposito di urato con anamnesi o presenza di tofi e/o di artrite gottosa, nel caso di febuxostat, e per tutte le forme di iperuricemia (> 9 mg/dL) non controllabili con la dieta e nelle complicazioni cliniche degli stati di iperuricemia, nel caso di allopurinolo. Nell’impostazione dello schema terapeutico ipouricemizzante si dovrà poi, infine, contemplare le specifiche delle opzioni terapeutiche in termini di interazione farmacologica, in caso di comorbidità, stabilità ed efficacia del trattamento ai dosaggi comunemente impiegati, anche in considerazione delle oscillazioni deleterie dei livelli di acido urico e dei possibili benefici in termini di protezione cardiovascolare (statement 6).
Considerato quanto esposto in questa rassegna appare quantomai verosimile che da questo trattamento possa derivare, parallelamente al beneficio nei riguardi della malattia da deposito di urato, una non trascurabile protezione cardiovascolare e renale. Una maggiore attenzione al mondo sommerso della malattia da deposito di urato appare, quindi, quantomai opportuna per contrastare lesività articolare ed extra-articolare di questa condizione clinica.
Bibliografia
- Nurmohamed MT. Cardiovascular risk in inflammatory arthritis: rheumatoid arthritis and gout. Lancet Rheumatol 2020; published online Sept 1. https://doi.org/10.1016/S2665-9913(20)30221-6.
- Zhu Y, et al. Comorbidities of gout and hyperuricemia in the US general population: NHANES 2007-2008. Am J Med 2012; 125: 679-687.e1.
- Richette P, et al. Revisiting comorbidities in gout: a cluster analysis. Ann Rheum Dis 2015;74: 142–47.
- Williams, B., Mancia, G., Spiering, W., Agabiti Rosei, E., Azizi, M., Burnier, M., Clement, D. L., Coca, A., de Simone, G., Dominiczak, A., Kahan, T., Mahfoud, F., Redon, J., Ruilope, L., Zanchetti, A., Kerins, M., Kjeldsen, S. E., Kreutz, R., Laurent, S., … Brady, A. (2018). 2018 ESC/ESH Guidelines for the management of arterial hypertension. The Task Force for the management of arterial hypertension of the European Society of Cardiology (ESC) and the European Society of Hypertension (ESH). European Heart Journal, 39(33), 3021–3104. https://doi.org/10.1093/EURHEARTJ/EHY339.
- Richette P, et al. 2016 updated EULAR evidence-based recommendations for the management of gout. Ann Rheum Dis. 2017 Jan;76(1):29-42.
- Trifirò, G., Morabito, P., Cavagna, L., Ferrajolo, C., Pecchioli, S., Simonetti, M., Bianchini, E., Medea, G., Cricelli, C., Caputi, A. P., & Mazzaglia, G. (2013). Epidemiology of gout and hyperuricaemia in Italy during the years 2005–2009: a nationwide population-based study. Annals of the Rheumatic Diseases, 72(5), 694–700. https://doi.org/10.1136/ANNRHEUMDIS-2011-201254
- Selvaraj, S., Claggett, B. L., Pfeffer, M. A., Desai, A. S., Mc Causland, F. R., McGrath, M. M., Anand, I. S., van Veldhuisen, D. J., Kober, L., Janssens, S., Cleland, J. G. F., Pieske, B., Rouleau, J. L., Zile, M. R., Shi, V. C., Lefkowitz, M. P., McMurray, J. J. V., & Solomon, S. D. (2020). Serum uric acid, influence of sacubitril–valsartan, and cardiovascular outcomes in heart failure with preserved ejection fraction: PARAGON-HF. European Journal of Heart Failure, 22(11), 2093–2101. https://doi.org/10.1002/EJHF.1984
- Wallace KL, et al. Increasing prevalence of gout and hyperuricemia over 10 years among older adults in a managed care population. J Rheumatol 2004; 31: 1582–1587.
- Desideri G, et al. Is it time to revise the normal range of serum uric acid levels? Eur Rev Med Pharmacol Sci. 2014;18(9):1295-306.
- Fishberg AM. The interpretation of blood uric acid in hypertension. Arch Intern Med. 1924;34(4):503-507.
- Glynn RJ, et al. Trends in serum uric acid levels 1961-1980. Arthritis Rheum. 1983;26(1):87-93.
- Choi HK, , et al. Obesity, weight change, hypertension, diuretic use, and risk of gout in men: the Health Professionals Follow-up Study. Arch Intern Med. 2005;165:742–748. doi: 10.1001/archinte.165.7.742
- Choi HK, et al. Purine-rich foods, dairy and protein intake, and the risk of gout in men. N Engl J Med. 2004;350:1093–1103. doi: 10.1001/archinte.165.7.742
- Choi HK, et al. Alcohol intake and risk of incident gout in men: a prospective study. Lancet 2004; 363(9417):1277–1281. doi: 10.1016/S0140-6736(04)16000-5.
- Choi HK, Curhan G. Soft drinks, fructose consumption, and the risk of gout in men: prospective cohort study. BMJ 2008; 336: 309–312.
- Choi JW, et al. Sugar-sweetened soft drinks, diet soft drinks, and serum uric acid level: the Third National Health and Nutrition Examination Survey. Arthritis Rheum 2008; 59: 109–116. doi: 10.1002/art.23245.
- Borghi C, et al. Urate-Lowering Drugs and Prevention of Cardiovascular Disease: The Emerging Role of Xanthine Oxidase Inhibition. Hypertension. 2016 Mar;67(3):496-8. doi: 10.1161/HYPERTENSIONAHA.115.06531. Epub 2016 Jan 25. PMID: 26865197.
- Bardin T, et al. Definition of hyperuricemia and gouty conditions. Curr. Opin. Rheumatol. 2014, 26, 186–191.
- Dorwart, B. B. Thomas sydenham (1624-1689), on gout: 1717. Journal of Clinical Rheumatology, 2004; 10(4), 227. https://doi.org/10.1097/01.RHU.0000135772.83956.74
- Shah A et al. Gout, hyperuricemia, and the risk of cardiovascular disease: cause and effect? Curr Rheumatol Rep. 2010 Apr;12(2):118-24. doi: 10.1007/s11926-010-0084-3.
- Casiglia E, et al. Working Group on Uric Acid and Cardiovascular Risk of the Italian Society of Hypertension (SIIA). Serum uric acid and fatal myocardial infarction: detection of prognostic cut-off values: The URRAH (Uric Acid Right for Heart Health) study. J Hypertens. 2020 Mar;38(3):412-419.
- Zhao G., Huang L., Song M., Song Y. Baseline serum uric acid level as a predictor of cardiovascular disease related mortality and all-cause mortality: A meta-analysis of prospective studies. Atherosclerosis, 2013; 231:1, pp 61-68. DOI:https://doi.org/10.1016/j.atherosclerosis.2013.08.023
- Yu W, Cheng JD. Uric Acid and Cardiovascular Disease: An Update From Molecular Mechanism to Clinical Perspective. Front Pharmacol. 2020 Nov 16;11:582680. doi: 10.3389/fphar.2020.582680.
- Ndrepepa G. Uric acid and cardiovascular disease. Clin Chim Acta. 2018 Sep;484:150-163. doi: 10.1016/j.cca.2018.05.046.
- Wang J et al. J. Hyperuricemia and risk of incident hypertension: a systematic review and meta-analysis of observational studies. PLoS One. 2014 Dec 1;9(12):e114259. doi: 10.1371/journal.pone.0114259.
- Bos MJ, et al. Uric acid is a risk factor for myocardial infarction and stroke: the Rotterdam study. Stroke. 2006 Jun;37(6):1503-7. doi: 10.1161/01.STR.0000221716.55088.d4.
- Holme I et al. Uric acid and risk of myocardial infarction, stroke and congestive heart failure in 417,734 men and women in the Apolipoprotein MOrtality RISk study (AMORIS). J Intern Med. 2009 Dec;266(6):558-70. doi: 10.1111/j.1365-2796.2009.02133.x.
- Kim HK, et al. Uric Acid Variability as a Predictive Marker of Newly Developed Cardiovascular Events in Type 2 Diabetes. Front Cardiovasc Med. 2021 Dec 2;8:775753. doi: 10.3389/fcvm.2021.775753.
- Working Group on Uric Acid and Cardiovascular Risk of the Italian Society of Hypertension (SIIA). The association of uric acid with mortality modifies at old age: data from the uric acid right for heart health (URRAH) study. J Hypertens. 2022 Apr 1;40(4):704-711. doi: 10.1097/HJH.0000000000003068.
- Sciacqua, A., Perticone, M., Tassone, E. J., Cimellaro, A., Miceli, S., Maio, R., Sesti, G., & Perticone, F. (2015). Uric acid is an independent predictor of cardiovascular events in post-menopausal women. International Journal of Cardiology, 197, 271–275. https://doi.org/10.1016/j.ijcard.2015.06.069.
- Montalcini T, et al. Relation between serum uric acid and carotid intima-media thickness in healthy postmenopausal women. Intern Emerg Med. 2007 Mar;2(1):19-23. doi: 10.1007/s11739-007-0004-3.
- Kannel WB. Metabolic risk factors for coronary heart disease in women: perspective from the Framingham Study. Am Heart J. 1987 Aug;114(2):413-9. doi: 10.1016/0002-8703(87)90511-4.
- Kim SY, Guevara JP, Kim KM, Choi HK, Heitjan DF, Albert DA. Hyperuricemia and coronary heart disease: a systematic review and meta-analysis. Arthritis Care Res (Hoboken). 2010 Feb;62(2):170-80. doi: 10.1002/acr.20065.
- Holme I, Aastveit AH, Hammar N, Jungner I, Walldius G. Uric acid and risk of myocardial infarction, stroke and congestive heart failure in 417,734 men and women in the Apolipoprotein MOrtality RISk study (AMORIS). J Intern Med. 2009 Dec;266(6):558-70. doi: 10.1111/j.1365-2796.2009.02133.x.
- Cameron JS. Uric Acid and renal disease. Nucleosides Nucleotides Nucleic Acids. 2006;25(9-11):1055-64.
- Obermayr RP, et al. Elevated uric acid increases the risk for kidney disease. J Am Soc Nephrol. 2008;19(12):2407- 13. 40. doi: 10.1681/ASN.2008010080.
- Degli Esposti L, et al. Hyperuricemia is associated with increased hospitalization risk and healthcare costs: Evidence from an administrative database in Italy. Nutr Metab Cardiovasc Dis. 2016;26(10):951-61. doi: 10.1016/j.numecd.2016.06.008.
- Li L. et al. Is hyperuricemia an independent risk factor for new-onset chronic kidney disease?: A systematic review and meta-analysis based on observational cohort studies. BMC Nephrol. 2014 Jul 27;15:122. doi: 10.1186/1471-2369-15-122.
- Zoppini G, et al. Serum uric acid levels and incident chronic kidney disease in patients with type 2 diabetes and preserved kidney function. Diabetes Care. 2012 Jan;35(1):99-104. doi: 10.2337/dc11-1346.
- Luo Q, et al. Serum uric acid and cardiovascular mortality in chronic kidney disease: a meta-analysis. BMC Nephrol. 2019 Jan 14;20(1):18. doi: 10.1186/s12882-018-1143-7.
- Kodama S, et al. Association between serum uric acid and development of type 2 diabetes. Diabetes Care. 2009 Sep;32(9):1737-42. doi: 10.2337/dc09-0288.
- Zhou C, et al. Positive association of serum uric acid with new-onset diabetes in Chinese women with hypertension in a retrospective analysis of the China Stroke Primary Prevention Trial. Diabetes Obes Metab. 2020 Sep;22(9):1598-1606. doi: 10.1111/dom.14072.
- Niskanen L, et al. Serum uric acid as a harbinger of metabolic outcome in subjects with impaired glucose tolerance: the Finnish Diabetes Prevention Study. Diabetes Care. 2006 Mar;29(3):709-11. doi: 10.2337/diacare.29.03.06.dc05-1465.
- Perticone F, et al. Serum uric acid and 1-h postload glucose in essential hypertension. Diabetes Care. 2012 Jan;35(1):153-7. doi: 10.2337/dc11-1727.
- Indraratna, P. L., Stocker, S. L., Williams, K. M., Graham, G. G., Jones, G., & Day, R. O. (2010). A proposal for identifying the low renal uric acid clearance phenotype. Arthritis Research and Therapy, 12(6), 1–3. https://doi.org/10.1186/AR3191/METRICS
- Polito L, et al. Xanthine oxidoreductase: A leading actor in cardiovascular disease drama. Redox Biol. 2021 Nov 24;48:102195.
- Viana-Huete V, Fuster JJ. Potential Therapeutic Value of Interleukin 1b-targeted Strategies in Atherosclerotic Cardiovascular Disease. Rev Esp Cardiol (Engl Ed). 2019 Sep;72(9):760-766. English, Spanish. doi: 10.1016/j.rec.2019.03.006.
- Fini MA, et al. Brief report: The uricase mutation in humans increases our risk for cancer growth. Cancer Metab. 2021 Sep 15;9(1):32. doi: 10.1186/s40170-021-00268-3.
- Álvarez-Lario B, Macarrón-Vicente J. Uric acid and evolution. Rheumatology (Oxford). 2010 Nov;49(11):2010-5. doi: 10.1093/rheumatology/keq204.
- Clarson LE, et al. Increased cardiovascular mortality associated with gout: a systematic review and metaanalysis. Eur J Prev Cardiol. 2015 Mar;22(3):335-43.
- Liu SC, et al. Gout and Risk of Myocardial Infarction: A Systematic Review and Meta-Analysis of Cohort Studies. PLoS One. 2015 Jul 31;10(7):e0134088. doi: 10.1371/journal.pone.0134088. PMID: 26230580; PMCID:PMC4521845.
- Andrés M, et al. Silent Monosodium Urate Crystal Deposits Are Associated With Severe Coronary Calcification in Asymptomatic Hyperuricemia: An Exploratory Study. Arthritis Rheumatol. 2016 Jun;68(6):1531-9.
- Feig DI, Kang DH, Johnson RJ. Uric acid and cardiovascular risk. N Engl J Med 2008;359(17):1811- 21.
- Virdis A, et al. From the Working Group on Uric Acid and Cardiovascular Risk of the Italian Society of Hypertension. Identification of the Uric Acid Thresholds Predicting an Increased Total and Cardiovascular Mortality Over 20 Years. Hypertension. 2020 Feb;75(2):302-308.
- So A, et al. Uric acid transport and disease. J Clin Invest. 2010;120(6):1791–1799.
- Butler R, et al. Allopurinol normalizes endothelial dysfunction in type 2 diabetics with mild hypertension. Hypertension. 2000; 35:746–751.
- Desco MC, et al. Xanthine oxidase is involved in free radical production in type 1 diabetes: protection by allopurinol. Diabetes. 2002; 51:1118–1124.
- Farquharson CA, et al. Allopurinol improves endothelial dysfunction in chronic heart failure. Circulation. 2002; 106:221–226.
- Aslan M, et al. Oxygen radical inhibition of nitric oxide-dependent vascular function in sickle cell disease. Proc Natl Acad Sci USA. 2001;98:15215–15220.
- Battelli MG, et al. Pathophysiology of circulating xanthine oxidoreductase: new emerging roles for a multi-tasking enzyme. Biochim Biophys Acta. 2014;1842(9):1502-1517
- Hare JM, Johnson RJ. Uric acid predicts clinical outcomes in heart failure: insights regarding the role of xanthine oxidase and uric acid in disease pathophysiology. Circulation. 2003 Apr 22;107(15):1951-3. doi: 10.1161/01.CIR.0000066420.36123.35.
- Huang H, . Uric acid and risk of heart failure: a systematic review and meta-analysis. Eur J Heart Fail. 2014 Jan;16(1):15-24. doi: 10.1093/eurjhf/hft132.
- Ogino K, . Uric acid-lowering treatment with benzbromarone in patients with heart failure: a double-blind placebo-controlled crossover preliminary study. Circ Heart Fail. 2010 Jan;3(1):73-81. doi: 10.1161/CIRCHEARTFAILURE.109.868604.
- Puddu P, et al. Relationships among hyperuricemia, endothelial dysfunction and cardiovascular disease: molecular mechanisms and clinical implications. J Cardiol. 2012 May;59(3):235-42. doi: 10.1016/j.jjcc.2012.01.013.
- Martillo, M. A., Nazzal, L., & Crittenden, D. B. (2014). The crystallization of monosodium urate. Current Rheumatology Reports, 16(2), 1–8. https://doi.org/10.1007/S11926-013-0400-9/FIGURES/2
- Borghi C, Tykarski A, Widecka K, Filipiak KJ, Domienik-Karłowicz J, Kostka-Jeziorny K, Varga A, Jaguszewski M, Narkiewicz K, Mancia G. Expert consensus for the diagnosis and treatment of patient with hyperuricemia and high cardiovascular risk. Cardiol J. 2018;25(5):545-563. doi: 10.5603/CJ.2018.0116.
- Borghi C, Domienik-Karłowicz J, Tykarski A, Widecka K, Filipiak KJ, Jaguszewski MJ, Narkiewicz K, Mancia G. Expert consensus for the diagnosis and treatment of patient with hyperuricemia and high cardiovascular risk: 2021 update. Cardiol J. 2021;28(1):1-14. doi: 10.5603/CJ.a2021.0001.
- Perez-Ruiz F, Calabozo M, Pijoan JI, Herrero-Beites AM, Ruibal A. Effect of urate-lowering therapy on the velocity of size reduction of tophi in chronic gout. Arthritis Rheum. 2002 Aug;47(4):356-60. doi: 10.1002/art.10511.
- Viazzi F, et al.Serum uric acid levels predict new-onset type 2 diabetes in hospitalized patients with primary hypertension: the MAGIC study. Diabetes Care. 2011;34(1):126-128. 24. doi: 10.2337/dc10-0918.
- Sui X, et al. Uric acid and the development of metabolic syndrome in women and men. Metabolism. 2008;57(6):845-52. doi: 10.1016/j.metabol.2008.01.030.
- Saag KG et al. Epidemiology, risk factors, and lifestyle modifications for gout. Arthritis Res Ther. 2006;8 Suppl 1(Suppl 1):S2. doi: 10.1186/ar1907.
- MacFarlane et al. Gout: a review of nonmodifiable and modifiable risk factors. Rheum Dis Clin North Am. 2014 Nov;40(4):581-604. doi: 10.1016/j.rdc.2014.07.002.
- Yokose, C., McCormick, N., & Choi, H. K. (2021). The role of diet in hyperuricemia and gout. Current Opinion in Rheumatology, 33(2), 135–144. https://doi.org/10.1097/BOR.0000000000000779
- Rai, S. K., Fung, T. T., Lu, N., Keller, S. F., Curhan, G. C., & Choi, H. K. (2017). The Dietary Approaches to Stop Hypertension (DASH) diet, Western diet, and risk of gout in men: prospective cohort study. BMJ, 357, 1794. https://doi.org/10.1136/BMJ.J1794
- Yokose, C., McCormick, N., Lu, N., Joshi, A. D., Curhan, G., & Choi, H. K. (2022). Adherence to 2020 to 2025 Dietary Guidelines for Americans and the Risk of New-Onset Female Gout. JAMA Internal Medicine, 182(3), 254–264. https://doi.org/10.1001/JAMAINTERNMED.2021.7419
- de Backer, G., Jankowski, P., Kotseva, K., Mirrakhimov, E., Reiner, Ž., Rydén, L., Tokgözoğlu, L., Wood, D., de Bacquer, D., Jankowski, P., Kotseva, K., Reiner, Z., Rydén, L., Tokgözoğlu, L., Wood, D., de Bacquer, D., Abreu, A., Aguiar, C., Badariene, J., … Fearnley, M. (2019). Management of dyslipidaemia in patients with coronary heart disease: Results from the ESC-EORP EUROASPIRE V survey in 27 countries. Atherosclerosis, 285, 135–146. https://doi.org/10.1016/j.atherosclerosis.2019.03.014
- De Vera MA, Marcotte G, Rai S, Galo JS, Bhole V. Medication adherence in gout: a systematic review. Arthritis Care Res (Hoboken). 2014 Oct;66(10):1551-9. doi: 10.1002/acr.22336.
- Abhishek A, et al. Long-term persistence and adherence on urate-lowering treatment can be maintained in primary care-5-year follow-up of a proof-of-concept study. Rheumatology (Oxford). 2017 Apr 1;56(4):529-533. doi: 10.1093/rheumatology/kew395.
- Mantarro, S., Capogrosso-Sansone, A., Tuccori, M., Blandizzi, C., Montagnani, S., Convertino, I., Antonioli, L., Fornai, M., Cricelli, I., Pecchioli, S., Cricelli, C., & Lapi, F. (2015). Allopurinol adherence among patients with gout: an Italian general practice database study. International Journal of Clinical Practice, 69(7), 757–765. https://doi.org/10.1111/IJCP.12604
- Ughi, N., Prevete, I., Ramonda, R., Cavagna, L., Filippou, G., Manara, M., Bortoluzzi, A., Parisi, S., Ariani, A., & Scirè, C. A. (2019). The Italian Society of Rheumatology clinical practice guidelines for the diagnosis and management of gout. Reumatismo, 71(S1), 50–79. https://doi.org/10.4081/reumatismo.2019.1176
- Punzi L. The role of clinical inertia in suboptimal management of gout. Swiss Med Wkly. 2020 Aug 19;150:w20334. doi: 10.4414/smw.2020.20334.
- Punzi L, Scanu A, Galozzi P, Luisetto R, Spinella P, Scirè CA, Oliviero F. One year in review 2020: gout. Clin Exp Rheumatol. 2020 Sep-Oct;38(5):807-821.
- Latourte A, et al. 2020 Recommendations from the French Society of Rheumatology for the management of gout: Management of acute flares. Joint Bone Spine. 2020 Oct;87(5):387-393. doi: 10.1016/j.jbspin.2020.05.001.
- Pascart T, et al. 2020 recommendations from the French Society of Rheumatology for the management of gout: Urate-lowering therapy. Joint Bone Spine. 2020 Oct;87(5):395-404. doi: 10.1016/j.jbspin.2020.05.002.
- FitzGerald JD, et al. 2020 American College of Rheumatology Guideline for the Management of Gout. Arthritis Care Res (Hoboken). 2020 Jun;72(6):744-760. doi: 10.1002/acr.24180.
- McDowell K, et al. Dapagliflozin reduces uric acid concentration, an independent predictor of adverse outcomes in DAPA-HF. Eur J Heart Fail. 2022 Jun;24(6):1066-1076. doi: 10.1002/ejhf.2433.
- Mogensen UM, et al; PARADIGM-HF Investigators and Committees. Sacubitril/valsartan reduces serum uric acid concentration, an independent predictor of adverse outcomes in PARADIGM-HF. Eur J Heart Fail. 2018 Mar;20(3):514-522. doi: 10.1002/ejhf.1056. Epub 2017 Nov 30.
- Høieggen A, et al; LIFE Study Group. The impact of serum uric acid on cardiovascular outcomes in the LIFE study. Kidney Int. 2004 Mar;65(3):1041-9. doi: 10.1111/j.1523-1755.2004.00484.x.
- Verma S. Association between uric acid levels and cardio-renal outcomes and death in patients with type 2 diabetes: A subanalysis of EMPA-REG OUTCOME. Diabetes Obes Metab. 2020 Jul;22(7):1207-1214. doi: 10.1111/dom.13991.
- Ferreira JP, et al. Empagliflozin and uric acid metabolism in diabetes: A post hoc analysis of the EMPA-REG OUTCOME trial. Diabetes Obes Metab. 2022 Jan;24(1):135-141. doi: 10.1111/dom.14559.
- Doehner W, et al. Uric acid and sodium-glucose cotransporter-2 inhibition with empagliflozin in heart failure with reduced ejection fraction: the EMPEROR-reduced trial. Eur Heart J. 2022 Sep 21;43(36):3435-3446. doi: 10.1093/eurheartj/ehac320.
- Elion GB, et al. Potentiation by inhibition of drug degradation: 6-substituted purines and xanthine oxidase. Biochem Pharmacol1963;12: 85-93.
- Pacher P, et al. Therapeutic effects of xanthine oxidase inhibitors: renaissance half a century after the discovery of allopurinol. Pharmacol Rev. 2006;58(1):87-114.
- Takano Y, et al. Selectivity of febuxostat, a novel non-purine inhibitor of xanthine oxidase/xanthine dehydrogenase. Life Sci. 2005 Mar 4;76(16):1835-47.
- Rundles RW, et al. Allopurinol in the treatment of gout. Ann Intern Med 1966;64:229-58.
- Horiuchi H, et al. A comparative study on the hypouricemic activity and potency in renal xanthine calculus formation of two xanthine oxidase/xanthine dehydrogenase inhibitors: TEI-6720 and allopurinol in rats. Res Commun Mol Pathol Pharmacol1999; 104:307-19.
- Mayer MD, et al. Pharmacokinetics and pharmacodynamics of febuxostat, a new non-purine selective inhibitor of xanthine oxidase in subjects with renal impairment. Am J Ther 2005;12:22-34.
- Becker MA, et al. Febuxostat, a novel nonpurine selective inhibitor of xanthine oxidase: a twenty-eight-day, multicenter, phase II, randomized, double-blind, placebocontrolled placebo controlled, dose-response clinical trial examining safety and efficacy in patients with gout. Arthritis Rheum 2005; 52: 916-23.
- Schumacher HR Jr, et al. Febuxostat in the treatment of gout: 5-yr findings of the FOCUS efficacy and safety study. Rheumatology (Oxford) 2009; 48: 188-94.
- Becker MA, et al. The urate-lowering efficacy and safety of febuxostat in the treatment of the hyperuricemia of gout: the CONFIRMS trial. Arthritis Res Ther 2010; 12:R63.
- Terkeltau BR. Update on gout: new therapeutic strategies and options. Nat Rev Rheumatol. 2010;6(1):30-8.
- Becker MA, et al. Febuxostat compared with allopurinol in patients with hyperuricemia and gout. N Engl J Med 2005;353:2450-2461.
- Schumacher HR Jr, et al. Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout: a 28-week, phaseIII, randomized, double-blind, parallel-group trial. Arthritis Rheum. 2008; 59: 1540-1548.
- Singh JA, et al. Comparative effectiveness of urate lowering with febuxostat versus allopurinol in gout: analyses from large U.S. managed care cohort. Arthritis Res Ther. 2015 May 12;17(1):120. doi: 10.1186/s13075-015-0624-3.
- Higgins P, et al. Xanthine oxidase inhibition for the treatment of cardiovascular disease: a systematic review and metaanalysis. Cardiovasc Ther. 2012 Aug;30(4):217-26.
- Hare JM, et al. Impact of Oxypurinol in Patients With Symptomatic Heart Failure Results of the OPT-CHF Study. J Am Coll Cardiol 2008;51:2301-2309.
- Givertz MM, et al. NHLBI Heart Failure Clinical Research Effects of Xanthine Oxi dase Inhibition in Hyperuricemic Heart Failure Patients: The Xanthine Oxidase Inhibition for Hyperuricemic Heart Failure Patients (EXACT-HF) Study. Circulation. 2015;131(20):1763- 71.
- Otaki Y, et al. Association of plasma xanthine oxidoreductase activity with severity and clinical outcome in patients with chronic heart failure. Int J Cardiol. 2017 Feb 1;228:151-157.
- Nicholls A, et al. Effect of oestrogen therapy on plasma and urinary levels of uric acid. Br Med J. 1973 Feb 24;1(5851):449-51.
- Fang J, et al. Serum uric acid and cardiovascular mortality the NHANES I epidemiologic follow-up study, 1971-1992. National Health and Nutrition Examination Survey. JAMA. 2000 May 10;283(18):2404-10.
- Kimura K, et al. Febuxostat Therapy for Patients With Stage 3 CKD and Asymptomatic Hyperuricemia: A Randomized Trial. Am J Kidney Dis. 72(6): 798-810.
- Mackenzie IS, et al; ALL-HEART Study Group. Allopurinol versus usual care in UK patients with ischaemic heart disease (ALL-HEART): a multicentre, prospective, randomised, open-label, blinded-endpoint trial. Lancet. 2022 Oct 8;400(10359):1195-1205. doi: 10.1016/S0140-6736(22)01657-9. PMID: 36216006.
- Terkeltaub R, et al. Recent developments in our understanding of the renal basis of hyperuricemia and the development of novel antihyperuricemic therapeutics. Arthritis Res Ther. 2006;8 Suppl 1(Suppl 1):S4. doi: 10.1186/ar1909.
- Wright DF, et al. Predicting allopurinol response in patients with gout. Br J Clin Pharmacol. 2016 Feb;81(2):277-89. doi: 10.1111/bcp.12799.
- Stamp LK, et al. Starting dose is a risk factor for allopurinol hypersensitivity syndrome: a proposed safe starting dose of allopurinol. Arthritis Rheum. 2012 Aug;64(8):2529-36. doi: 10.1002/art.34488.
- Yokose C, et al. Heart disease and the risk of allopurinol-associated severe cutaneous adverse reactions: a general population-based cohort study. CMAJ. 2019 Sep 30;191(39):E1070-E1077. doi: 10.1503/cmaj.190339
- Ramasamy SN, et al. Allopurinol hypersensitivity: a systematic review of all published cases, 1950-2012. Drug Saf. 2013 Oct;36(10):953-80. doi: 10.1007/s40264-013-0084-0.
- Stamp LK, et al. Impaired response or insufficient dosage? Examining the potential causes of “inadequate response” to allopurinol in the treatment of gout. Semin Arthritis Rheum. 2014 Oct;44(2):170-4. doi: 10.1016/j.semarthrit.2014.05.007.
- Neogi T. Clinical practice. Gout. N Engl J Med. 2011 Feb 3;364(5):443-52. doi: 10.1056/NEJMcp1001124.
- Mukoyoshi M, et al. In vitro drug-drug interaction studies with febuxostat, a novel non-purine selective inhibitor of xanthine oxidase: plasma protein binding, identification of metabolic enzymes and cytochrome P450 inhibition. Xenobiotica. 2008 May;38(5):496-510. doi: 10.1080/00498250801956350.
- Jackson RL, Hunt B, MacDonald PA. The efficacy and safety of febuxostat for urate lowering in gout patients ≥65 years of age. BMC Geriatr. 2012 Mar 21;12:11. doi: 10.1186/1471-2318-12-11.
- White WB, et al. Cardiovascular safety of febuxostat or allopurinol in patients with gout. N Engl J Med 2018;378: 1200-10.
- Katsiki N, et al. The future of febuxostat after the Cardiovascular Safety of Febuxostat and Allopurinol in Patients with Gout and Cardiovascular Morbidities (CARES) trial: who CARES? Expert Opin Pharmacother. 2018 Oct 4:1-4. doi: 10.1080/14656566.2018.1532503
- Mackenzie IS, et al. FAST Study Group. Long-term cardiovascular safety of febuxostat compared with allopurinol in patients with gout (FAST): a multicentre, prospective, randomised, open-label, non-inferiority trial. Lancet. 2020 Nov 28;396(10264):1745-1757.
- Gao L et al. Cardiovascular safety of febuxostat compared to allopurinol for the treatment of gout: A systematic and meta-analysis Clin Cardiol. 2021;44:907–916)
- Kimura Y, Tsukui D, Kono H. Uric Acid in Inflammation and the Pathogenesis of Atherosclerosis. Int J Mol Sci. 2021 Nov 17;22(22):12394. doi: 10.3390/ijms222212394.
- Unger T, et al. 2020 International Society of Hypertension Global Hypertension Practice Guidelines. Hypertension. 2020 Jun;75(6):1334-1357. doi: 10.1161/HYPERTENSIONAHA.120.15026.
BOARD SCIENTIFICO
Claudio Borghi, in qualità di responsabile scientifico
Professore Ordinario di Medicina Interna, Università di Bologna, Direttore Unità Operativa di Medicina Interna, Policlinico S. Orsola-Malpighi, Bologna
Stefano Carugo
Professore Associato Malattie dell’Apparato Cardiovascolare, Università degli Studi di Milano, Direttore UOC Cardiologia, Ospedale Maggiore Policlinico, Milano
Santina Cottone
Professore Ordinario di Nefrologia, Direttore UOSD di Nefrologia e Dialisi, AOUP Palermo, Palermo
Giovambattista Desideri
Professore Ordinario di Medicina Interna, Università degli Studi dell’Aquila, L’Aquila
Claudio Ferri
Direttore Scuola di Specialità in Medicina Interna, Università degli Studi dell’Aquila, L’Aquila
Vincenzo Montemurro
Responsabile Ambulatorio di Cardiologia, Presidio “Scillesi d’America” – Scilla ASP Reggio Calabria, Reggio Calabria
Maria Lorenza Muiesan
Professore Ordinario di Medicina Interna Università di Brescia, Brescia
Pasquale Perrone Filardi
Professore Ordinario di Cardiologia Università degli Studi Federico II, Napoli
Roberto Pontremoli
Professore Ordinario di Medicina Interna, Università degli Studi di Genova, Genova
Leonardo Punzi
Direttore Unità Operativa Complessa di Reumatologia, Azienda Ospedale Università di Padova, Padova
Giorgio Sesti
Professore ordinario di Medicina Interna presso l’Università La Sapienza di Roma, Roma
Pierfranco Terrosu
Responsabile Unità Operativa Complessa di Cardiologia, Asl Sassari, Sassari
SPECIALISTI PARTECIPANTI
Francesco Annunziata, Nola (NA)
Antonietta Baruffo, Napoli
Mario Armando Battista, Roma
Antonio Bonelli, Matera
Gesualdo Campolo, Prato
Caterina Carollo, Palermo
Valeria Cernaro, Messina
Rosa Paola Cerra, Catanzaro
Maria Elisabetta Cianchetti, Cagliari
Mario Cordoni, Piombino (LI)
Nicolò Dasseni, Brescia
Giovanni D’Avola, Catania
Giovanni Demicheli, Alessandria
Paolo Di Giosia, Ascoli Piceno
Elisabetta Di Meglio, Ischia (NA)
Salvatore Evola, Palermo
Oriana Fabrazzo, Pisa
Alessandra Fagnani, Monza (MB)
Anna Maria Ferrigno, Milano
Giovanni Gaudio, Somma Lombardo (VA)
Andrea Giorgi, Roma
Marco Giuggia, Settimo Torinese (TO)
Xhulia Gjoni, Monza (MB)
Alessandro Graziani, Ravenna
Patrizia Grimaldi, Messina
Kapya Kikonde, Santorso (VI)
Lucia La Mura, Angri (SA)
Salvatore Lenti, Andria (BT)
Paolo Lentini, Bassano Del Grappa (VI)
Alessandro Lo Nigro, Treviso
Alessandro Locatelli, Bergamo
Cristina Lovello, Roma
Alessandro Marchi, Pavia
Roberta Marcialis, Rivoli (TO)
Guido Mariani, Ascoli Piceno
Annamaria Masu, Lodi
Matilde Menchelli, Pisa
Giuseppe Mennella, Padova
Xenia Metcalf, Udine
Francesco Mingione, Caserta
Manuela Morini, Gubbio (PG)
Matteo Nardin, Vercelli
Giada Panascia, Catania
Alice Parisi, Pinerolo (TO)
Monica Peralta, Cagliari
Carlotta Perego, Agrate Brianza (MB)
Federica Piani, Bologna
Domenico Pontoriero, Tropea (VV)
Federica Portolan, Trento
Pasquale Predotti, Salerno
Giuseppe Restivo, Enna
Matteo Righini, Bologna e Ravenna
Stefano Rizza, Roma
Mario Rizzo, Enna
Calogero Rodofili, Roma
Mattia Rossi, Verona
Salvatore Ruosi, Caserta
Federico Ruosi, Caserta
Massimo Sainaghi, Milano
Anita Scarsella, Avezzano (AQ)
Alberto Sentimentale, Roma
Antonello Silvestri, Rocca Priora (RM)
Marco Simone, Milano
Pierangelo Tedesco, Foggia
Massimiliano Tosto, Palmanova (UD)
Antonella Ventresca, L’Aquila
- Contesto
Nel corso dell’ultimo decennio, l’interesse nei confronti del dismetabolismo dell’acido urico è cresciuto in maniera esponenziale. Tale attenzione emerge sia dalla crescente incidenza della malattia da deposito di urato che dalla recente individuazione di uno stretto nesso fisiopatologico tra dismetabolismo dell’acido urico e problematiche cardio-nefro-metaboliche. A differenza del recente passato in cui l’attenzione del clinico si soffermava solo sulla nefropatia da calcoli di acido urico e sulla gotta, osservando così solo la “punta dell’iceberg” del problema, sappiamo oggi che l’iperuricemia cronica con deposito di urato è associata a ipertensione, obesità, diabete mellito, malattie renali e cardiovascolari, oltre che a un’aumentata mortalità (1-3). Alla luce delle più recenti solide evidenze, inoltre, le linee guida ESC/ESH hanno incluso la valutazione dei livelli di uricemia tra le raccomandazioni per l’inquadramento clinico del paziente iperteso (4). Tuttavia, sebbene l’iperuricemia cronica con deposito di urato sia pienamente curabile, meno del 50% dei pazienti iperuricemici viene portato al target raccomandato dalle linee guida (5). La gestione terapeutica delle problematiche cliniche del dismetabolismo dell’acido urico è, infatti, ancora largamente inadeguata e subottimale, sia in termini di identificazione dei pazienti da trattare che di target terapeutici da raggiungere e di gestione farmacologica. Molti pazienti ricevono non di rado un trattamento solo “cosmetico”, inefficace al raggiungimento del target, peraltro mantenuto per un periodo di tempo limitato. Il problema è fin troppo spesso affrontato in maniera monodisciplinare − la più rilevante tra le criticità − e si fatica a raggiungere e mantenere i valori di uricemia al di sotto della soglia minima dei 6 mg/dL raccomandata dalle linee guida EULAR (5). A questo concorre spesso l’impiego di molecole non adeguatamente potenti e/o sottodosate rispetto al target da raggiungere.
Le conoscenze attuali possono consentire di giungere a una “quadratura del cerchio” nel dibattito sulla gestione adeguata del dismetabolismo dell’acido urico attraverso un confronto culturale e un dibattito scientifico partecipato che rappresentano ad oggi gli strumenti più adeguati all’acquisizione del consenso scientifico sul tema.
- Presentazione del progetto
In questo contesto si inscrive il progetto “Iperuricemia, depositi di urato e malattia cardio-nefro-metabolica: la quadratura del cerchio”, nato nel 2022 da MEDIABOUT S.r.l. Editore Scientifico e da un board scientifico costituito da esperti di riconosciuta competenza nell’ambito del dismetabolismo dell’acido urico. Il progetto si è delineato in tre fasi successive, di cui la prima, propedeutica allo sviluppo della progettualità, ha previsto un incontro del board scientifico durante il quale sono state definite le tematiche d’interesse ed è stato delineato il profilo degli specialisti che avrebbero preso parte al progetto. Nello specifico, sulla base delle molteplici evidenze disponibili e della ormai chiara e indispensabile necessità di un momento di riflessione multidisciplinare tra le figure professionali maggiormente coinvolte nella gestione del dismetabolismo dell’acido urico, sono stati identificati come target privilegiati del progetto gli specialisti di area cardio-nefro-metabolica e reumatologica con comprovata esperienza nella gestione del dismetabolismo dell’acido urico. Durante il primo confronto scientifico, il board ha anche elaborato un questionario in forma di survey online volto a fotografare la percezione del “problema iperuricemia” nella pratica clinica quotidiana degli specialisti partecipanti, allo scopo di identificare le aree di incertezza gestionale, in ragione di ciò maggiormente meritevoli di approfondimenti e chiarificazioni.
Nella seconda fase, attraverso la partecipazione attiva del gruppo di specialisti coinvolti, le risposte alla survey sono state elaborate statisticamente e analizzate dal punto di vista clinico da parte del board scientifico, al fine di evidenziare gli output oggetto di discussione nelle successive attività d’incontro sul territorio. Gli eventi realizzati a Bologna e Napoli hanno visto la partecipazione del board scientifico e degli 80 specialisti sia ospedalieri che ambulatoriali selezionati uniformemente in tutta Italia. Attraverso un confronto attivo ed articolato sui dati emersi dalla survey analizzati in relazione alle evidenze dalla letteratura, si è giunti alla definizione di statement per la gestione delle problematiche cliniche connesse al dismetabolismo dell’acido urico, oggetto della presente pubblicazione, ultimo step previsto dalla progettualità. Lo scopo ultimo era quello di sensibilizzare l’attenzione del medico nei confronti dell’iperuricemia cronica con deposito di urato, promuovere la ricerca intorno a questa problematica clinica e favorire una sua gestione patient-oriented più che disease-oriented, in linea con i dettami della medicina della complessità.
- Survey
In generale, gli esiti della survey hanno descritto una visione moderna sul tema dell’iperuricemia cronica con deposito di urato, in cui i frutti della diffusione delle conoscenze in tempi recenti riguardanti le implicazioni cardio-nefro-metaboliche sono divenuti temi di gestione pratica. Il campione dei medici partecipanti ha mostrato un’elevata attenzione e consapevolezza sul tema, e la valutazione dei livelli di acido urico – anche al di là della condizione di gotta – sembra essere ormai divenuto un aspetto di rilievo nella pratica clinica.
Secondo quanto emerso dalla survey, la valutazione dell’uricemia rientra in modo sistematico nella pratica clinica dell’85% dei medici, i quali nel 61% dei casi stimano la prevalenza dell’iperuricemia nei loro pazienti compresa tra il 30 e il 60%, con una non trascurabile rilevanza delle forme iatrogene nell’opinione del 56% dei medici (Figura 1, pannelli A, B, C). I dati epidemiologici invero confermano una prevalenza vicina al 61% dell’iperuricemia cronica in entrambi i sessi, soprattutto negli ultra 75enni (6). Rilevante è l’osservazione che la correzione del dismetabolismo dell’acido urico è ritenuto un aspetto prioritario dal 51% dei medici (Figura 2, pannello A). Inoltre, il 59% dei medici ritiene che la reale dimensione epidemiologica dell’iperuricemia cronica con deposito di urato sia sottostimata, poiché troppo spesso erroneamente identificata esclusivamente con il classico attacco artritico gottoso (Figura 2, pannello B). I dati di letteratura mostrano, invero, che tali depositi possono evidenziarsi in pazienti con livelli di acido urico > 6 mg/dL senza che questi presentino alcun segno clinico di gotta (6).
Il percepito delle implicazioni extra-articolari – e dei meccanismi fisiopatologici a esse sottostanti – da parte dei medici appare anch’esso al passo con le evidenze scientifiche, soprattutto per quanto riguarda le complicanze cardiovascolari, seguite da quelle renali e metaboliche. Circa l’80% dei medici ritiene che l’iperuricemia aumenti il rischio di eventi cardiovascolari ed è d’accordo che l’attivazione del sistema renina-angiotensina, l’aumento dei mediatori della flogosi vascolare, la disfunzione endoteliale-stress ossidativo, l’incremento della pressione arteriosa e l’insulino-resistenza siano tra i meccanismi responsabili dell’associazione tra iperuricemia cronica con e senza deposito di urato e complicanze cardiovascolari e renali (Figura 3, pannelli A e B).
Come primo approccio al paziente, il 53% dei medici somministrerebbe la terapia ipouricemizzante a pieno dosaggio (come da indicazioni per ciascun farmaco); il 66% ritiene che il fallimento della terapia e la scarsa aderenza al trattamento siano dovuti alla mancata profilassi antinfiammatoria con colchicina e/o FANS (Figura 4, pannelli A e B).
Sul tema dei farmaci cardiovascolari che hanno anche un documentato effetto sui livelli di uricemia, il 56% dei medici ritiene che farmaci quali sacubitril-valsartan, SGLT2 inibitori e losartan possono contribuire in modo non trascurabile a ridurre i livelli di acido urico, in linea con i dati della letteratura (7) (Figura 5, pannello A). Per quanto riguarda, invece, la presenza di malattia renale cronica di stadio 3, la maggior parte dei medici somministrerebbe inibitori della xantina-ossidasi (XO) per valori di uricemia > 6 mg/dL (37%) o > 7 mg/dL (36%) mentre il 21% degli intervistati li userebbero sempre (Figura 5, pannello B). Infine, la maggior parte dei medici sostiene che un protocollo dietetico e/o l’uso di inibitori della XO vadano considerati quando l’elevazione dell’uricemia è combinata a deposito di urato, quando un paziente nefropatico mostra valori di uricemia > 7,0 mg/dL, quando il paziente ha precedenti noti o suggestivi di attacco gottoso o litiasi renale e uricemia > 7,0 mg/dL o quando presenta un aumentato rischio cardiovascolare (Figura 5, pannello C).
Questa survey evidenzia, dunque, un approccio terapeutico moderno che contempla l’impiego di farmaci ad azione uricosurica indiretta per la gestione del paziente con comorbidità. Anche nel contesto della malattia renale cronica si denota un orientamento verso un intervento precoce che non attende l’instaurarsi di valori estremi di uricemia. Questi risultati ben fotografano l’opinione degli specialisti partecipanti nei riguardi di una condizione clinica che racchiude nei livelli plasmatici di un semplice prodotto del metabolismo un universo di conoscenze complesse che possono trovare la loro interpretazione solo in un contesto di collaborazione multidisciplinare. Ciononostante, esiste ancora una porzione rilevante di medici (il 15%, ossia 1 medico su 7) che non valuta sistematicamente l’uricemia nella sua pratica clinica e un 49% che ritiene la correzione dei suoi livelli un aspetto secondario e non prioritario. Sebbene si sia comunque evidenziata un’evoluzione nell’approccio gestionale dell’uricemia tra gli specialisti partecipanti rispetto a quello di un recente passato, rimangono dunque sia aree grigie di conoscenza da affrontare che nozioni da consolidare. è a partire da queste basi che sono state costruite le relazioni tenutesi nel corso degli eventi di Bologna e Napoli del progetto “Iperuricemia, depositi di urato e malattia cardio-nefro-metabolica: la quadratura del cerchio”.
- Iperuricemia cronica con deposito di urato
L’iperuricemia cronica con deposito di urato oggi rappresenta una delle problematiche dismetaboliche più diffuse nel mondo occidentale (6,8). Nel nostro Paese la prevalenza dell’iperuricemia, definita da livelli circolanti di acido urico > 6,0 mg/dL (9), è aumentata di circa il 40% nell’arco di un solo quinquennio, passando dall’8,5% nel 2005 all’11,9% nel 2009 (6). Il valore medio dell’uricemia nelle popolazioni occidentali è sostanzialmente raddoppiato dagli inizi del ‘900 ai giorni nostri, passando nella popolazione maschile americana da meno di 3,5 mg/dL negli anni ‘20 (10) a 6,25 mg/dL negli anni ‘70, con un trend verso un ulteriore aumento (11). Le principali cause di questa diffusione epidemica dell’iperuricemia sono da ricercare soprattutto nella enorme frequenza dell’eccedenza ponderale e della franca obesità in tutte le fasce di età (12) e nell’aumentato consumo di cibi ricchi in purine (13), di birra e superalcolici (14) e di bevande edulcorate con fruttosio di sintesi (15,16). Il progressivo invecchiamento della popolazione e, quindi, l’espansione di quelle fasce di età in cui la prevalenza dell’iperuricemia cronica è maggiore (6), anche a causa della riduzione della funzionalità renale e, quindi, della capacità del rene di eliminare urati, rappresenta un ulteriore determinante della notevole diffusione di questa condizione nel nostro Paese. Questa rilevante diffusione dell’iperuricemia cronica con e senza deposito di urato giustifica il crescente interesse che la letteratura scientifica sta rivolgendo da alcuni anni al dismetabolismo dell’acido urico anche in ragione della sua stretta relazione con le problematiche cardio-nefro-metaboliche (9,17).
Nel recente passato, le uniche patologie fisiopatologicamente ricondotte ad un aumento dei livelli circolanti di questo metabolita erano la gotta, fondamentalmente nella sua classica estrinsecazione clinica in forma di “podagra”, e la nefrolitiasi uratica. La precipitazione di cristalli di urato monosodico a livello articolare è il determinante fisiopatologico dell’iperuricemia cronica con deposito di urato. Quando i cristalli precipitano per eccesso di soluto, o si staccano da depositi articolari preformati, innescano i diversi meccanismi sottesi alla flogosi articolare acuta che caratterizza l’iperuricemia cronica con deposito di urato (5,9,18). Questi meccanismi fisiopatologici non necessariamente si attivano in forma tumultuosa per determinare la classica estrinsecazione clinica magistralmente descritta da Thomas Sydenham (19). Studi basati sull’uso dell’ecografia articolare dimostrano, infatti, come la deposizione articolare di cristalli di urato monosodico si riscontri nei pazienti con iperuricemia cronica con deposito di urato in circa il 9% delle articolazioni esenti da segni clinici di flogosi. Ancora più interessante è l’evidenza di segni ecografici di deposito articolare di cristalli di urato monosodico nel 25% dei soggetti iperuricemici clinicamente asintomatici e senza storia di artrite acuta (5).
Le evidenze scientifiche degli ultimi anni suggeriscono, invero, da un lato l’esistenza di un non trascurabile sommerso di danno articolare da acido urico clinicamente silente e dall’altro un’ampia lesività extra-articolare di acido urico che comincia a estrinsecarsi per livelli di uricemia inferiori al limite di solubilità della molecola (5,9,18). L’iperuricemia cronica con deposito di urato, infatti, si associa frequentemente ad ipertensione, obesità, diabete mellito, malattie renali e cardiovascolari e ad un’aumentata mortalità (1-3).
- Dismetabolismo dell’acido urico e patologie cardio-nefro-metaboliche
Al fine di contestualizzare la condizione di iperuricemia cronica con deposito di urato, è stato presentato un caso clinico esemplificativo di questa categoria di pazienti: un individuo anziano (> 80 anni), con scarsa aderenza alla terapia ipouricemizzante − nonostante i sintomi articolari di iperuricemia − senza sintomatologia grave ma caratterizzato da varie comorbidità tra cui ipertensione, ridotta funzionalità renale, ipercolesterolemia, alti livelli di glicata ed elevato indice di massa corporea. Appaiono immediatamente evidenti le tre componenti principali del dismetabolismo dell’acido urico, ossia cuore, rene e metabolismo (Figura 6) (20). I dati che emergono dalla letteratura vanno identificando l’iperuricemia, anche asintomatica, come un vero e proprio predittore di danno cardiovascolare e renale e non solo come un mero marcatore di rischio (21,22). L’accumularsi nel corso del tempo di un numero impressionante di pubblicazioni scientifiche a conferma di questa osservazione ha suscitato un progressivo interesse non solo da parte della comunità scientifica ma anche della stampa laica che ha cominciato a chiedersi perché mai un paziente affetto da iperuricemia cronica con deposito di urato dovesse morire di malattie cardiovascolari e quale fosse il nesso fisiopatologico che potesse giustificare l’aumentata incidenza delle malattie cardiovascolari, renali e metaboliche. Il quesito chiave, scientificamente inappuntabile, che emerge è, dunque, se venga prima l’uovo (l’iperuricemia cronica) o la gallina (le comorbidità cardio-nefro-metaboliche), ossia quale delle due condizioni determini l’altra.
Nel contesto cardiovascolare, la faculty ha approfondito le principali comorbidità cardiovascolari associate all’aumento dei livelli di acido urico. L’iperuricemia sembra, infatti, favorire l’insorgenza e lo sviluppo di malattie cardiovascolari attraverso la modulazione di diversi meccanismi, quali la risposta infiammatoria, lo stress ossidativo, l’insulino-resistenza/diabete, lo stress del reticolo endoplasmatico e la disfunzione endoteliale (23). Tra le patologie correlate all’iperuricemia si annoverano la cardiopatia coronarica, l’ictus, l’insufficienza cardiaca congestizia, l’ipertensione arteriosa e la fibrillazione atriale, nonché un aumento del rischio di mortalità per malattia cardiovascolare nella popolazione generale e nei soggetti con cardiopatia coronarica confermata (24). È stato osservato, inoltre, come l’incremento del rischio di ipertensione associato a iperuricemia sia proporzionale all’elevazione dei livelli di uricemia (25). L’iperuricemia è un forte fattore di rischio per l’infarto del miocardio e l’ictus, soprattutto di tipo ischemico (26) e, a conferma di ciò, alcuni studi hanno rilevato un’aumentata insorgenza di infarto miocardico acuto, ictus e insufficienza cardiaca in soggetti di mezza età con aumentati livelli circolanti di acido urico senza storia di malattie cardiovascolari (27). Nei pazienti con diabete di tipo 2, l’elevata variabilità dei livelli di acido urico è stata associata a un aumento del rischio di malattia cardiovascolare sintomatica di nuova insorgenza, con conseguente necessità di intervento di rivascolarizzazione coronarica percutanea (28). Sono di particolare rilevanza, a questo proposito, le evidenze tratte dal progetto URRAH, uno studio di coorte osservazionale multicentrico basato su un ampio database di 23.475 soggetti, di età compresa tra 18 e 95 anni, di cui erano disponibili la misurazione dei livelli sierici di uricemia (mediamente 5 mg/dL; ≃ 1% con gotta) e informazioni cliniche complete su parametri metabolici, funzionalità cardiaca e renale (21). Lo studio URRAH ha avuto il merito di far emergere i livelli di acido urico < 6 mg/dL come predittori di mortalità cardiovascolare e per tutte le cause, anche indipendentemente dalla riduzione della funzionalità renale (21,29).
Alcuni studi hanno, inoltre, investigato la correlazione tra uricemia ed eventi cardiovascolari nella popolazione femminile in fase post-menopausale, tipicamente associata a un incremento nei livelli di questo prodotto del metabolismo purinico. Indipendentemente da altri fattori di rischio cardiovascolare e dalla durata della menopausa, elevati livelli di acido urico correlano con un aumento del rischio di morte ed eventi cardiovascolari maggiori, in particolare di eventi cerebrovascolari (30), oltre che con un incremento dello spessore medio-intimale carotideo, anche nei soggetti senza sindrome metabolica (31). Anche nella popolazione di Framingham e in altri studi è stata descritta una correlazione tra l’iperuricemia e il rischio coronarico nella popolazione femminile (32-34). Durante il dibattito è stato, inoltre, sottolineato come non sia solo l’aumento dei livelli di acido urico oltre le soglie di rischio identificate (> 5-6 mg/dL, in base alla popolazione considerata (21)) a determinare le malattie cardiovascolari, ma che anche le eccessive oscillazioni della sua concentrazione plasmatica siano associate all’insorgenza di eventi cardiovascolari.
Nel contesto renale, molti studi nel corso degli ultimi anni hanno dato consistenza all’ipotesi che l’iperuricemia cronica possa esercitare un effetto nefrolesivo indipendentemente dalla formazione di depositi renali di cristalli di urato monosodico (35), con un meccanismo di danno renale correlato soprattutto allo sviluppo di una malattia arteriolare pre-glomerulare che altera la risposta di autoregolazione renale del flusso ematico e causa ipertensione glomerulare (35). Molti studi epidemiologici indicano, infatti, l’esistenza di una relazione tra livelli circolanti di acido urico e declino della funzione renale, declino che inizia a concretizzarsi ancora una volta per valori di uricemia inferiori al limite di solubilità della molecola (36). In linea con queste evidenze è la dimostrazione, ottenuta dall’analisi di un ampio database amministrativo, di un significativo aumento del rischio di ospedalizzazione per malattie cardiovascolari e renali e dei relativi costi assistenziali al crescere dei livelli circolanti di acido urico già a partire da livelli di uricemia < 6 mg/dL (37). Il follow-up a lungo termine di individui non affetti da problematiche renali ha rivelato che elevati livelli di acido urico sierico (> 7,0 mg/dL negli uomini o > 6,0 mg/dL nelle donne) comportano un aumento del rischio di sviluppo di disfunzione renale cronica (CKD) (38). Questa osservazione è stata confermata da un altro studio, effettuato questa volta su soggetti diabetici di tipo 2 con funzione renale conservata, ove l’iperuricemia si è rivelata essere un fattore di rischio indipendente per lo sviluppo di CKD incidente (39). Infine, elevati livelli di acido urico sono associati a un aumento significativo del rischio di mortalità cardiovascolare nei pazienti con CKD: confrontando gli esiti di 10 studi (n = 26.660), una metanalisi ha rilevato che ogni aumento di 1 mg/dL dei livelli di acido urico sierico, analizzato come variabile continua su tutta la popolazione disponibile, comporta un aumento del rischio di mortalità cardiovascolare del 12% (40).
Per quanto riguarda il rischio di diabete di tipo 2, numerose evidenze correlano l’iperuricemia all’aumento del rischio di diabete di nuova insorgenza (41,42). I livelli sierici di acido urico sembrano peraltro agire da indicatore del destino metabolico nei soggetti con alterata tolleranza al glucosio (43). In ultimo, alcune evidenze dimostrano che l’acido urico è fortemente in grado di influenzare la glicemia post-carico in pazienti con normale tolleranza agli idrati di carbonio ed ipertensione essenziale, analogamente a quanto osservato nei soggetti con ridotta tolleranza al glucosio e nei pazienti diabetici (44).
In sintesi, l’iperuricemia cronica appare essere un marcatore integrato e indipendente di rischio cardio-nefro-metabolico. La sua riduzione per via farmacologica potrebbe, quindi, fornire una significativa protezione d’organo. Nel corso del dibattito scientifico sono stati poi approfonditi i possibili meccanismi fisiopatologici che rendono ragione delle diverse scelte terapeutiche che il clinico può implementare per la gestione di questa condizione cronica e delle comorbidità correlate.
- Caratterizzazione fenotipica dei pazienti con dismetabolismo dell’acido urico
La prevalenza dell’iperuricemia cronica con e senza deposito di urato è considerevolmente aumentata, negli uomini più che nelle donne, nel corso degli ultimi anni, a dimostrazione che ci si trova di fronte a un fenomeno epidemiologico in progressiva espansione. La prevalenza maggiore dell’iperuricemia si ha, soprattutto negli uomini, intorno ai 75-84 anni (6). È possibile identificare due fenotipi diversi di pazienti con elevati livelli di acido urico: gli “iperproduttori” (20%), con determinante genetica legata alla XO o a causa di una sovralimentazione con alimenti ricchi di purine e fruttosio di sintesi, e gli “ipoescretori” (80%) (45). È bene considerare differentemente l’iperuricemia provocata da un’eccessiva produzione o da una ridotta escrezione per attuare un’adeguata scelta terapeutica con inibitori della XO o farmaci uricosurici.
Le tappe centrali del metabolismo dell’acido urico sono rappresentate dalla conversione della ipoxantina a xantina e di quest’ultima ad acido urico ad opera dell’enzima xantina ossidoreduttasi. Questo enzima, isolato per la prima volta nel latte oltre cento anni fa, si compone di due forme tra loro interconvertibili, la XO e la xantina deidrogenasi (46). Queste due forme catalizzano le reazioni finali della via metabolica di degradazione delle purine convertendo l’ipoxantina in xantina e la xantina in acido urico. Oltre al suo ruolo nel catabolismo delle purine, la xantina ossidoreduttasi possiede un’attività di nitrito reduttasi, che genera ossido nitrico (NO), e un’attività di NADH ossidasi, che libera specie reattive dell’ossigeno (ROS). Ciascuno dei prodotti biochimici della xantina ossidoreduttasi può svolgere un ruolo fisiologico o patologico sulla base dell’entità della sua produzione (Figura 7). ROS e NO svolgono infatti un ruolo essenziale nell’immunità innata e contribuiscono a modulare il tono vascolare locale (e dunque la pressione sanguigna); tuttavia, un loro eccesso causa stress ossidativo, flogosi sistemica o disfunzione endoteliale, inducendo anche mutagenesi o citotossicità (46). Per quanto riguarda invece l’acido urico, in condizioni fisiologiche, questo favorisce un adeguato livello pressorio attraverso l’attivazione del sistema renina-angiotensina, svolge un ruolo di scavenger dei radicali liberi nei fluidi biologici e stimola i macrofagi favorendo la risposta immunitaria (46). Per contro, l’iperuricemia favorisce l’ipertensione, induce stress ossidativo a livello intracellulare e contribuisce all’infiammazione sistemica (46). Questo meccanismo comporta la produzione di IL-1b a seguito dell’assemblaggio del complesso proteico definito “inflammasoma” da parte dei macrofagi (46). IL-1b induce l’espressione di citochine proinfiammatorie, riduce l’espressione dei marcatori delle cellule muscolari lisce e promuove un cambiamento fenotipico proaterogeno; agisce dunque da “direttore d’orchestra” non solo del processo infiammatorio ma anche della conseguente aterosclerosi (47). Va inoltre menzionato che, nel corso dell’evoluzione, la specie umana ha perso l’enzima uricasi responsabile della degradazione dell’acido urico (48). Oltre ai benefici sovramenzionati, originariamente l’acido urico svolgeva probabilmente anche un ruolo di neuroprotezione, manteneva stabile la pressione arteriosa in posizione eretta e favoriva l’accumulo di grasso viscerale, tutti meccanismi che mostrano i loro risvolti negativi nell’uomo moderno che subisce, dunque, gli effetti deleteri degli elevati livelli circolanti di questa molecola (49).
6.1 Acido urico, xantina ossidasi e possibili meccanismi fisiopatologici
I livelli di uricemia possono essere determinati da un eccesso di produzione o da una ridotta escrezione di acido urico ed esistono elementi per immaginare che questo aspetto debba essere preso in considerazione nell’ambito delle scelte terapeutiche (Figura 8). Infatti, mentre l’eccesso di produzione potrebbe giovarsi di un intervento indirizzato a inibire i meccanismi di trasformazione biochimica incentrati sulla XO, i limiti della escrezione potrebbero essere superati mediante l’impiego di farmaci uricosurici. Nell’ambito del rischio cardiovascolare sono ipotizzabili tre principali meccanismi fisiopatologici alla base della lesività cardio-nefro-metabolica del dismetabolismo dell’acido urico, meccanismi che possono variamente embricarsi nei diversi pazienti.
In primo luogo, va considerato lo stato infiammatorio cronico legato alla malattia con deposito di urato, patologia troppo spesso erroneamente interpretata come confinata agli attacchi artritici acuti. L’iperuricemia cronica con deposito di urato, invero, è una malattia cronica nella quale gli accessi acuti rappresentano solo la “punta dell’iceberg” di un processo infiammatorio cronico che, in quanto tale, condiziona un aumentato rischio di eventi cardiovascolari (50,51). A conferma di ciò anche la presenza di depositi subclinici di urato a livello articolare nel paziente iperuricemico è associato a una maggiore estensione della patologia aterosclerotica (52).
In secondo luogo, va considerata la possibilità di una lesività diretta dell’acido urico, indipendente dalla precipitazione di cristalli di urato monosodico a livello articolare e tissutale, come suggerito dall’evidenza che la relazione tra livelli circolanti di acido urico e problematiche cardio-nefro-metaboliche si delinea a partire da livelli di uricemia inferiori al limite di solubilità della molecola nei fluidi biologici (9,17,53,54). A tale riguardo non appare inutile sottolineare come le funzioni fisiologiche o, all’opposto, fisiopatologiche dell’acido urico siano condizionate dai suoi livelli raggiunti nei liquidi biologici e dal contesto biochimico in cui si trova (55). Questa interpretazione fisiopatologica, pur supportata da robuste evidenze scientifiche, non giustifica l’uso della terapia farmacologica ipouricemizzante che è attualmente raccomandata solo per i pazienti con iperuricemia cronica con deposito di urato.
Da ultimo, va considerato il complesso ruolo biologico dell’enzima chiave nella sintesi di acido urico, la XO, enzima capace di esercitare effetti ora favorevoli ora lesivi condizionati principalmente dal suo livello di attività (46). Invero, il meccanismo prevalente potrebbe essere proprio quello della sintesi eccessiva di acido urico e, quindi, la sua identificazione potrebbe rappresentare il presupposto essenziale per identificare correttamente i pazienti iperuricemici passibili di un intervento terapeutico indirizzato anche alla prevenzione cardiovascolare.
La xantina ossidoreduttasi mostra una certa attività ossidasica in presenza di una ridotta biodisponibilità di NAD+, ad esempio in quelle condizioni di ischemia/ipossia che si osservano nella flogosi vascolare aterogenica (46). In queste condizioni, peraltro, si osserva anche un aumento dell’espressione di XO e, conseguentemente, un aumento della generazione di ROS che finiscono per influenzare profondamente la fisiologia vascolare. Questo rende ragione del miglioramento della funzione vascolare che è stato descritto in diversi contesti clinici, quali il diabete mellito e lo scompenso cardiaco, in corso di trattamento con inibitori della XO (56-59). L’attività enzimatica della xantina ossidoreduttasi, soprattutto quando esageratamente aumentata, può influenzare negativamente la fisiologia vascolare perché le specie reattive dell’ossigeno − in particolare superossido e perossido di idrogeno − sono in grado di reagire con l’ossido nitrico per formare perossinitrito, una specie ossidante di natura non radicalica. Questa reazione porta a un duplice effetto negativo: da un lato la degradazione dell’ossido nitrico si accompagna a uno sbilanciamento della funzione endoteliale in senso proaterogeno, protrombotico, vasocostrittore; dall’altra il perossinitrito di per sé è una specie altamente reattiva che amplifica gli effetti dello stress ossidativo (46). Considerando il ruolo svolto da NO a livello dell’albero circolatorio − controllo del tono della parete vasale, prevenzione nell’adesione leucocitaria, inibizione dell’adesione ed aggregazione piastrinica, inibizione della proliferazione dell’intima − ben si comprende come i processi che comportano la riduzione della sua biodisponibilità causino inevitabilmente un’alterazione dell’omeostasi a livello vascolare. A conferma del coinvolgimento fisiopatologico della XO nella genesi del danno vascolare, è stato descritto un incremento dell’attività di questo enzima in sezioni di tessuto proveniente da placche aterosclerotiche ma non da tessuto vascolare di soggetti sani (60).
I ROS derivati dalla XO possono essere responsabili di una serie di processi dannosi alla base della fisiopatologia dell’insufficienza cardiaca, come l’ipertrofia cardiaca, la fibrosi miocardica, il rimodellamento del ventricolo sinistro e l’alterazione della contrattilità (61). Di conseguenza, la riduzione dell’uricemia mediante l’inibizione della XO ha mostrato effetti benefici sui marcatori di malattia in pazienti affetti da insufficienza cardiaca, come la disfunzione endoteliale e il flusso sanguigno periferico, lo squilibrio metabolico e la mortalità (62). Un recente studio ha mostrato che la riduzione dell’acido urico sierico senza l’inibizione della XO può non avere alcun effetto sulla compromissione emodinamica nell’insufficienza cardiaca, suggerendo così che sia prevalentemente l’iperattività della XO – piuttosto che l’acido urico – ad essere coinvolta nella compromissione emodinamica dell’insufficienza cardiaca (63). L’azione benefica degli inibitori della XO potrebbe essere dovuta prevalentemente alla loro capacità di migliorare indirettamente la disfunzione endoteliale riducendo lo stress ossidativo, piuttosto che alla riduzione dell’uricemia (64).
- Livelli desiderabili di uricemia e approccio non farmacologico
Come detto in precedenza, i livelli di uricemia sono determinati dal metabolismo delle purine e, in particolare, dal loro catabolismo, di cui l’acido urico è il prodotto terminale. Un aumento dei livelli di acido urico nel sangue può essere dettato da un disequilibrio tra la sua produzione endogena/assunzione e la sua escrezione che avviene sia per uricolisi batterica nell’intestino che per filtrazione glomerulare (55). Quando si parla di riduzione dei livelli circolanti di acido urico non si può prescindere dal menzionare lo stile di vita, importante determinante capace di influenzare tali valori; approfondiremo questo argomento nella sezione 7.2.
L’approccio farmacologico deve essere necessariamente accompagnato da un intervento non farmacologico. Rilevante menzionare come tale intervento non farmacologico in un paziente in cui sia importante attenzionare i livelli di acido urico possa essere implementato anche in via preventiva.
7.1 Valori di riferimento dell’uricemia
I valori di riferimento di una grandezza biologica vengono stabiliti in base a criteri arbitrari e convenzionali, nella generalità dei casi facendo riferimento ai valori più frequentemente riscontrati negli individui sani della specie umana. Si può, infatti, ragionevolmente supporre che l’organismo vivente, come organismo e come specie, tenda a mantenere costanti i valori dei suoi parametri biochimici entro certi limiti che definiscono, appunto, l’intervallo di riferimento. Per questo motivo il dato di laboratorio generalmente viene confrontato con un determinato intervallo di valori definiti “valori normali”, o più correttamente “valori di riferimento”, ovvero come valori riscontrati nella popolazione costituita dagli individui sani. Questo tipo di approccio all’individuazione degli “intervalli di riferimento” evidentemente ha come momento centrale, di rilevanza fondamentale, la corretta individuazione della popolazione dei soggetti che vengono utilizzati per ottenerli.
Utilizzando questo tipo di approccio sono stati identificati per la popolazione italiana due distinti intervalli di riferimento per l’uricemia: 3,5-7,2 mg/dL nei maschi adulti e nelle donne in postmenopausa e 2,6-6,0 mg/dL nelle donne in età premenopausale (9). Questa differenziazione dipende dal fatto che nelle donne in età fertile l’uricemia tende ad essere più bassa per l’effetto uricosurico degli estrogeni. I valori medi di acido urico sono, inoltre, dipendenti da variabili come peso, altezza, pressione arteriosa, funzionalità renale e assunzione di alcolici. È ragionevole pensare che il limite superiore dell’intervallo di riferimento dell’uricemia negli esseri umani possa coincidere con il limite di solubilità della molecola che nel plasma è pari a circa 6,8 mg/dL a 37°C (65), in quanto la sua lesività articolare di acido urico dipende proprio dalla precipitazione dell’urato monosodico con formazione di cristalli. In vitro, è stato peraltro osservato che il processo di deposizione possa avvenire anche a concentrazioni inferiori a livelli di pH più bassi e a una temperatura tissutale più bassa nelle articolazioni periferiche (limite di solubilità: 6,0 mg/dL a 35°C e pH 7,0) (66). Il processo opposto, ossia quello di risoluzione dei depositi tofacei avviene, invece, a livelli di acido urico < 5 mg/dL (66-68). A conferma di ciò, le linee guida internazionali per la gestione della iperuricemia cronica con deposito di urato raccomandano di mantenere i livelli circolanti di acido urico al limite minimo di 6 mg/dL (o < 5mg/dL nelle forme più severe di iperuricemia cronica con deposito di urato) al fine di prevenire la formazione di depositi di urato, promuovere la dissoluzione dei depositi già presenti e prevenire le riacutizzazioni artritiche (5). È interessante notare che l’influenza dell’acido urico sulla fisiopatologia cardiovascolare sembra iniziare ad estrinsecarsi per livelli circolanti di 5,0-5,5 mg/dL, inferiori al limite di solubilità della molecola e, quindi, largamente indipendenti dalla precipitazione di cristalli di urato monosodico, essenza fisiopatologica dell’iperuricemia cronica con deposito di urato (9,53,54). Anche la relazione tra uricemia, dismetabolismo glucidico (69) e sindrome metabolica (70) sembra concretizzarsi per valori di uricemia inferiori, o al massimo prossimi, al limite di solubilità della molecola.
Alla luce di queste evidenze appare opportuna una rivisitazione del concetto di normalità dell’uricemia in quanto l’approccio che ha portato alla identificazione degli attuali intervalli di riferimento, differenziati in base al genere, appare oggi minato nella sua solidità sostanzialmente da due aspetti critici, uno di ordine epidemiologico e uno di ordine scientifico. Per quanto attiene il primo, il progressivo aumento dei livelli di uricemia media nella popolazione generale fa sì che gli attuali valori di riferimento non siano in linea con quanto si osserva oggi nella popolazione generale. Questo aspetto dovrebbe condurre, in linea teorica, addirittura ad una paradossale revisione verso l’alto dei valori di riferimento attuali se l’approccio seguito per definirli dovesse continuare a essere quello statistico, basato sulla distribuzione dei valori nella popolazione generale sana. Per quanto attiene, invece, il secondo elemento di criticità, il progresso della conoscenza scientifica ha ormai attribuito incontrovertibilmente all’acido urico un ruolo fisiopatologico molto ampio, ben al di là di quanto ipotizzabile quando è stata individuata quella coorte di soggetti sani da cui il suddetto intervallo di riferimento è stato derivato con metodo statistico. Alla luce delle attuali evidenze scientifiche, in attesa di una revisione delle linee guida possibilmente centrate sul paziente, la soglia di normalità per l’uricemia non può che corrispondere a quei 6 mg/dL che le raccomandazioni internazionali già suggeriscono come obiettivo da raggiungere per il paziente con iperuricemia cronica con deposito di urato. Questo livello desiderabile è senza dubbio quello che ha le maggiori possibilità di intercettare la totalità della lesività dell’acido urico, obiettivo che sempre ci si dovrebbe prefiggere nella definizione di ogni intervallo di normalità (9).
7.2 Approccio non farmacologico
A questo proposito viene discusso come l’approccio “vincente” consista nell’agire contemporaneamente con un trattamento farmacologico e un cambiamento dello stile di vita e delle abitudini alimentari, e in particolare sull’assunzione di purine, tramite la dieta, che può determinare un incremento dei livelli di acido urico (Figura 9) (71,72). Nel valutare gli effetti della dieta in pazienti con elevati livelli di uricemia, uno studio che ha confrontato tre regimi dietetici (dieta a basso apporto di grassi, dieta mediterranea e dieta a basso contenuto di carboidrati) ha dimostrato, dopo 6 mesi, una riduzione consistente dei livelli di uricemia per tutti e tre (73). Un altro studio ha invece osservato un aumentato rischio di iperuricemia cronica e, parallelamente, cardiovascolare in soggetti maschi, seguiti per oltre 20 anni, che assumevano una dieta “Western” − ricca di carni rosse, zuccheri e grassi − rispetto a coloro che assumevano, invece, una dieta “DASH” (Dietary Approaches to Stop Hypertension) − basata soprattutto sull’apporto di frutta e verdura (74). Un terzo studio, ha trovato infine che, nelle donne, la dieta “DASH”, seguita nel corso degli anni, era la migliore in termini di outcome di uricemia, tenendo conto di obesità, uso di diuretici e consumo di alcolici. Il risultato peggiore, ancora una volta, derivava dalla dieta “Western” (75).
Sulla base di queste e altre evidenze si sconsiglia, dunque, un’alimentazione ricca di carne rossa, crostacei, frutti di mare, alcuni pesci e prodotti di origine vegetale (tra cui asparagi e lenticchie), si raccomanda di evitare l’apporto di fruttosio di sintesi tramite bevande zuccherate, di limitare l’assunzione di alcolici (in particolare di birra), di non eccedere nel consumo di uova (massimo due porzioni al giorno) e di utilizzare metodi di cottura che richiedono pochi grassi (in particolare il burro) (13-16). Alcuni di questi alimenti aumentano, infatti, il substrato purinico, favorendo la produzione di acido urico come prodotto terminale del loro metabolismo (13). Per contro, un effetto positivo della dieta in termini di riduzione dell’acido urico viene attribuito al caffè (13-16). È inoltre importante assicurare la giusta idratazione − 2L d’acqua quotidiani − e di svolgere attività fisica regolare (76). Lo stesso ragionamento vale per il decremento ponderale, che riduce in via indiretta l’insulino-resistenza e ha, quindi, un impatto notevole sui livelli circolanti di acido urico (12). Infine, è necessario prestare attenzione all’utilizzo concomitante di farmaci che possono aumentare i livelli di uricemia, come ad esempio i diuretici (17). Tutti i pazienti devono ricevere informazioni precise sulla modifica dello stile di vita richiesto, sulla dieta, sulla necessità di perdere peso (ove opportuno) e sulla stretta aderenza al trattamento raccomandato. A tal proposito, la faculty discute di come, spesso, introdurre sistematicamente tutte queste modifiche nel proprio stile di vita incontri le resistenze di molti pazienti, in particolar modo di quelli più anziani, che si vedono privati di un’ampia selezione di alimenti (magari di uso quotidiano fino a poco tempo prima). Questo sfocia dunque in una scarsissima aderenza alla terapia non farmacologica, che rende ancora più indispensabile l’attuazione di una terapia, invece, farmacologica. I due approcci sono complementari, e forse imprescindibili, per raggiungere un adeguato controllo dei livelli di uricemia e dunque la prevenzione delle conseguenze cardio-nefro-metaboliche derivanti dal suo dismetabolismo.
- La terapia farmacologica dell’iperuricemia
Poiché i livelli di uricemia possono essere determinati o da un eccesso di produzione o da una ridotta escrezione, esistono elementi per immaginare che questo aspetto debba essere preso in considerazione nell’ambito delle scelte terapeutiche. Infatti, mentre l’eccesso di produzione potrebbe giovarsi di un intervento indirizzato a inibire i meccanismi di trasformazione biochimica incentrati sulla XO, i limiti della escrezione potrebbero essere superati mediante l’impiego di farmaci uricosurici. La discussione che segue prende spunto dalle raccomandazioni fornite dalle linee guida e integra le più recenti evidenze in letteratura con gli spunti clinici pratici emersi dal confronto scientifico.
8.1 Raccomandazioni farmacologiche fornite delle linee guida
Una prima problematica che si incontra nel trattamento dell’iperuricemia cronica con deposito di urato è dunque l’aderenza alla terapia che è solo di circa il 20% poiché molti pazienti abbandonano il trattamento una volta risolto l’attacco artritico acuto (77-80). L’iperuricemia cronica con deposito di urato è la patologia reumatica più curabile e meglio conosciuta ma, paradossalmente, è la peggio curata, anche a causa della presenza di un non trascurabile grado di inerzia terapeutica da parte del medico (81).
Sebbene non vi sia stata una vera e propria innovazione farmaceutica, c’è grande fermento attorno alle linee guida nazionali ed internazionali per la gestione dell’iperuricemia cronica con deposito di urato (82). Nel corso della discussione, vengono, dunque, messe a confronto queste linee guida, in particolar modo quelle EULAR (5), quelle francesi (83,84) e quelle americane (85). L’utilizzo di colchicina, FANS o corticosteroidi è raccomandato come intervento di prima linea negli attacchi acuti, seguiti dall’impiego degli inibitori di interleuchina nei casi non responsivi alla terapia ipouricemizzante (82). La colchicina ha una valida efficacia polivalente sia a basse che alte dosi, seppur con un proporzionale aumento di effetti avversi (es. diarrea). La colchicina è inoltre raccomandata per la profilassi degli attacchi artritici acuti quando si inizia una terapia ipouricemizzante, per una durata di circa 6 mesi.
Il valore soglia d’inizio per il trattamento dell’iperuricemia definito da EULAR è di 6 mg/dL e per portare il paziente al di sotto di questi livelli bisogna intraprendere la terapia ipouricemizzante il prima possibile. La faculty discute dell’eventualità di intervenire già durante l’attacco acuto: sebbene su questo punto vi siano divergenze tra le raccomandazioni fornite dalle varie linee guida prese in considerazione, l’intervento farmacologico ipouricemizzante immediato può avere il beneficio pratico di non perdere l’occasione di curare un paziente che, al termine dell’attacco, potrebbe non ripresentarsi dal medico per cominciare la terapia. A questo si associa, peraltro, una scarsa sensibilità da parte di molti clinici sul tema dell’iperuricemia cronica con deposito di urato e delle sue conseguenze cardio-nefro-metaboliche, riducendo ulteriormente la possibilità di ricevere una terapia ipouricemizzante, soprattutto nelle donne. Si discute, inoltre, di come sia consigliabile mettere in atto una titolazione progressiva del farmaco al fine di evitare reazioni avverse dose-dipendenti. La terapia ipouricemizzante di riferimento è rappresentata dagli inibitori della XO, allopurinolo e febuxostat (5), approfonditi nel paragrafo 8.2.
Infine, l’Italia è il solo Paese a non avere un farmaco uricosurico: probenecid è permesso solo per uso ospedaliero, mentre sulfinpirazone è indicato solo nel trattamento del post-infarto. Alcuni farmaci cardiovascolari hanno un discreto effetto uricosurico indiretto (Tabella 1); è il caso delle gliflozine, di losartan e di sacubitril-valsartan che hanno un effetto sulle concentrazioni plasmatiche di acido urico, riducendole (86-91). Questi farmaci possono costituire un valido strumento per ottimizzare la strategia di gestione dell’iperuricemia e dei fattori di rischio concomitanti. Allo stesso modo, occorre prestare grande attenzione ai farmaci che possono invece modulare in direzione opposta i livelli di acido urico, aumentandone i livelli ed esacerbando la patologia, quali l’acido acetilsalicilico a basso dosaggio, molti diuretici e beta-bloccanti (Tabella 1) (66).
8.2 Gli inibitori della xantina ossidasi
Allopurinolo è chimicamente un analogo purinico, originariamente sintetizzato nell’ambito di un programma di sviluppo di farmaci antibatterici e chemioterapici (92). Questo farmaco è un inibitore non selettivo relativamente debole della XO che a basse dosi agisce come substrato per questo enzima (“inibitore suicida”), mentre ad alte dosi si comporta come un inibitore non competitivo (93,94). Allopurinolo viene metabolizzato ad ossipurinolo, metabolita attivo che viene eliminato dal rene. È un farmaco mediamente sicuro e ben tollerato, che riduce l’uricemia in maniera dose-dipendente. Il suo utilizzo per il trattamento dell’iperuricemia cronica con deposito di urato è stato approvato dalla Food and Drug Administration (FDA) nel 1996 e rappresenta il farmaco attualmente di maggior utilizzo per ridurre l’uricemia, raccomandato come prima linea di intervento dalle linee guida alla dose iniziale di 50-100 mg (80). Il largo impiego è dettato da un lato dalla sua efficacia terapeutica, quando utilizzato a dosaggi adeguati (fino a 800 mg/die), e dall’altro in ragione della indisponibilità fino a un passato relativamente recente di altri inibitori della XO efficaci e ben tollerati (93,95).
L’uso di febuxostat come trattamento ipouricemizzante è invece relativamente più recente, approvato da FDA e da European Medicines Agency (EMA) da circa 10 anni. Invero, nonostante febuxostat sia andato a colmare un importante gap terapeutico nella gestione di una patologia, la sua introduzione in commercio è stata inizialmente rallentata dall’evidenza di un aumento nominale dei decessi per cause cardiovascolari rispetto ad allopurinolo osservato in alcuni studi pilota (96-99). Dopo varie revisioni delle evidenze scientifiche EMA ha approvato l’uso di febuxostat alla dose di 80 e 120 mg/die mentre FDA ne ha approvato l’introduzione in commercio alle dosi di 40 e 80 mg sulla scorta dei risultati di un ulteriore trattamento randomizzato controllato su 2.269 pazienti con iperuricemia cronica con deposito di urato – lo studio CONFIRMS – che aveva evidenziato una simile frequenza di eventi cardiovascolari nei pazienti trattati con febuxostat o allopurinolo, in assenza di decessi per cause cardiovascolari nei pazienti trattati con febuxostat (100).
A differenza di allopurinolo e del suo metabolita attivo ossipurinolo, febuxostat non è un composto purino-simile ma è un derivato dell’acido tiazolidin-carbossilico che ha la peculiare capacità di inibire selettivamente sia la forma ridotta che la forma ossidata della XO (101-103) con una potenza da 10 a 30 volte superiore rispetto a quella di allopurinolo (96) e la cui efficacia è dose dipendente. Paragonato ad allopurinolo, febuxostat si è rivelato più efficace alle dosi comunemente utilizzate nel ridurre i livelli di acido urico nei pazienti affetti da iperuricemia con deposito di urato, con il 56,9% dei pazienti naïve al trattamento che ha raggiunto livelli di acido urico < 6,0 mg/dL (vs. 44,8% con allopurinolo; P < 0,001) e il 35,5% che ha raggiunto livelli di acido urico < 5,0 mg/dL (vs. 19,2% con allopurinolo; P < 0,001) (104). Inoltre, febuxostat presenta una doppia via di eliminazione, epatica e renale, ragione per cui non ne è richiesto alcun aggiustamento posologico nei pazienti con insufficienza renale di grado I-III (97), condizione non infrequente nei pazienti con iperuricemia cronica con deposito di urato (9). Inoltre, a differenza di allopurinolo, febuxostat non richiede l’aggiustamento posologico di warfarin quando somministrati contemporaneamente, in quanto non interferisce con la sua farmacocinetica (si veda paragrafo 9.1). Queste caratteristiche di febuxostat ne rendono particolarmente vantaggioso l’uso nei pazienti che non raggiungono il target terapeutico in corso di trattamento con allopurinolo o che non tollerano questo farmaco, invero non scevro di effetti indesiderati.
L’evidenza di un profondo coinvolgimento fisiopatologico della XO nella genesi del danno vascolare derivante da studi di fisiopatologia sperimentale e clinica ha trovato conferma nella dimostrazione di effetti favorevoli sulla fisiopatologia cardiovascolare derivante dall’inibizione della XO: miglioramento della funzione endoteliale e della funzione contrattile miocardica, riduzione dello stress ossidativo (105). In ambito trialistico, lo studio OPT-CHF (Oxypurinol Therapy for Congestive Heart Failure), che ha arruolato 405 pazienti con scompenso cardiaco moderato-severo a ridotta frazione di eiezione (classe NYHA III/IV), ha evidenziato un miglioramento clinico in corso di trattamento con ossipurinolo, metabolita attivo di allopurinolo, nei pazienti con aumentati livelli circolanti di acido urico (106). In controtendenza con queste evidenze, lo studio EXACT-HF (Xanthine Oxidase Inhibition for Hyperuricemic Heart Failure Patients), che ha arruolato 253 pazienti iperuricemici (uricemia > 9,5 mg/dL), con scompenso cardiaco sintomatico a ridotta frazione di eiezione, randomizzati al trattamento con allopurinolo 600 mg/die o placebo per 24 settimane, non ha dimostrato differenze significative nei due bracci di trattamento relativamente all’outcome primario (sopravvivenza, peggioramento dello scompenso cardiaco e stato funzionale globale) (107). Invero, nel considerare il possibile utilizzo di un inibitore della XO nel paziente con scompenso cardiaco va debitamente tenuto conto di alcune evidenze che suggeriscono come il livello di attività della XO possa variare in funzione dello stadio clinico della patologia (108). Nei pazienti in classe NYHA II una iperattività della XO si osserva in circa il 20% dei casi mentre nel 10% dei casi si osserva un basso livello di attività di questo enzima. Nei pazienti con scompenso cardiaco in classe III/IV queste percentuali salgono a circa il 35% e a circa il 18%, rispettivamente (Figura 10) (108).
È interessante notare come sia l’aumentata attività che la ridotta attività della XO siano associate ad un aumentato rischio di eventi cardiovascolari e ad una aumentata mortalità (108) (Figura 11). Sulla base di queste evidenze è lecito ipotizzare che i soggetti che maggiormente possano trarre il maggiore beneficio dell’inibizione della XO siano quelli nei quali i livelli di attività sono aumentati (o quantomeno normali) ma non quelli con bassi livelli di attività della XO. In questa ottica si potrebbe arrivare ad ipotizzare, ovviamente in un contesto squisitamente speculativo, che l’inefficacia dell’inibizione della XO nel ridurre l’outcome primario nello studio EXACT-HF possa, nella realtà dei fatti, nascondere la reciproca elisione del possibile vantaggio nei pazienti scompensati con alti livelli di attività della XO e del possibile svantaggio nei pazienti con bassi livelli di attività della XO (107). Il naturale derivato di questa ipotesi è rappresentato dalla necessità di individuare un indice semplice ed affidabile di attività della XO che potrebbe guidare la scelta del clinico nell’identificazione dei pazienti con iperuricemia cronica con deposito di urato nei quali è ipotizzabile che la riduzione dell’uricemia con inibitori della XO possa tradursi anche in un beneficio a livello cardiovascolare. Nelle donne in età fertile, ad esempio, l’effetto uricosurico degli estrogeni (109) può mascherare un’aumentata attività della XO che, pur inefficace nel condizionare un aumento dei livelli circolanti di acido urico avrebbe, comunque, tutte le potenzialità per favorire lo sviluppo della patologia aterosclerotica. A conferma di questa ipotesi, la predittività dei livelli circolanti di acido urico nei confronti degli eventi cardiovascolari è soprattutto evidente nelle donne in età fertile (21,110) nelle quali livelli di acido urico anche solo ai limiti alti della norma esprimono verosimilmente una aumenta attività della XO. Lo studio FEATHER (Febuxostat Versus Placebo Randomized Controlled Trial Regarding Reduced Renal Function in Patients With Hyperuricemia Complicated by Chronic Kidney Disease Stage 3) il trattamento con febuxostat è risultato associato ad un numero di problematiche cardiovascolari e cerebrali, riportate nello studio nell’ambito degli eventi avversi, simili a quelle osservate nel gruppo placebo (111). Del tutto recentemente sono stati pubblicati i risultati dello studio ALL-HEART (Allopurinol versus usual care in UK patients with ischaemic heart disease) disegnato con lo scopo di verificare se la terapia con allopurinolo migliorasse i principali outcome cardiovascolari nei pazienti con cardiopatia ischemica cronica (112). Lo studio ha incluso una popolazione intention-to-treat composta da 5.721 pazienti di età pari o superiore a 60 anni con ischemia cardiaca ma senza storia di iperuricemia cronica con deposito di urato (età media 72 anni, 76% di sesso maschile). I pazienti sono stati randomizzati 1:1 a ricevere allopurinolo titolato fino a una dose di 600 mg al giorno in aggiunta alle terapie cardiovascolari abituali (n= 2.853) o le sole terapie abituali (n= 2.868). L’outcome primario era un composito di infarto miocardico non fatale, ictus non fatale o morte cardiovascolare. Outcome secondari erano il tempo all’insorgenza di svariati eventi cardiovascolari, che includevano infarto miocardico non fatale, ictus non fatale, morte cardiovascolare, mortalità per tutte le cause, ricovero per sindrome coronarica acuta, rivascolarizzazione coronarica o rivascolarizzazione coronarica, ricovero per insufficienza cardiaca e tutti i ricoveri cardiovascolari (112). A un follow-up medio di 4,8 anni non è emersa alcuna differenza tra i gruppi nel tasso dell’endpoint primario, che si è verificato in 314 (11,0%) partecipanti nel braccio allopurinolo (2,47 eventi per 100 anni-paziente) e 325 (11,3%) nel braccio con terapia abituale (2,37 eventi per 100 anni-paziente), con un hazard ratio di 1,04 (intervallo di confidenza al 95% compreso tra 0,89 e 1,21; p=0,65). Non sono emerse differenze in nessuno degli outcome secondari (112). La conclusione degli autori dello studio appare perentoria “sulla base dei risultati della studio ALL-HEART, il trattamento con allopurinolo non dovrebbe essere raccomandato per la prevenzione secondaria degli eventi cardiovascolari nei pazienti con malattia coronarica” è forse un po’ troppo precipitosa (112). Il livello medio dell’uricemia nella popolazione arruolata nello studio ALL-HEART e randomizzata al trattamento con allopurinolo, infatti, era 0,35±0,08 mmol/L (5,9±1,34 mg/dL), valori suggestivi del fatto che una larga quota dei pazienti trattati non presentava iperattività della XO (112).
- Efficacia e sicurezza dei farmaci inibitori della xantina ossidasi
Nel contesto delle terapie ipouricemizzanti, la faculty entra nel merito delle caratteristiche specifiche degli inibitori della XO, molecole che, come esposto in precedenza, impediscono la conversione delle purine endogene in acido urico.
9.1 Tollerabilità degli inibitori della xantino ossidasi
Allopurinolo è un profarmaco convertito in ossipurinolo, metabolita attivo ad azione non selettiva sulla XO e che riduce i livelli di urato con una modalità dose-dipendente (113,114). A causa della sua azione aspecifica, allopurinolo può causare diversi tipi di effetti avversi con rischio proporzionale al crescere della dose; tra questi va considerata la reazione da ipersensibilità che, sebbene sia una manifestazione rara, comporta un serio rischio di ospedalizzazione e mortalità. Le gravi reazioni cutanee avverse correlate ad allopurinolo sono associate, inoltre, all’insorgenza di cardiopatie, con rischio direttamente proporzionale al dosaggio iniziale (115-117). A questo proposito, si dibatte se questo dato sia stato adeguatamente preso in considerazione dalle linee guida EULAR. La maggior parte dei pazienti riceve 300 mg di allopurinolo al giorno, ma questa dose è spesso inadeguata per raggiungere i livelli target di urato (102,118). Dosi giornaliere fino a 800 mg possono essere utilizzate in pazienti con funzione renale normale, mentre nei pazienti con insufficienza renale la posologia di allopurinolo deve essere ridotta a causa dell’aumentato rischio di ipersensibilità in tali pazienti (119). Per l’impiego di allopurinolo vanno valutate possibili interazioni con farmaci concomitanti come il warfarin, ove è opportuno monitorare attentamente il paziente, e i diuretici tiazidici, che possono richiedere una riduzione del dosaggio di allopurinolo quando è presente una diminuzione della funzionalità renale (anche in assenza di insufficienza renale è opportuno monitorare la funzionalità renale dei pazienti in terapia con allopurinolo).
Febuxostat svolge, invece, un’inibizione selettiva della XO e presenta scarse interferenze farmacologiche (113,120). Ad esempio, nel caso specifico del warfarin, questo non richiede aggiustamenti di dosaggio quando co-somministrato a febuxostat e anche nei casi di assunzione concomitante di idroclorotiazide e febuxostat, quest’ultimo non richiede aggiustamenti del dosaggio. Febuxostat si è rivelato superiore ad allopurinolo in termini di regolarità graduale e costante della riduzione di acido urico: alla dose giornaliera di 80 mg o 120 mg, febuxostat riduce più efficacemente i livelli di acido urico sierico rispetto ad allopurinolo alla dose giornaliera fissa comunemente utilizzata di 300 mg (102). L’efficacia di febuxostat rispetto ad allopurinolo è stata valutata da numerosi studi – tra cui gli studi FACT, APEX e FOCUS – che hanno mostrato ottime curve di riduzione dell’iperuricemia nei pazienti con iperuricemia cronica con deposito di urato e la riduzione del rischio di nuovi attacchi acuti in corso di trattamento con febuxostat (99,102,103). Febuxostat riduce e mantiene più efficacemente i livelli di urato sierico < 6,0 mg/dL rispetto ad allopurinolo (300 o 100 mg) in soggetti con iperuricemia e deposito di urato, compresi quelli con funzionalità renale da lieve a moderatamente compromessa (Figura 12) (103). Lo studio FOCUS (Febuxostat Open-label Clinical trial of Urate-lowering efficacy and Safety), in particolare, ha riportato un’efficace riduzione dell’iperuricemia da parte di febuxostat al follow-up di 5 anni, e il verificarsi di poche reazioni collaterali (99). Nei pazienti con CKD, la monoterapia con febuxostat ha mostrato un miglior controllo dei valori di uricemia. In pazienti > 65 anni con iperuricemia asintomatica febuxostat (40-80 mg) è risultato superiore rispetto a un approccio terapeutico basato su modifiche dello stile di vita (dieta e attività fisica) e, nei due terzi dei casi, sull’uso di basse dosi di allopurinolo (121). Negli studi FACT (Febuxostat versus Allopurinol Control Trial in subjects with gout) e APEX (Phase III, Febuxostat, Allopurinol and Placebo-Controlled Study in Gout Subjects), il trattamento con febuxostat fino a 52 settimane ha dimostrato di portare a target la maggioranza della popolazione trattata, e la sua tollerabilità si è rivelata molto elevata anche nei pazienti > 65 anni con iperuricemia con deposito di urato (102,103,121). Nel paziente anziano, per definizione pluripatologico, febuxostat risulta efficace e tollerato, come anche nel paziente con CKD, modulando la dose in base alla clearance della creatinina.
9.2 Studi CARES e FAST
Lo studio CARES (Cardiovascular Safety of Febuxostat and Allopurinol in Patients with Gout and Cardiovascular Morbidities) è stato specificatamente disegnato per rispondere al quesito di sicurezza cardiovascolare di febuxostat formulato da FDA (122). Tuttavia, lo studio CARES non aveva portato a posizioni certe al riguardo, poiché presentava alcune non trascurabili e importanti limiti metodologici (123). Nello specifico, erano stati confrontati gli esiti cardiovascolari di molti pazienti che avevano sospeso il farmaco assegnato, lo studio aveva una durata ridotta, non forniva informazioni sul tipo di trattamento ipouricemizzante prescritto dopo il ritiro dal trattamento randomizzato e, con disegno di non inferiorità, non prevedeva un braccio placebo. La frequenza di eventi cardiovascolari è risultata simile nei due bracci di trattamento (Figura 13) ma nei pazienti trattati con febuxostat l’analisi intention-to-treat ha evidenziato un rischio di mortalità cardiovascolare e totale significativamente più alto rispetto ai pazienti trattati con allopurinolo. Per i limiti metodologici sopramenzionati, i risultati dello studio CARES devono essere interpretati con cautela e, conseguentemente, la succitata differente frequenza di mortalità nei due bracci di trattamento poteva esprimere, al massimo, una minore efficacia di febuxostat nei confronti di allopurinolo (123). I risultati dello studio FAST (Febuxostat versus Allopurinol Streamlined Trial), recentemente pubblicato, consentono di definire meglio il profilo di sicurezza di febuxostat (124). Lo studio è stato specificatamente richiesto dal European Union Risk Management Plan per verificare la sicurezza cardiovascolare di febuxostat rispetto al trattamento standard con allopurinolo. Lo studio, prospettico, randomizzato, in aperto con valutazione in cieco degli endpoint, ha confrontato febuxostat (80-120 mg/die) e allopurinolo con disegno di non-inferiorità. Sono stati arruolati 6.128 pazienti con iperuricemia cronica con deposito di urato (85,3% di sesso maschile) ed almeno un fattore di rischio cardiovascolare addizionali, precedentemente trattati con allopurinolo (124).
Febuxostat è risultato non inferiore ad allopurinolo per l’endpoint primario (un composito di ospedalizzazione per infarto miocardico non fatale o riscontro di un aumento dei biomarker indicativi di sindrome coronarica acuta, ictus non fatale o morte cardiovascolare) nell’analisi on-treatment (hazard ratio aggiustato pari a 0,85, intervallo di confidenza al 95% compreso tra 0,70 e 1,03, limite di non inferiorità pari a 1,3), risultato confermato nell’analisi intention-to-treat (Figura 14). La non inferiorità di febuxostat rispetto ad allopurinolo è risultata evidente anche per vari outcome secondari compresa la morte per cause cardiovascolari (hazard ratio aggiustato pari a 0,91, intervallo di confidenza al 95% compreso tra 0,66 e 1,27) e per tutte le cause (hazard ratio aggiustato pari a 0,75, intervallo di confidenza al 95% compreso tra 0,59 e 0,95) (Figura 15).
I risultati dello studio FAST appaiono robusti e rassicuranti in merito alla sicurezza cardiovascolare di febuxostat nella larga maggioranza dei pazienti con iperuricemia cronica con deposito di urato, anche se non consentono di trarre conclusioni definitive relativamente ai pazienti con malattia cardiovascolare più severa (124). Questi nuovi dati hanno dunque portato alla revisione delle indicazioni sulla sicurezza cardiovascolare di febuxostat riportate nel riassunto delle caratteristiche del prodotto (RCP), a tutto vantaggio di una gestione ottimale dell’iperuricemia cronica con deposito di urato.
In sintesi, lo studio FAST ha dimostrato che febuxostat non è inferiore ad allopurinolo per quanto riguarda l’incidenza dell’endpoint cardiovascolare primario e il suo uso a lungo termine non è associato a un aumento del rischio di mortalità o di eventi avversi gravi, confutando così gli esiti dello studio CARES.
Inoltre, appare meritevole di menzione una recente metaanalisi di studi che hanno confrontato la sicurezza cardiovascolare di febuxostat e allopurinolo che ha dimostrato un migliore profilo di sicurezza cardiovascolare di febuxostat rispetto ad allopurinolo (125).
- Inibizione della xantina ossidasi e protezione cardiovascolare
In conclusione, si discute del dualismo della condizione iperuricemica: da una parte le problematiche osteoarticolari, dall’altra le complicanze cardiovascolari, renali e metaboliche. La condizione di iperuricemia cronica, specie se non controllata, determina un elevato rischio di mortalità sia cardiovascolare che per tutte le cause. Elevati livelli di acido urico non debbono più essere associati soltanto all’iperuricemia cronica con deposito di urato, ma riflettono una problematica più estesa con ripercussioni cardio-nefro-metaboliche. I depositi subclinici di urato possono aumentare il rischio cardiovascolare, ad esempio, destabilizzando le placche aterosclerotiche e aumentando il rischio di cardiomiopatia ischemica (126). È ormai evidente come l’iperuricemia cronica aumenti progressivamente il rischio di ipertensione sintomatica e determini un peggioramento prognostico di varie patologie cardiovascolari (1-3). Lo studio Rotterdam riporta preoccupanti proiezioni circa i danni coronarici e cerebrovascolari in presenza di iperuricemia (26), mentre lo studio URRAH descrive un aumento della mortalità cardiovascolare e per tutte le cause in vari setting (tra cui scompenso e CKD), già a livelli di acido urico di 4,5-5 mg/dL in pazienti senza iperuricemia (21,29). Poiché il rischio nasce a livelli di acido urico < 6 mg/dL, si invita a ragionare diversamente: la precipitazione di acido urico non è la causa primaria e il processo inizia prima. Di conseguenza, l’iperuricemia asintomatica va sistematicamente ricercata. Di fatti, le linee guida della Società Internazionale dell’Ipertensione 2020 raccomandano di monitorare i livelli circolanti di acido urico (127). Bisogna inoltre tener conto sia della produzione che dell’escrezione dell’acido urico, oltre che la predisposizione genetica (es. se un soggetto è iperproduttore di acido urico, mangiare fruttosio di sintesi aumenterà il suo rischio di iperuricemia), quando si decide quale terapia implementare. Poiché la lesività da dismetabolismo dell’acido urico è da ricondurre ai depositi di urato monosodico, ai livelli di acido urico per sé e all’iperattività della XO, bisogna modulare la XO (17).
A livello di sicurezza cardiovascolare, allopurinolo e febuxostat si equivalgono, ma febuxostat risulta più stabile a dosi elevate e, quindi, più efficace nell’attenuare le oscillazioni dei livelli di acido urico (a cui è stato attribuito un significato prognostico sfavorevole). Il rischio di problematiche cardiovascolari, renali e metaboliche connesse al dismetabolismo dell’acido urico sembra dipendente principalmente dal livello di attività della XO che può favorire la formazione di placche, l’infiammazione endoteliale e l’attivazione del sistema renina-angiotensina. L’inibizione della XO rappresenta, quindi, il trattamento ipouricemizzante di riferimento sia nei soggetti iperproduttori che nei soggetti ipoescretori. A conferma di ciò, il trattamento con inibitori della XO è associato ad una riduzione dell’ipertrofia ventricolare sinistra e ad un miglioramento del controllo della pressione arteriosa, della funzione renale e dell’assetto metabolico. Nel confronto allopurinolo vs febuxostat, lo studio FAST ha dimostrato un’equivalenza tra i due farmaci in termini di sicurezza cardiovascolare e una tendenza verso un miglior outcome cardiovascolare con febuxostat (122-124). Lo studio FEATHER descrive, inoltre, un effetto nefroprotettivo da parte di febuxostat nei pazienti con CKD (108). Infine, i trial clinici DAPA-HF, PARADIGM-HF, SOCRATES-Reduced, LIFE/REENAL, EMPA-REG e EMPEROR-REDUCED mostrano una significativa riduzione dell’acido urico e un significativo miglioramento dell’outcome clinico con farmaci cardiovascolari dotati anche di un effetto uricosurico (86-91). Nell’ottimizzare la strategia di gestione dell’iperuricemia cronica con deposito di urato, occorre dunque anche prestare grande attenzione ai farmaci prescritti a causa delle comorbidità e che possono influenzare in modo sostanziale i livelli di acido urico (vedi Tabella 1).
- Conclusioni
Il progetto “Iperuricemia, depositi di urato e malattia cardio-nefro-metabolica: la quadratura del cerchio” è nato dall’esigenza di un dibattito scientifico tra le figure professionali maggiormente coinvolte nella gestione del dismetabolismo dell’acido urico. Specialisti di area cardio-nefro-metabolica e reumatologica con comprovata esperienza nella gestione del dismetabolismo dell’acido urico hanno contribuito, attraverso l’interazione con il board scientifico, a identificare le aree grigie di conoscenza ed evidenziare e risolvere problematiche di orientamento gestionale nel contesto dell’iperuricemia cronica con deposito di urato.
Il ruolo dell’acido urico, dei suoi livelli plasmatici e dei suoi depositi articolari e tissutali come fattore di rischio cardiovascolare è oggi oggetto di attivo dibattito scientifico con un numero crescente di studi che ne suggeriscono un ruolo importante nelle patologie cardio-nefro-metaboliche. Questa “relazione pericolosa” tra acido urico e malattie extra-articolari, peraltro, sembra che cominci a delinearsi già per valori di uricemia al di sotto della soglia di 6 mg/dL che le raccomandazioni internazionali dei reumatologi suggeriscono come target terapeutico per i pazienti con iperuricemia cronica con deposito di urato. Inoltre, esiste la possibilità che ciò che si vede, i livelli di acido urico, siano solo la parte emersa di un più ampio meccanismo di danno vascolare che potrebbe risiedere nella produzione esagerata o nella mancata clearance di alcuni prodotti intermedi della sintesi dello stesso, con attività pro-ossidante la cui capacità di nuocere sarebbe proporzionale allo stato ossidativo di base del soggetto o alla efficienza del sistema anti-ossidante. È possibile, quindi, che analoghi livelli di acido urico circolante possano svolgere una diversa azione nociva in ragione della labilità del substrato vascolare nei confronti degli stessi o del meccanismo biochimico che ha contributo a generarli. In luce di tutto ciò e dalle discussioni emerse nel corso degli eventi di Napoli e Bologna, sono stati stilati 6 statement conclusivi, riportati nella Figura 16.
Spicca, in primis, l’esigenza di effettuare una valutazione sistematica dei livelli di acido urico nei propri pazienti, anche in assenza di evidente sintomatologia articolare o manifestazioni gottose acute, altresì in considerazione della comprovata correlazione tra iperuricemia e danno cardio-nefro-metabolico (statement 1). A partire da ciò, scaturisce la necessità di sviluppare, nel paziente iperuricemico, una strategia terapeutica a tutto tondo, che tenga in considerazione comorbidità, terapie concomitanti e fenotipo eziologico, sviluppando i dettami della medicina di complessità che promulga un approccio patient-oriented, in opposizione a quello disease-oriented (statement 2). Inoltre, bisogna considerare la crescente letteratura che dimostra l’influenza positiva o negativa sui valori di uricemia di medicinali prescritti per condizioni patologiche pregresse e concomitanti, rivelandosi perciò o potenziali strumenti fruibili a beneficio del paziente o ostacoli al raggiungimento del target terapeutico. Tale approccio gestionale di complessità, non potrà poi esimersi dall’informare il paziente sull’importanza di una trasformazione dello stile di vita − in termini di dieta, calo ponderale e attività fisica − e dell’aderenza sia a queste modifiche che alla terapia farmacologica (statement 3). L’assunzione di purine attraverso carni rosse, fruttosio di sintesi, birra e altri alimenti, promuove la biogenesi di acido urico, diventando altamente nociva se non tenuta sotto controllo, soprattutto nei pazienti “iperproduttori”. Il fine ultimo, dunque, sarà quello di condurre i pazienti al di sotto delle soglie di rischio definite dalle linee guida e dagli studi sul tema (< 6,0 mg/dL nei pazienti con malattia da deposito di urato o < 5,0 mg/dL nella forma più severa di malattia). A questo scopo, gli esperti concordano su un intervento precoce con terapia ipouricemizzante tramite l’impiego di inibitori della XO (statement 4). La XO si viene sempre più configurando come una protagonista nella patogenesi del danno vascolare soprattutto in quelle condizioni in cui la sua attività viene esageratamente aumentata per effetto di uno stimolo ipossico/ischemico o infiammatorio cronico, quale quello rappresentato dalla flogosi vascolare aterogenica. Le evidenze della letteratura trialistica sembrano suggerire la possibilità che il blocco della XO, sia nei pazienti “iperproduttori” che “ipoescretori”, possa configurarsi come un prezioso strumento di protezione cardiovascolare in molti ma non in tutti i pazienti ad aumentato rischio cardiovascolare (statement 5). Il naturale derivato di questa ipotesi interpretativa è rappresentato dalla necessità di poter disporre di misure affidabili e riproducibili del grado di attività della XO per individuare al meglio quegli individui, probabilmente molti, che possono maggiormente beneficiare di un blocco potente e selettivo della XO. Nelle more che vengano definiti strumenti biochimici adeguatamente semplici e riproducibili per identificare soggetti idealmente candidabili a strategie di prevenzione cardiovascolare basate sul possibile uso di inibitori della XO. Non appare inutile ricordare come attualmente l’indicazione all’uso degli inibitori della XO sia rappresentata dal trattamento dell’iperuricemia cronica con deposito di urato con anamnesi o presenza di tofi e/o di artrite gottosa, nel caso di febuxostat, e per tutte le forme di iperuricemia (> 9 mg/dL) non controllabili con la dieta e nelle complicazioni cliniche degli stati di iperuricemia, nel caso di allopurinolo. Nell’impostazione dello schema terapeutico ipouricemizzante si dovrà poi, infine, contemplare le specifiche delle opzioni terapeutiche in termini di interazione farmacologica, in caso di comorbidità, stabilità ed efficacia del trattamento ai dosaggi comunemente impiegati, anche in considerazione delle oscillazioni deleterie dei livelli di acido urico e dei possibili benefici in termini di protezione cardiovascolare (statement 6).
Considerato quanto esposto in questa rassegna appare quantomai verosimile che da questo trattamento possa derivare, parallelamente al beneficio nei riguardi della malattia da deposito di urato, una non trascurabile protezione cardiovascolare e renale. Una maggiore attenzione al mondo sommerso della malattia da deposito di urato appare, quindi, quantomai opportuna per contrastare lesività articolare ed extra-articolare di questa condizione clinica.
Bibliografia
- Nurmohamed MT. Cardiovascular risk in inflammatory arthritis: rheumatoid arthritis and gout. Lancet Rheumatol 2020; published online Sept 1. https://doi.org/10.1016/S2665-9913(20)30221-6.
- Zhu Y, et al. Comorbidities of gout and hyperuricemia in the US general population: NHANES 2007-2008. Am J Med 2012; 125: 679-687.e1.
- Richette P, et al. Revisiting comorbidities in gout: a cluster analysis. Ann Rheum Dis 2015;74: 142–47.
- Williams, B., Mancia, G., Spiering, W., Agabiti Rosei, E., Azizi, M., Burnier, M., Clement, D. L., Coca, A., de Simone, G., Dominiczak, A., Kahan, T., Mahfoud, F., Redon, J., Ruilope, L., Zanchetti, A., Kerins, M., Kjeldsen, S. E., Kreutz, R., Laurent, S., … Brady, A. (2018). 2018 ESC/ESH Guidelines for the management of arterial hypertension. The Task Force for the management of arterial hypertension of the European Society of Cardiology (ESC) and the European Society of Hypertension (ESH). European Heart Journal, 39(33), 3021–3104. https://doi.org/10.1093/EURHEARTJ/EHY339.
- Richette P, et al. 2016 updated EULAR evidence-based recommendations for the management of gout. Ann Rheum Dis. 2017 Jan;76(1):29-42.
- Trifirò, G., Morabito, P., Cavagna, L., Ferrajolo, C., Pecchioli, S., Simonetti, M., Bianchini, E., Medea, G., Cricelli, C., Caputi, A. P., & Mazzaglia, G. (2013). Epidemiology of gout and hyperuricaemia in Italy during the years 2005–2009: a nationwide population-based study. Annals of the Rheumatic Diseases, 72(5), 694–700. https://doi.org/10.1136/ANNRHEUMDIS-2011-201254
- Selvaraj, S., Claggett, B. L., Pfeffer, M. A., Desai, A. S., Mc Causland, F. R., McGrath, M. M., Anand, I. S., van Veldhuisen, D. J., Kober, L., Janssens, S., Cleland, J. G. F., Pieske, B., Rouleau, J. L., Zile, M. R., Shi, V. C., Lefkowitz, M. P., McMurray, J. J. V., & Solomon, S. D. (2020). Serum uric acid, influence of sacubitril–valsartan, and cardiovascular outcomes in heart failure with preserved ejection fraction: PARAGON-HF. European Journal of Heart Failure, 22(11), 2093–2101. https://doi.org/10.1002/EJHF.1984
- Wallace KL, et al. Increasing prevalence of gout and hyperuricemia over 10 years among older adults in a managed care population. J Rheumatol 2004; 31: 1582–1587.
- Desideri G, et al. Is it time to revise the normal range of serum uric acid levels? Eur Rev Med Pharmacol Sci. 2014;18(9):1295-306.
- Fishberg AM. The interpretation of blood uric acid in hypertension. Arch Intern Med. 1924;34(4):503-507.
- Glynn RJ, et al. Trends in serum uric acid levels 1961-1980. Arthritis Rheum. 1983;26(1):87-93.
- Choi HK, , et al. Obesity, weight change, hypertension, diuretic use, and risk of gout in men: the Health Professionals Follow-up Study. Arch Intern Med. 2005;165:742–748. doi: 10.1001/archinte.165.7.742
- Choi HK, et al. Purine-rich foods, dairy and protein intake, and the risk of gout in men. N Engl J Med. 2004;350:1093–1103. doi: 10.1001/archinte.165.7.742
- Choi HK, et al. Alcohol intake and risk of incident gout in men: a prospective study. Lancet 2004; 363(9417):1277–1281. doi: 10.1016/S0140-6736(04)16000-5.
- Choi HK, Curhan G. Soft drinks, fructose consumption, and the risk of gout in men: prospective cohort study. BMJ 2008; 336: 309–312.
- Choi JW, et al. Sugar-sweetened soft drinks, diet soft drinks, and serum uric acid level: the Third National Health and Nutrition Examination Survey. Arthritis Rheum 2008; 59: 109–116. doi: 10.1002/art.23245.
- Borghi C, et al. Urate-Lowering Drugs and Prevention of Cardiovascular Disease: The Emerging Role of Xanthine Oxidase Inhibition. Hypertension. 2016 Mar;67(3):496-8. doi: 10.1161/HYPERTENSIONAHA.115.06531. Epub 2016 Jan 25. PMID: 26865197.
- Bardin T, et al. Definition of hyperuricemia and gouty conditions. Curr. Opin. Rheumatol. 2014, 26, 186–191.
- Dorwart, B. B. Thomas sydenham (1624-1689), on gout: 1717. Journal of Clinical Rheumatology, 2004; 10(4), 227. https://doi.org/10.1097/01.RHU.0000135772.83956.74
- Shah A et al. Gout, hyperuricemia, and the risk of cardiovascular disease: cause and effect? Curr Rheumatol Rep. 2010 Apr;12(2):118-24. doi: 10.1007/s11926-010-0084-3.
- Casiglia E, et al. Working Group on Uric Acid and Cardiovascular Risk of the Italian Society of Hypertension (SIIA). Serum uric acid and fatal myocardial infarction: detection of prognostic cut-off values: The URRAH (Uric Acid Right for Heart Health) study. J Hypertens. 2020 Mar;38(3):412-419.
- Zhao G., Huang L., Song M., Song Y. Baseline serum uric acid level as a predictor of cardiovascular disease related mortality and all-cause mortality: A meta-analysis of prospective studies. Atherosclerosis, 2013; 231:1, pp 61-68. DOI:https://doi.org/10.1016/j.atherosclerosis.2013.08.023
- Yu W, Cheng JD. Uric Acid and Cardiovascular Disease: An Update From Molecular Mechanism to Clinical Perspective. Front Pharmacol. 2020 Nov 16;11:582680. doi: 10.3389/fphar.2020.582680.
- Ndrepepa G. Uric acid and cardiovascular disease. Clin Chim Acta. 2018 Sep;484:150-163. doi: 10.1016/j.cca.2018.05.046.
- Wang J et al. J. Hyperuricemia and risk of incident hypertension: a systematic review and meta-analysis of observational studies. PLoS One. 2014 Dec 1;9(12):e114259. doi: 10.1371/journal.pone.0114259.
- Bos MJ, et al. Uric acid is a risk factor for myocardial infarction and stroke: the Rotterdam study. Stroke. 2006 Jun;37(6):1503-7. doi: 10.1161/01.STR.0000221716.55088.d4.
- Holme I et al. Uric acid and risk of myocardial infarction, stroke and congestive heart failure in 417,734 men and women in the Apolipoprotein MOrtality RISk study (AMORIS). J Intern Med. 2009 Dec;266(6):558-70. doi: 10.1111/j.1365-2796.2009.02133.x.
- Kim HK, et al. Uric Acid Variability as a Predictive Marker of Newly Developed Cardiovascular Events in Type 2 Diabetes. Front Cardiovasc Med. 2021 Dec 2;8:775753. doi: 10.3389/fcvm.2021.775753.
- Working Group on Uric Acid and Cardiovascular Risk of the Italian Society of Hypertension (SIIA). The association of uric acid with mortality modifies at old age: data from the uric acid right for heart health (URRAH) study. J Hypertens. 2022 Apr 1;40(4):704-711. doi: 10.1097/HJH.0000000000003068.
- Sciacqua, A., Perticone, M., Tassone, E. J., Cimellaro, A., Miceli, S., Maio, R., Sesti, G., & Perticone, F. (2015). Uric acid is an independent predictor of cardiovascular events in post-menopausal women. International Journal of Cardiology, 197, 271–275. https://doi.org/10.1016/j.ijcard.2015.06.069.
- Montalcini T, et al. Relation between serum uric acid and carotid intima-media thickness in healthy postmenopausal women. Intern Emerg Med. 2007 Mar;2(1):19-23. doi: 10.1007/s11739-007-0004-3.
- Kannel WB. Metabolic risk factors for coronary heart disease in women: perspective from the Framingham Study. Am Heart J. 1987 Aug;114(2):413-9. doi: 10.1016/0002-8703(87)90511-4.
- Kim SY, Guevara JP, Kim KM, Choi HK, Heitjan DF, Albert DA. Hyperuricemia and coronary heart disease: a systematic review and meta-analysis. Arthritis Care Res (Hoboken). 2010 Feb;62(2):170-80. doi: 10.1002/acr.20065.
- Holme I, Aastveit AH, Hammar N, Jungner I, Walldius G. Uric acid and risk of myocardial infarction, stroke and congestive heart failure in 417,734 men and women in the Apolipoprotein MOrtality RISk study (AMORIS). J Intern Med. 2009 Dec;266(6):558-70. doi: 10.1111/j.1365-2796.2009.02133.x.
- Cameron JS. Uric Acid and renal disease. Nucleosides Nucleotides Nucleic Acids. 2006;25(9-11):1055-64.
- Obermayr RP, et al. Elevated uric acid increases the risk for kidney disease. J Am Soc Nephrol. 2008;19(12):2407- 13. 40. doi: 10.1681/ASN.2008010080.
- Degli Esposti L, et al. Hyperuricemia is associated with increased hospitalization risk and healthcare costs: Evidence from an administrative database in Italy. Nutr Metab Cardiovasc Dis. 2016;26(10):951-61. doi: 10.1016/j.numecd.2016.06.008.
- Li L. et al. Is hyperuricemia an independent risk factor for new-onset chronic kidney disease?: A systematic review and meta-analysis based on observational cohort studies. BMC Nephrol. 2014 Jul 27;15:122. doi: 10.1186/1471-2369-15-122.
- Zoppini G, et al. Serum uric acid levels and incident chronic kidney disease in patients with type 2 diabetes and preserved kidney function. Diabetes Care. 2012 Jan;35(1):99-104. doi: 10.2337/dc11-1346.
- Luo Q, et al. Serum uric acid and cardiovascular mortality in chronic kidney disease: a meta-analysis. BMC Nephrol. 2019 Jan 14;20(1):18. doi: 10.1186/s12882-018-1143-7.
- Kodama S, et al. Association between serum uric acid and development of type 2 diabetes. Diabetes Care. 2009 Sep;32(9):1737-42. doi: 10.2337/dc09-0288.
- Zhou C, et al. Positive association of serum uric acid with new-onset diabetes in Chinese women with hypertension in a retrospective analysis of the China Stroke Primary Prevention Trial. Diabetes Obes Metab. 2020 Sep;22(9):1598-1606. doi: 10.1111/dom.14072.
- Niskanen L, et al. Serum uric acid as a harbinger of metabolic outcome in subjects with impaired glucose tolerance: the Finnish Diabetes Prevention Study. Diabetes Care. 2006 Mar;29(3):709-11. doi: 10.2337/diacare.29.03.06.dc05-1465.
- Perticone F, et al. Serum uric acid and 1-h postload glucose in essential hypertension. Diabetes Care. 2012 Jan;35(1):153-7. doi: 10.2337/dc11-1727.
- Indraratna, P. L., Stocker, S. L., Williams, K. M., Graham, G. G., Jones, G., & Day, R. O. (2010). A proposal for identifying the low renal uric acid clearance phenotype. Arthritis Research and Therapy, 12(6), 1–3. https://doi.org/10.1186/AR3191/METRICS
- Polito L, et al. Xanthine oxidoreductase: A leading actor in cardiovascular disease drama. Redox Biol. 2021 Nov 24;48:102195.
- Viana-Huete V, Fuster JJ. Potential Therapeutic Value of Interleukin 1b-targeted Strategies in Atherosclerotic Cardiovascular Disease. Rev Esp Cardiol (Engl Ed). 2019 Sep;72(9):760-766. English, Spanish. doi: 10.1016/j.rec.2019.03.006.
- Fini MA, et al. Brief report: The uricase mutation in humans increases our risk for cancer growth. Cancer Metab. 2021 Sep 15;9(1):32. doi: 10.1186/s40170-021-00268-3.
- Álvarez-Lario B, Macarrón-Vicente J. Uric acid and evolution. Rheumatology (Oxford). 2010 Nov;49(11):2010-5. doi: 10.1093/rheumatology/keq204.
- Clarson LE, et al. Increased cardiovascular mortality associated with gout: a systematic review and metaanalysis. Eur J Prev Cardiol. 2015 Mar;22(3):335-43.
- Liu SC, et al. Gout and Risk of Myocardial Infarction: A Systematic Review and Meta-Analysis of Cohort Studies. PLoS One. 2015 Jul 31;10(7):e0134088. doi: 10.1371/journal.pone.0134088. PMID: 26230580; PMCID:PMC4521845.
- Andrés M, et al. Silent Monosodium Urate Crystal Deposits Are Associated With Severe Coronary Calcification in Asymptomatic Hyperuricemia: An Exploratory Study. Arthritis Rheumatol. 2016 Jun;68(6):1531-9.
- Feig DI, Kang DH, Johnson RJ. Uric acid and cardiovascular risk. N Engl J Med 2008;359(17):1811- 21.
- Virdis A, et al. From the Working Group on Uric Acid and Cardiovascular Risk of the Italian Society of Hypertension. Identification of the Uric Acid Thresholds Predicting an Increased Total and Cardiovascular Mortality Over 20 Years. Hypertension. 2020 Feb;75(2):302-308.
- So A, et al. Uric acid transport and disease. J Clin Invest. 2010;120(6):1791–1799.
- Butler R, et al. Allopurinol normalizes endothelial dysfunction in type 2 diabetics with mild hypertension. Hypertension. 2000; 35:746–751.
- Desco MC, et al. Xanthine oxidase is involved in free radical production in type 1 diabetes: protection by allopurinol. Diabetes. 2002; 51:1118–1124.
- Farquharson CA, et al. Allopurinol improves endothelial dysfunction in chronic heart failure. Circulation. 2002; 106:221–226.
- Aslan M, et al. Oxygen radical inhibition of nitric oxide-dependent vascular function in sickle cell disease. Proc Natl Acad Sci USA. 2001;98:15215–15220.
- Battelli MG, et al. Pathophysiology of circulating xanthine oxidoreductase: new emerging roles for a multi-tasking enzyme. Biochim Biophys Acta. 2014;1842(9):1502-1517
- Hare JM, Johnson RJ. Uric acid predicts clinical outcomes in heart failure: insights regarding the role of xanthine oxidase and uric acid in disease pathophysiology. Circulation. 2003 Apr 22;107(15):1951-3. doi: 10.1161/01.CIR.0000066420.36123.35.
- Huang H, . Uric acid and risk of heart failure: a systematic review and meta-analysis. Eur J Heart Fail. 2014 Jan;16(1):15-24. doi: 10.1093/eurjhf/hft132.
- Ogino K, . Uric acid-lowering treatment with benzbromarone in patients with heart failure: a double-blind placebo-controlled crossover preliminary study. Circ Heart Fail. 2010 Jan;3(1):73-81. doi: 10.1161/CIRCHEARTFAILURE.109.868604.
- Puddu P, et al. Relationships among hyperuricemia, endothelial dysfunction and cardiovascular disease: molecular mechanisms and clinical implications. J Cardiol. 2012 May;59(3):235-42. doi: 10.1016/j.jjcc.2012.01.013.
- Martillo, M. A., Nazzal, L., & Crittenden, D. B. (2014). The crystallization of monosodium urate. Current Rheumatology Reports, 16(2), 1–8. https://doi.org/10.1007/S11926-013-0400-9/FIGURES/2
- Borghi C, Tykarski A, Widecka K, Filipiak KJ, Domienik-Karłowicz J, Kostka-Jeziorny K, Varga A, Jaguszewski M, Narkiewicz K, Mancia G. Expert consensus for the diagnosis and treatment of patient with hyperuricemia and high cardiovascular risk. Cardiol J. 2018;25(5):545-563. doi: 10.5603/CJ.2018.0116.
- Borghi C, Domienik-Karłowicz J, Tykarski A, Widecka K, Filipiak KJ, Jaguszewski MJ, Narkiewicz K, Mancia G. Expert consensus for the diagnosis and treatment of patient with hyperuricemia and high cardiovascular risk: 2021 update. Cardiol J. 2021;28(1):1-14. doi: 10.5603/CJ.a2021.0001.
- Perez-Ruiz F, Calabozo M, Pijoan JI, Herrero-Beites AM, Ruibal A. Effect of urate-lowering therapy on the velocity of size reduction of tophi in chronic gout. Arthritis Rheum. 2002 Aug;47(4):356-60. doi: 10.1002/art.10511.
- Viazzi F, et al.Serum uric acid levels predict new-onset type 2 diabetes in hospitalized patients with primary hypertension: the MAGIC study. Diabetes Care. 2011;34(1):126-128. 24. doi: 10.2337/dc10-0918.
- Sui X, et al. Uric acid and the development of metabolic syndrome in women and men. Metabolism. 2008;57(6):845-52. doi: 10.1016/j.metabol.2008.01.030.
- Saag KG et al. Epidemiology, risk factors, and lifestyle modifications for gout. Arthritis Res Ther. 2006;8 Suppl 1(Suppl 1):S2. doi: 10.1186/ar1907.
- MacFarlane et al. Gout: a review of nonmodifiable and modifiable risk factors. Rheum Dis Clin North Am. 2014 Nov;40(4):581-604. doi: 10.1016/j.rdc.2014.07.002.
- Yokose, C., McCormick, N., & Choi, H. K. (2021). The role of diet in hyperuricemia and gout. Current Opinion in Rheumatology, 33(2), 135–144. https://doi.org/10.1097/BOR.0000000000000779
- Rai, S. K., Fung, T. T., Lu, N., Keller, S. F., Curhan, G. C., & Choi, H. K. (2017). The Dietary Approaches to Stop Hypertension (DASH) diet, Western diet, and risk of gout in men: prospective cohort study. BMJ, 357, 1794. https://doi.org/10.1136/BMJ.J1794
- Yokose, C., McCormick, N., Lu, N., Joshi, A. D., Curhan, G., & Choi, H. K. (2022). Adherence to 2020 to 2025 Dietary Guidelines for Americans and the Risk of New-Onset Female Gout. JAMA Internal Medicine, 182(3), 254–264. https://doi.org/10.1001/JAMAINTERNMED.2021.7419
- de Backer, G., Jankowski, P., Kotseva, K., Mirrakhimov, E., Reiner, Ž., Rydén, L., Tokgözoğlu, L., Wood, D., de Bacquer, D., Jankowski, P., Kotseva, K., Reiner, Z., Rydén, L., Tokgözoğlu, L., Wood, D., de Bacquer, D., Abreu, A., Aguiar, C., Badariene, J., … Fearnley, M. (2019). Management of dyslipidaemia in patients with coronary heart disease: Results from the ESC-EORP EUROASPIRE V survey in 27 countries. Atherosclerosis, 285, 135–146. https://doi.org/10.1016/j.atherosclerosis.2019.03.014
- De Vera MA, Marcotte G, Rai S, Galo JS, Bhole V. Medication adherence in gout: a systematic review. Arthritis Care Res (Hoboken). 2014 Oct;66(10):1551-9. doi: 10.1002/acr.22336.
- Abhishek A, et al. Long-term persistence and adherence on urate-lowering treatment can be maintained in primary care-5-year follow-up of a proof-of-concept study. Rheumatology (Oxford). 2017 Apr 1;56(4):529-533. doi: 10.1093/rheumatology/kew395.
- Mantarro, S., Capogrosso-Sansone, A., Tuccori, M., Blandizzi, C., Montagnani, S., Convertino, I., Antonioli, L., Fornai, M., Cricelli, I., Pecchioli, S., Cricelli, C., & Lapi, F. (2015). Allopurinol adherence among patients with gout: an Italian general practice database study. International Journal of Clinical Practice, 69(7), 757–765. https://doi.org/10.1111/IJCP.12604
- Ughi, N., Prevete, I., Ramonda, R., Cavagna, L., Filippou, G., Manara, M., Bortoluzzi, A., Parisi, S., Ariani, A., & Scirè, C. A. (2019). The Italian Society of Rheumatology clinical practice guidelines for the diagnosis and management of gout. Reumatismo, 71(S1), 50–79. https://doi.org/10.4081/reumatismo.2019.1176
- Punzi L. The role of clinical inertia in suboptimal management of gout. Swiss Med Wkly. 2020 Aug 19;150:w20334. doi: 10.4414/smw.2020.20334.
- Punzi L, Scanu A, Galozzi P, Luisetto R, Spinella P, Scirè CA, Oliviero F. One year in review 2020: gout. Clin Exp Rheumatol. 2020 Sep-Oct;38(5):807-821.
- Latourte A, et al. 2020 Recommendations from the French Society of Rheumatology for the management of gout: Management of acute flares. Joint Bone Spine. 2020 Oct;87(5):387-393. doi: 10.1016/j.jbspin.2020.05.001.
- Pascart T, et al. 2020 recommendations from the French Society of Rheumatology for the management of gout: Urate-lowering therapy. Joint Bone Spine. 2020 Oct;87(5):395-404. doi: 10.1016/j.jbspin.2020.05.002.
- FitzGerald JD, et al. 2020 American College of Rheumatology Guideline for the Management of Gout. Arthritis Care Res (Hoboken). 2020 Jun;72(6):744-760. doi: 10.1002/acr.24180.
- McDowell K, et al. Dapagliflozin reduces uric acid concentration, an independent predictor of adverse outcomes in DAPA-HF. Eur J Heart Fail. 2022 Jun;24(6):1066-1076. doi: 10.1002/ejhf.2433.
- Mogensen UM, et al; PARADIGM-HF Investigators and Committees. Sacubitril/valsartan reduces serum uric acid concentration, an independent predictor of adverse outcomes in PARADIGM-HF. Eur J Heart Fail. 2018 Mar;20(3):514-522. doi: 10.1002/ejhf.1056. Epub 2017 Nov 30.
- Høieggen A, et al; LIFE Study Group. The impact of serum uric acid on cardiovascular outcomes in the LIFE study. Kidney Int. 2004 Mar;65(3):1041-9. doi: 10.1111/j.1523-1755.2004.00484.x.
- Verma S. Association between uric acid levels and cardio-renal outcomes and death in patients with type 2 diabetes: A subanalysis of EMPA-REG OUTCOME. Diabetes Obes Metab. 2020 Jul;22(7):1207-1214. doi: 10.1111/dom.13991.
- Ferreira JP, et al. Empagliflozin and uric acid metabolism in diabetes: A post hoc analysis of the EMPA-REG OUTCOME trial. Diabetes Obes Metab. 2022 Jan;24(1):135-141. doi: 10.1111/dom.14559.
- Doehner W, et al. Uric acid and sodium-glucose cotransporter-2 inhibition with empagliflozin in heart failure with reduced ejection fraction: the EMPEROR-reduced trial. Eur Heart J. 2022 Sep 21;43(36):3435-3446. doi: 10.1093/eurheartj/ehac320.
- Elion GB, et al. Potentiation by inhibition of drug degradation: 6-substituted purines and xanthine oxidase. Biochem Pharmacol1963;12: 85-93.
- Pacher P, et al. Therapeutic effects of xanthine oxidase inhibitors: renaissance half a century after the discovery of allopurinol. Pharmacol Rev. 2006;58(1):87-114.
- Takano Y, et al. Selectivity of febuxostat, a novel non-purine inhibitor of xanthine oxidase/xanthine dehydrogenase. Life Sci. 2005 Mar 4;76(16):1835-47.
- Rundles RW, et al. Allopurinol in the treatment of gout. Ann Intern Med 1966;64:229-58.
- Horiuchi H, et al. A comparative study on the hypouricemic activity and potency in renal xanthine calculus formation of two xanthine oxidase/xanthine dehydrogenase inhibitors: TEI-6720 and allopurinol in rats. Res Commun Mol Pathol Pharmacol1999; 104:307-19.
- Mayer MD, et al. Pharmacokinetics and pharmacodynamics of febuxostat, a new non-purine selective inhibitor of xanthine oxidase in subjects with renal impairment. Am J Ther 2005;12:22-34.
- Becker MA, et al. Febuxostat, a novel nonpurine selective inhibitor of xanthine oxidase: a twenty-eight-day, multicenter, phase II, randomized, double-blind, placebocontrolled placebo controlled, dose-response clinical trial examining safety and efficacy in patients with gout. Arthritis Rheum 2005; 52: 916-23.
- Schumacher HR Jr, et al. Febuxostat in the treatment of gout: 5-yr findings of the FOCUS efficacy and safety study. Rheumatology (Oxford) 2009; 48: 188-94.
- Becker MA, et al. The urate-lowering efficacy and safety of febuxostat in the treatment of the hyperuricemia of gout: the CONFIRMS trial. Arthritis Res Ther 2010; 12:R63.
- Terkeltau BR. Update on gout: new therapeutic strategies and options. Nat Rev Rheumatol. 2010;6(1):30-8.
- Becker MA, et al. Febuxostat compared with allopurinol in patients with hyperuricemia and gout. N Engl J Med 2005;353:2450-2461.
- Schumacher HR Jr, et al. Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout: a 28-week, phaseIII, randomized, double-blind, parallel-group trial. Arthritis Rheum. 2008; 59: 1540-1548.
- Singh JA, et al. Comparative effectiveness of urate lowering with febuxostat versus allopurinol in gout: analyses from large U.S. managed care cohort. Arthritis Res Ther. 2015 May 12;17(1):120. doi: 10.1186/s13075-015-0624-3.
- Higgins P, et al. Xanthine oxidase inhibition for the treatment of cardiovascular disease: a systematic review and metaanalysis. Cardiovasc Ther. 2012 Aug;30(4):217-26.
- Hare JM, et al. Impact of Oxypurinol in Patients With Symptomatic Heart Failure Results of the OPT-CHF Study. J Am Coll Cardiol 2008;51:2301-2309.
- Givertz MM, et al. NHLBI Heart Failure Clinical Research Effects of Xanthine Oxi dase Inhibition in Hyperuricemic Heart Failure Patients: The Xanthine Oxidase Inhibition for Hyperuricemic Heart Failure Patients (EXACT-HF) Study. Circulation. 2015;131(20):1763- 71.
- Otaki Y, et al. Association of plasma xanthine oxidoreductase activity with severity and clinical outcome in patients with chronic heart failure. Int J Cardiol. 2017 Feb 1;228:151-157.
- Nicholls A, et al. Effect of oestrogen therapy on plasma and urinary levels of uric acid. Br Med J. 1973 Feb 24;1(5851):449-51.
- Fang J, et al. Serum uric acid and cardiovascular mortality the NHANES I epidemiologic follow-up study, 1971-1992. National Health and Nutrition Examination Survey. JAMA. 2000 May 10;283(18):2404-10.
- Kimura K, et al. Febuxostat Therapy for Patients With Stage 3 CKD and Asymptomatic Hyperuricemia: A Randomized Trial. Am J Kidney Dis. 72(6): 798-810.
- Mackenzie IS, et al; ALL-HEART Study Group. Allopurinol versus usual care in UK patients with ischaemic heart disease (ALL-HEART): a multicentre, prospective, randomised, open-label, blinded-endpoint trial. Lancet. 2022 Oct 8;400(10359):1195-1205. doi: 10.1016/S0140-6736(22)01657-9. PMID: 36216006.
- Terkeltaub R, et al. Recent developments in our understanding of the renal basis of hyperuricemia and the development of novel antihyperuricemic therapeutics. Arthritis Res Ther. 2006;8 Suppl 1(Suppl 1):S4. doi: 10.1186/ar1909.
- Wright DF, et al. Predicting allopurinol response in patients with gout. Br J Clin Pharmacol. 2016 Feb;81(2):277-89. doi: 10.1111/bcp.12799.
- Stamp LK, et al. Starting dose is a risk factor for allopurinol hypersensitivity syndrome: a proposed safe starting dose of allopurinol. Arthritis Rheum. 2012 Aug;64(8):2529-36. doi: 10.1002/art.34488.
- Yokose C, et al. Heart disease and the risk of allopurinol-associated severe cutaneous adverse reactions: a general population-based cohort study. CMAJ. 2019 Sep 30;191(39):E1070-E1077. doi: 10.1503/cmaj.190339
- Ramasamy SN, et al. Allopurinol hypersensitivity: a systematic review of all published cases, 1950-2012. Drug Saf. 2013 Oct;36(10):953-80. doi: 10.1007/s40264-013-0084-0.
- Stamp LK, et al. Impaired response or insufficient dosage? Examining the potential causes of “inadequate response” to allopurinol in the treatment of gout. Semin Arthritis Rheum. 2014 Oct;44(2):170-4. doi: 10.1016/j.semarthrit.2014.05.007.
- Neogi T. Clinical practice. Gout. N Engl J Med. 2011 Feb 3;364(5):443-52. doi: 10.1056/NEJMcp1001124.
- Mukoyoshi M, et al. In vitro drug-drug interaction studies with febuxostat, a novel non-purine selective inhibitor of xanthine oxidase: plasma protein binding, identification of metabolic enzymes and cytochrome P450 inhibition. Xenobiotica. 2008 May;38(5):496-510. doi: 10.1080/00498250801956350.
- Jackson RL, Hunt B, MacDonald PA. The efficacy and safety of febuxostat for urate lowering in gout patients ≥65 years of age. BMC Geriatr. 2012 Mar 21;12:11. doi: 10.1186/1471-2318-12-11.
- White WB, et al. Cardiovascular safety of febuxostat or allopurinol in patients with gout. N Engl J Med 2018;378: 1200-10.
- Katsiki N, et al. The future of febuxostat after the Cardiovascular Safety of Febuxostat and Allopurinol in Patients with Gout and Cardiovascular Morbidities (CARES) trial: who CARES? Expert Opin Pharmacother. 2018 Oct 4:1-4. doi: 10.1080/14656566.2018.1532503
- Mackenzie IS, et al. FAST Study Group. Long-term cardiovascular safety of febuxostat compared with allopurinol in patients with gout (FAST): a multicentre, prospective, randomised, open-label, non-inferiority trial. Lancet. 2020 Nov 28;396(10264):1745-1757.
- Gao L et al. Cardiovascular safety of febuxostat compared to allopurinol for the treatment of gout: A systematic and meta-analysis Clin Cardiol. 2021;44:907–916)
- Kimura Y, Tsukui D, Kono H. Uric Acid in Inflammation and the Pathogenesis of Atherosclerosis. Int J Mol Sci. 2021 Nov 17;22(22):12394. doi: 10.3390/ijms222212394.
- Unger T, et al. 2020 International Society of Hypertension Global Hypertension Practice Guidelines. Hypertension. 2020 Jun;75(6):1334-1357. doi: 10.1161/HYPERTENSIONAHA.120.15026.
Related papers
La medicina tradizionale basa le sue scelte e soluzioni terapeutiche sulla dimostrazione della efficacia dei farmaci quale emerge dai risultati degli studi clinici controllati che selezionano le molecole più efficaci e dettano la strategia di impiego nei pazienti in cui si presume una maggiore efficacia. Nell’ambito di questa strategia di condotta è possibile identificare due [more info]
L’insostenibile leggerezza dell’essere, splendido romando di Milan Kundera, ha come tema principale la pesantezza esistenziale. Ogni persona vive una sola volta e non si ha mai la possibilità di valutare le proprie scelte, perciò diventa difficile capire se tutto ciò che si fa nella vita è giusto o sbagliato, perché non si ha modo di [more info]
Introduzione Le malattie cardiovascolari (CV) costituiscono una delle principali cause di mortalità in tutto il mondo. Secondo l’Organizzazione Mondiale della Sanità (OMS), nel 2019 circa il 32% delle morti globali è stato attribuito a malattie cardiovascolari (1). Tra queste, ruolo predominante gioca la malattia coronarica aterosclerotica, la quale rappresenta la prima causa di mortalità e [more info]