- Sistema Renina-Angiotensina-Aldosterone (SRAA) e ipertensione
Il Sistema Renina-Angiotensina-Aldosterone (SRAA) è un meccanismo ormonale di vitale importanza per la regolazione della pressione sanguigna e l’omeostasi idroelettrolitica. Il sistema viene innescato dalla secrezione dell’enzima renina, prodotto dai reni in risposta a stimoli quali ridotta pressione sanguigna, ipovolemia o scarsità di sodio (1). Al suo rilascio, consegue una reazione a catena che conduce alla produzione di angiotensina II ad opera dell’enzima di conversione dell’angiotensina (ACE), presente nelle cellule endoteliali di piccoli e grandi vasi. Angiotensina II è un potente vasocostrittore, attiva il sistema simpatico e stimola la secrezione surrenalica di aldosterone con conseguente ritenzione di sodio (1). L’angiotensina II può essere sia circolante che tissutale ed è responsabile dell’aumento della pressione sanguigna attraverso l’attivazione del suo recettore di tipo 1 (AT1) (3). ACE non è l’unico enzima che media la produzione di angiotensina II: anche il complesso enzimatico CAGE (enzima generante angiotensina II chemiostatico-sensibile), la chimasi e la catepsina G possono convertire angiotensina I in angiotensina II (4,5). Fondamentale è anche l’azione dell’aldosterone, ormone terminale del SRAA, che regola l’equilibrio dei liquidi corporei e di vari elettroliti, tra cui sodio e potassio (1). Il SRAA regola dunque la pressione sanguigna, mantiene la tonicità vascolare e l’omeostasi idroelettrolitica corporea fondamentale per un corretto funzionamento di cuore e reni, senza rispettivi sovraccarichi (2). Tuttavia, la sua attivazione cronica, in molteplici patologie, comporta svariati effetti negativi, soprattutto a livello cardiovascolare.
L’iperattivazione del SRAA ha un’azione fortemente vasocostrittiva, ipertrofica, pro-fibrotica e pro-infiammatoria, a livello della muscolatura liscia, e conduce all’ipertensione sistemica e al rimodellamento dei tessuti cardiovascolari e renali. Inoltre favorisce l’insorgenza e la progressione del danno cardiovascolare in patologie quali ipertensione, infarto miocardico acuto e insufficienza cardiaca cronica. L’attivazione cronica del SRAA è anche coinvolta nello sviluppo di malattie renali croniche, complicazioni epatiche (alimentate dall’azione pro-infiammatoria), obesità (per l’azione sugli adipociti), diabete e disturbi del sistema nervoso (2). Di fatto, la disregolazione del SRAA alimenta il rischio cardiovascolare e di danno d’organo a cui conseguono eventi clinici anche fatali. Per questa ragione, sono molti i farmaci ideati per agire sull’iperattivazione del SRAA: gli ACE-inibitori impediscono la conversione di angiotensina I in angiotensina II; i sartani bloccano il legame dell’angiotensina II al suo recettore AT1; e, infine, gli antagonisti dei recettori dei mineralcorticoidi agiscono a valle, frenando le conseguenze dell’azione dell’aldosterone.
- Farmaci antipertensivi: gli ACE-inibitori
Il primo farmaco ACE-inibitore messo in commercio per il trattamento dell’ipertensione è stato captopril, nel 1980, seguito rapidamente da numerosi altri quali enalapril, perindopril, lisinopril, ramipril, quinapril, benazepril, cilazapril, trandolapril, fosinopril, moexipril, imidapril e zofenopril (3). Tutte queste sono molecole analoghe alla 2-metilpropionil-L-prolina (6). Il target molecolare di questa classe di medicinali è l’enzima ACE, responsabile della conversione da angiotensina I ad angiotensina II. ACE è una zinco-metalloproteinasi, generalmente ancorata alla membrana cellulare – solo una piccola parte viene rilasciata in circolo – e localizzata in vari tessuti i cui principali sono l’endotelio, di piccoli e grandi vasi, e i tessuti polmonari (3,7).
Dato il suo strategico posizionamento, ACE regola la quantità di angiotensina II circolante, la quale ha un ruolo di potente vasocostrittore. Di conseguenza, gli ACE-inibitori attuano un significativo effetto vasodilatatore che riduce la resistenza anche di piccole arteriole. La riduzione di angiotensina II aumenta la natriuresi, abbassa la pressione sanguigna e previene il rimodellamento del muscolo liscio e dei miociti cardiaci; ne consegue una riduzione della pressione arteriosa e venosa che riduce il pre- e il post-carico del cuore (8). La gittata e il battito cardiaco rimangono invariati e non viene riportata ipotensione posturale. Inoltre, gli ACE-inibitori interferiscono con la degradazione della bradichinina ossia un peptide, anch’esso substrato di ACE, che induce la vasodilatazione stimolando il rilascio di ossido nitrico (3,6).
Le caratteristiche farmacocinetiche e farmacodinamiche di ciascun ACE-inibitore dipendono dalla loro specifica affinità, potenza, lipofilia e ritenzione da parte dei tessuti che esprimono ACE; tali fattori ne determinano il perdurare dell’inibizione. Sebbene gli ACE-inibitori non agiscano sulla produzione di angiotensina II che si verifica per vie enzimatiche alternative – le quali potrebbero attenuare l’effetto antipertensivo nel lungo termine (9) –, questa classe di farmaci dimostra un adeguato controllo pressorio per mesi o anni. Tale effetto sembra essere dovuto alla mancata degradazione di peptidi vasodilatatori, tra cui la bradichinina (3).
L’efficacia terapeutica antipertensiva degli ACE-inibitori riduce il rischio di quelle problematiche cardiovascolari e coronariche tipicamente associate ad elevati valori di pressione sanguigna (8). La loro azione correla con una riduzione dell’ipertrofia ventricolare sinistra, una riduzione dell’irrigidimento di piccole e grandi arterie e un miglioramento della funzione endoteliale (10,11). Inoltre, alcuni ACE-inibitori sembrano esercitare un effetto nefroprotettivo nei pazienti con nefropatia diabetica, grazie all’efficace riduzione della pressione sanguigna (3,12).
- Zofenopril
3.1. Indicazioni e posologia
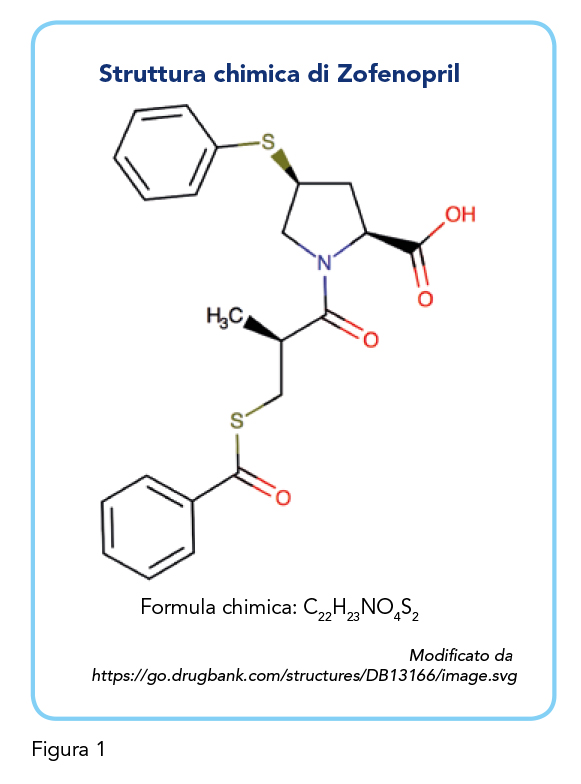
Zofenopril è un farmaco ACE-inibitore indicato per il trattamento dell’ipertensione essenziale in forma lieve e moderata, con solide evidenze di efficacia e sicurezza. Inoltre, i dati raccolti nel contesto degli studi SMILE hanno mostrato che l’impiego di questo ACE-inibitore può essere esteso anche al di là del controllo pressorio (13). Zofenopril è infatti indicato nel trattamento, iniziato entro le prime 24 ore, di pazienti che hanno subito un infarto miocardico acuto, con o senza sintomi di scompenso, emodinamicamente stabili e che non sono stati sottoposti a terapia con trombolitici. Zofenopril riduce il rischio di eventi cardiovascolari maggiori e la sua efficacia cardioprotettiva dipende anche dalla peculiare struttura chimica contenente un gruppo sulfidrilico (Figura 1) che conferisce una potente azione antiossidante, protettiva per l’endotelio e atta a rallentare il progredire dell’aterosclerosi (13-16).
Nei pazienti ipertesi, Zofenopril viene titolato a dosi crescenti a partire da 15 mg una volta al giorno a intervalli di 4 settimane. Il dosaggio va aggiustato in base alla risposta pressoria e risulta solitamente efficace alla dose di 30 mg, sempre una volta al giorno. La dose massima giornaliera che può essere raggiunta è di 60 mg, somministrabile singolarmente o in due dosi da 30 mg. Qualora non si raggiungesse il target pressorio, possono essere aggiunti altri farmaci antipertensivi (e.g. diuretici). Una combinazione dalla comprovata efficacia è quella con Idroclorotiazide, diuretico dal meccanismo d’azione complementare e con scarsa o nessuna interferenza sulla biodisponibilità reciproca.
I pazienti ipertesi con compromissione renale possono essere più suscettibili ad alcuni degli effetti avversi degli ACE-inibitori (e.g. ipotensione, iperkaliemia, neutropenia) (6,8): se la clearance di creatinina risulta > 45 mL/min, non sono richiesti aggiustamenti posologici; se si dovesse scendere al di sotto di questa soglia, la dose terapeutica di Zofenopril va dimezzata, senza modificare il regime posologico di una volta al giorno. Questo stesso procedimento di valutazione, somministrazione della terapia e cautele speciali va attuato anche nel caso di pazienti anziani. Se un paziente adulto presenta un danno renale grave ed è sottoposto a dialisi, il regime posologico diventa un quarto di quello del paziente con funzionalità renale normale. Nel caso di compromissione epatica lieve e moderata, è previsto un dimezzamento della dose normale mentre, in presenza di insufficienza epatica, Zofenopril è controindicato. Infine, efficacia e sicurezza di questo farmaco non sono state stabilite al di sotto dei 18 anni, popolazione che, pertanto, non va trattata con Zofenopril.
L’efficacia cardioprotettiva e di prevenzione degli eventi cardiovascolari maggiori di Zofenopril nei pazienti con infarto miocardico post-acuto è stata dimostrata nei quattro studi randomizzati e controllati del programma SMILE che hanno coinvolto oltre 3.600 pazienti (13). La presenza di un gruppo sulfidrilico nella struttura chimica di Zofenopril contribuisce a tali proprietà cardioprotettive e conferisce un elevato potere antiossidante che lo contraddistingue dalla maggior parte degli ACE-inibitori. Nei pazienti che hanno subito recente infarto miocardico, il trattamento con Zofenopril deve iniziare entro 24 ore dall’evento e perdurare per almeno 6 settimane (17). Numerosi studi hanno mostrato una riduzione del rischio di mortalità e morbilità quando gli ACE-inibitori vengono somministrati nella fase acuta dell’infarto miocardico (13). Secondo un’ampia meta-analisi effettuata sui dati di circa 100.000 pazienti trattati con ACE-inibitori nelle prime 24 ore dall’evento di post-infarto miocardico (18), i benefici di questo intervento precoce sono presumibilmente dovuti a un ruolo positivo del rimodellamento tissutale e sono proporzionalmente maggiori nei sottogruppi a rischio più elevato (13,18). Tali benefici sono inoltre complementari a quelli osservati successivamente negli studi di terapia prolungata con ACE-inibitori iniziata diversi giorni o settimane dopo l’infarto in pazienti con evidenza di insufficienza cardiaca o disfunzione ventricolare sinistra (13,18). La titolazione di Zofenopril in questa tipologia di pazienti prevede una dose iniziale di 7,5 mg ogni 12 ore (1° e 2° giorno) che va poi aumentata a 15 mg ogni 12 ore (3° e 4° giorno) e, infine, aumentata ancora a 30 mg ogni 12 ore (dal 5° giorno in poi). Eccezione a questa titolazione è il caso in cui si manifesti bassa pressione sistolica (≤ 120 mmHg) all’inizio del trattamento o nei primi 3 giorni successivi all’infarto: in questo caso la dose non va aumentata. Se la pressione sistolica dovesse risultare ≤ 100 mmHg (ipotensione), si può proseguire il trattamento con l’ultima dose tollerata; se invece questa dovesse scendere sotto i 90 mmHg per due misurazioni consecutive a meno di 1 ora di distanza, la terapia con Zofenopril va interrotta. Trascorse 6 settimane, la condizione del paziente va rivalutata e il farmaco deve essere sospeso nei casi in cui non vi siano più segni di disfunzione ventricolare o scompenso. La terapia con Zofenopril non è indicata nei pazienti con infarto miocardico che presentano compromissione epatica o renale o sono sottoposti a dialisi. Zofenopril va inoltre utilizzato con cautela nei pazienti con infarto al di sopra dei 75 anni. Qualora considerato appropriato, è possibile somministrare al paziente che ha subito infarto miocardico acuto altre terapie standard, tra cui l’acido acetilsalicilico (ASA). Gli ACE-inibitori sulfidrilici come Zofenopril mantengono i loro benefici cardiovascolari anche in presenza di inibitori della cicloossigenasi quali ASA (19,20). Inoltre, lo studio SMILE-4 ha dimostrato che la combinazione Zofenopril+ASA conferisce una migliore protezione cardiovascolare rispetto all’associazione di ASA con Ramipril (19).
3.2. Meccanismo d’azione
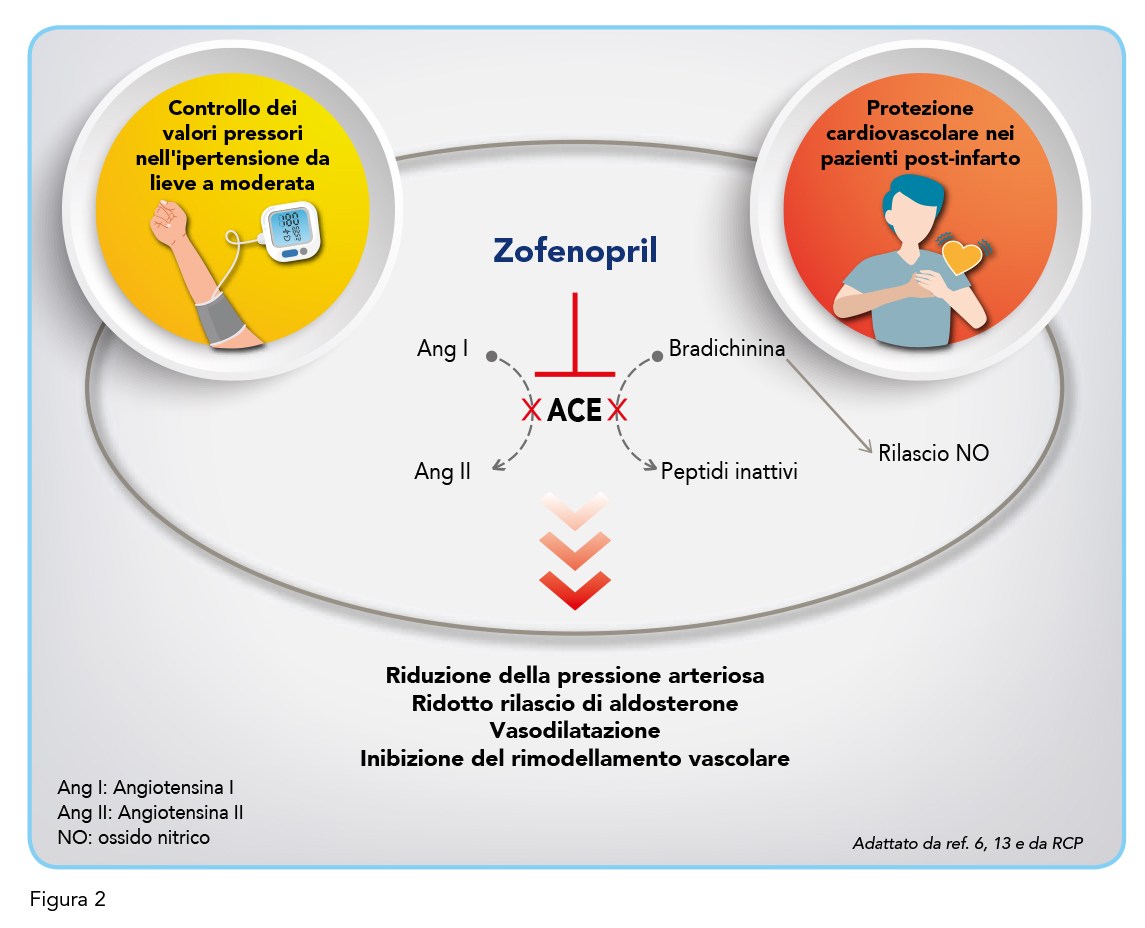
Zofenopril è un ACE-inibitore sulfidrilico caratterizzato da elevata lipofilia, da un alto grado di penetrazione tissutale di lunga durata, da un’inibizione selettiva dell’ACE del tessuto cardiaco e da una potente attività antiossidante (21). La presenza del gruppo sulfidrilico conferisce un’elevata affinità allo zinco situato nel sito di legame di ACE (13). Somministrato alle dosi di 30 mg e 60 mg, Zofenopril riduce l’attività plasmatica di ACE del 53,4% e del 74,4%, rispettivamente. Attraverso l’inibizione di questo enzima chiave del SRAA, Zofenopril riduce la produzione di angiotensina II e aumenta i livelli di bradichinina (Figura 2). Per quanto riguarda l’angiotensina II, una molecola dalle note proprietà vasocostrittrici e di ritenzione salina, la sua diminuzione comporta un aumento della natriuresi, una riduzione della pressione sanguigna e previene il rimodellamento della muscolatura liscia e dei miociti cardiaci, con conseguenti benefici cardiovascolari (8). Parallelamente, Zofenopril inibisce la degradazione della bradichinina (mediatore del sistema callicreina-chinina) che, aumentando in concentrazione, stimola i recettori B2 (recettori della bradichinina di tipo 2) espressi a livello endoteliale e della muscolatura liscia. Questo meccanismo favorisce il secondario rilascio di mediatori vasodilatatori tra cui ossido nitrico (NO), prostaglandine e fattore iperpolarizzante di derivazione endoteliale (13), contribuendo così al beneficio endoteliale e all’effetto antipertensivo.
In studi preclinici e clinici, Zofenopril ha dimostrato di esercitare un’azione vasculoprotettiva e cardioprotettiva indipendente dai suoi potenti effetti di riduzione della pressione arteriosa attraverso il blocco dello SRAA (22). Zofenopril agisce da donatore di idrogeno solforato (H2S), una molecola di segnalazione citoprotettiva che, in cooperazione con NO, mantiene l’omeostasi fisiologica sia nel cuore che nella circolazione e protegge dalle lesioni da ischemia-riperfusione miocardica (13,22). L’aumentata biodisponibilità di H2S determinata da Zofenopril attiva l’enzima eNOS (ossido nitrico sintasi endoteliale) favorendo ulteriormente il rilascio di NO a livello endoteliale. Zofenopril contribuisce anche all’aumentata espressione di enzimi antiossidanti quali Trx-1, GPx-1 e SOD-1 (13,22). Globalmente, questo meccanismo potenzia la difesa antiossidante del tessuto e previene la formazione di specie reattive dell’ossigeno in seguito alla lesione ischemica, proteggendo di conseguenza l’endotelio da possibili danni. Invero, una peculiarità dimostrata da Zofenopril è quella di rallentare il progredire dell’aterosclerosi, come dimostrato in uno studio clinico randomizzato su 48 pazienti con ipertensione da lieve a moderata (16). Si è osservata una minore progressione dell’ispessimento dell’intima media carotidea fino a 5 anni nel gruppo trattato con Zofenopril rispetto a un altro ACE-inibitore, Enalapril, accompagnata da un miglioramento dei marker plasmatici di NO/stress ossidativo (16).
3.3. Farmacocinetica
Zofenopril è una molecola altamente lipofilica, caratteristica che determina diverse delle sue proprietà farmacocinetiche come l’assorbimento orale, un grado apprezzabile di escrezione biliare e, probabilmente più importante, una maggiore penetrazione nei tessuti (21). Viene somministrato per via orale in forma di profarmaco come Zofenopril calcio, e la sua AUC non varia significativamente in seguito ad assunzione concomitante di cibo. L’assorbimento è rapido e completo, come anche la successiva conversione in zofenoprilato, il composto sulfidrile libero derivato dall’idrolisi del tio-estere. Il picco della concentrazione ematica viene raggiunto dopo 1,5 ore da un’assunzione orale singola, con cinetica lineare e senza accumulo anche a seguito di 3 settimane di somministrazione giornaliera di 15-60 mg. Il volume di distribuzione è di 96 litri allo steady-state e il legame alle proteine plasmatiche è pari all’88%. Lo zofenoprilato è il principale sottoprodotto del metabolismo di Zofenopril calcio (22%), assieme ad altri sette metaboliti; la sua emivita corrisponde a 5,5 ore e la sua cleareance in tutto l’organismo è di 1.300 mL/min. Sia Zofenopril calcio che zofenoprilato subiscono eliminazione per doppia via (biliare e renale): nel caso del profarmaco questa corrisponde rispettivamente al 69% tramite feci e al 26% tramite urine; nel caso del metabolita attivo è, invece, il 76% tramite feci e il 16% tramite urine.
3.4. Sicurezza e tollerabilità
Gli ACE-inibitori sono tra i medicinali più utilizzati nel trattamento dell’ipertensione e del post-infarto miocardico e il loro utilizzo ha mostrato comprovate evidenze di sicurezza e tollerabilità. Zofenopril è ben tollerato anche a dosi elevate (8), ma richiede specifiche cautele nei pazienti con deplezione di liquidi ed elettroliti, scompenso cardiaco o compromissione renale, poiché può condurre a ipotensione sintomatica (si veda la posologia in RCP). Gli effetti avversi più comuni sono: capogiri, cefalea, nausea/vomito, stanchezza e tosse secca. Quest’ultima, in particolare, è il motivo più frequente di interruzione del trattamento con ACE-inibitori, con un’incidenza stimata che arriva fino al 10% dei pazienti trattati (23,24). Zofenopril, tuttavia, ha mostrato un’incidenza relativamente bassa di tosse secca persistente con una frequenza del 2,4% secondo la revisione di dati individuali, sia pubblicati che inediti, provenienti da studi randomizzati in doppio cieco e da studi post-marketing, per un totale di circa 6.000 pazienti ipertesi (24). La tosse correlata all’impiego di Zofenopril, comunque, era generalmente di intensità lieve o moderata e tendeva a verificarsi più spesso solo all’inizio del trattamento, nei primi 6 mesi (24). La combinazione con Idroclorotiazide non sembrava aumentare significativamente la possibilità di tosse nei pazienti trattati con Zofenopril, con un’incidenza osservata pari al 3,0% (24). Infine, l’incidenza complessiva di tosse osservata in studi randomizzati in doppio cieco sull’impego di Zofenopril nel trattamento di pazienti post-infarto miocardico (n=1.455) è risultata pari al 3,6% (24), confermandosi un farmaco ben tollerato anche in questa categoria di pazienti. Globalmente, una ridotta incidenza di tosse può migliorare la compliance del paziente alla terapia antipertensiva.
Zofenopril è controindicato nei casi di: 1) ipersensibilità al farmaco, agli eccipienti o a qualsiasi altro ACE-inibitore; 2) familiarità o episodi pregressi di edema angioneurotico; 3) grave compromissione epatica; 4) secondo e terzo semestre di gravidanza; 5) stenosi bilaterale dell’arteria renale (o unilaterale in caso di rene singolo); 6) utilizzo concomitante con Aliskiren nei pazienti con diabete mellito o compromissione renale (velocità di filtrazione glomerulare < 60 mL/min/1,73 m2) o parallelamente a Sacubritil/Valsartan (anche a meno di 36 ore dall’ultima dose).
Alcuni pazienti trattati con ACE-inibitori hanno manifestato angioedema come reazione da ipersensibilità. È una reazione avversa rara che può avvenire principalmente nelle prime settimane di trattamento e spiegabile da un aumento delle concentrazioni di bradichinina e da un possibile aumento delle concentrazioni di altri peptidi, come la sostanza P (3).
Zofenopril inibisce il rilascio dell’aldosterone (6) e può dunque influire sui livelli di potassio, sebbene questo rimanga generalmente entro i valori sicuri. Pertanto si sconsiglia l’utilizzo concomitante di Zofenopril con agenti che aumentano il potassio sierico in presenza di grave compromissione renale o di diabete (3).
In alcune categorie sensibili di pazienti (con problematiche renali, collagenopatie vascolari, in trattamento con immunosoppressivi) sono stati riscontrati casi di trombocitopenia/agranulocitosi/neutropenia o anemia; si consiglia dunque un frequente monitoraggio della conta dei globuli bianchi e della conta ematica.
L’utilizzo concomitante di Zofenopril e altri farmaci antipertensivi (e.g. calcio-antagonisti, alfa- o beta-bloccanti) deve essere condotto con cautela per tenere sotto controllo possibili effetti antipertensivi additivi o di potenziamento. Inoltre, Zofenopril può essere utilizzato in concomitanza con terapie standard quali ASA (come indicato in RCP). Zofenopril sembra infatti mantenere le sua proprietà di protezione cardiovascolare anche in presenza di inibitori della cicloossigenasi (19). Infine, l’utilizzo concomitante con FANS (Farmaci Antinfiammatori Non Steroidei) può ridurre l’effetto antipertensivo degli ACE-inibitori.
3.5 Studi sull’efficacia antipertensiva di Zofenopril
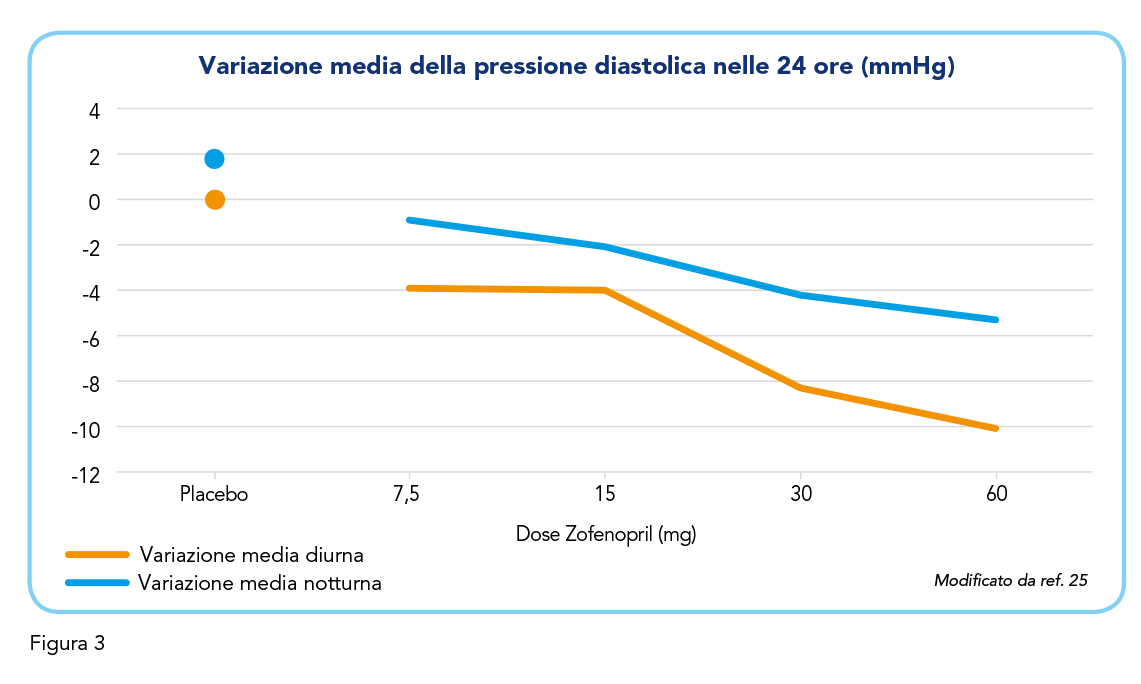
Svariati studi hanno caratterizzato la capacità di Zofenopril di ridurre la pressione arteriosa. In termini di dosaggio, uno di questi studi (25) ha valutato l’efficacia antipertensiva e la sicurezza di Zofenopril tra i 7,5 e i 60 mg (dose massima indicata in RCP). Sono stati reclutati 211 pazienti con pressione diastolica compresa tra i 95 e i 110 mmHg e, dopo 2 settimane di placebo, 43 pazienti hanno iniziato a ricevere Zofenopril alla dose di 7,5 mg, 39 alla dose di 15 mg, 44 alla dose di 30 mg, 42 alla dose di 60 mg e 43 hanno ricevuto il placebo (si ricorda, ai fini dell’applicazione clinica, di seguire la titolazione prevista dall’RCP del farmaco). Nel gruppo trattato con Zofenopril, la pressione diastolica media è diminuita nelle 24 ore secondo un andamento dose-dipendente e con un effetto più pronunciato durante il giorno rispetto alla notte (Figura 3). Una significativa riduzione della pressione diastolica diurna e notturna è stata ottenuta con zofenopril 60 mg. Le dosi che hanno indotto un maggiore effetto antipertensivo sono state quelle di 30 mg e di 60 mg, rispettivamente con il 54,3% e il 69,4% dei pazienti in cui la pressione diastolica si è normalizzata. Infine, le analisi laboratoriali non hanno evidenziato alcun problema di sicurezza del farmaco.
In seguito, altri studi hanno confrontato Zofenopril con altri farmaci antipertensivi di comune utilizzo quali altri ACE-inibitori, sartani, beta-bloccanti o calcio-antagonisti. Rispetto a Enalapril, Zofenopril ha mostrato un effetto antipertensivo più pronunciato durante le prime 4 settimane di trattamento in pazienti con ipertensione da lieve a moderata (26). Questa differenza si è annullata nelle settimane successive anche grazie alla possibilità, prevista dal disegno di studio, di aumentare il dosaggio da 30 a 60 mg/die per Zofenopril, e da 20 a 40 mg/die per Enalapril. Questo raddoppiamento della dose è stato necessario in una maggiore proporzione di pazienti del gruppo Enalapril, rispetto al gruppo Zofenopril. La frequenza di effetti collaterali è risultata anch’essa comparabile, anche se la gravità degli eventi avversi era significativamente più lieve con Zofenopril. Inoltre, Zofenopril eguaglia l’efficacia antipertensiva di Lisinopril, un ulteriore ACE-inibitore, nei pazienti anziani (27). Rispetto, invece, ad Atenololo (beta-bloccante), oltre che essere più rapido in efficacia, Zofenopril risulta anche meglio tollerato (28). In questo studio, sono stati reclutati 304 pazienti di mezza età o anziani con ipertensione lieve o moderata. Dopo 4 settimane, la riduzione della pressione sanguigna è risultata significativamente maggiore con Zofenopril 30 mg/die rispetto ad Atenololo 50 mg/die (sistolica/diastolica: -15,6/-13,5 mmHg vs. -13,1/-11,8 mmHg). A seguito della possibilità di raddoppiare il dosaggio, gli esiti a 12 settimane sono risultati comparabili tra i due farmaci, anche se una maggiore percentuale di pazienti del gruppo Zofenopril ha raggiunto valori di pressione diastolica da seduti < 90 mmHg. In termini di tollerabilità, Zofenopril ha dimostrato un profilo migliore, con solo 14 individui con effetti avversi segnalati (9,1%) contro i 30 del gruppo Atenololo (20,8%).
Confrontando Zofenopril con diversi rappresentanti della classe dei sartani, questo ha mostrato di eguagliare Candesartan in entità e andamento della riduzione della pressione nei pazienti ipertesi nelle 24 ore (29) e di superare Losartan in efficacia durante il primo mese di trattamento (30). Per quest’ultimo studio sono stati arruolati 375 pazienti con ipertensione lieve o moderata. Sebbene l’entità di riduzione della pressione sanguigna, misurata presso uno studio clinico o in forma domiciliare, fosse equivalente a 12 settimane e a 3 mesi (con pari tollerabilità al trattamento), Zofenopril si è mostrato più efficace nel raggiungere livelli pressori inferiori durante il primo mese dello studio. Inoltre, la percentuale di pazienti ad aver necessitato un aumento della dose (da 30 a 60 mg per Zofenopril e da 50 a 100 mg per Losartan) era minore nel gruppo Zofenopril (33,1% vs 42,1%).
In ultimo, Zofenopril ha mostrato proprietà antipertensive pari a quelle di Amlodipina, farmaco calcio-antagonista (31). Lo studio in questione ha valutato, ad intervalli di 2 settimane, i valori pressori di 303 pazienti con ipertensione da lieve a moderata. Entrambi i farmaci hanno ridotto ad andamento comparabile la pressione sia sistolica che diastolica, fino a ridurla di almeno 10 mmHg a 12 settimane di trattamento.
3.6 Studi sull’associazione di Zofenopril a un diuretico (Idroclorotiazide)
Una problematica diffusa riguarda quei pazienti che, in trattamento monoterapico per l’ipertensione, non riescono a raggiungere valori pressori target. Di conseguenza, le linee guida ESC/ESH del 2018 consigliano, tra le varie possibili, la combinazione di un ACE-inibitore con un diuretico (32). I due farmaci hanno un effetto sinergico sul SRAA inibendo la produzione di angiotensina II, a monte, e sulla ritenzione di sodio e acqua da parte dei reni, a valle. La somministrazione concomitante di Zofenopril e Idroclorotiazide è un’associazione fissa e approvata in diversi paesi europei per la gestione dell’ipertensione da lieve a moderata (33). L’efficacia e la sicurezza di questa combinazione sono state testate in vari studi clinici; ne è un esempio l’indagine in cui sono stati confrontati gli effetti sulla pressione arteriosa di un trattamento randomizzato in doppio cieco di 12 settimane con Zofenopril (15, 30 o 60 mg) o Idroclorotiazide (12,5 o 25 mg) con quelli delle loro combinazioni (34). La riduzione della pressione sanguigna indotta dal trattamento combinato è risultata maggiore rispetto all’impiego dei due farmaci singoli, senza comportare una variazione nella manifestazione di effetti avversi che sono risultati perlopiù di lieve intensità. Questo studio ha inoltre dimostrato che la combinazione Zofenopril+Idroclorotiazide svolge un controllo pressorio regolare e omogeneo, come si è potuto osservare monitorando l’indice di variazione della pressione arteriosa nelle 24 ore (33,34). Si ricorda al lettore di applicare sempre dosaggi e posologia come da indicazione in RCP.
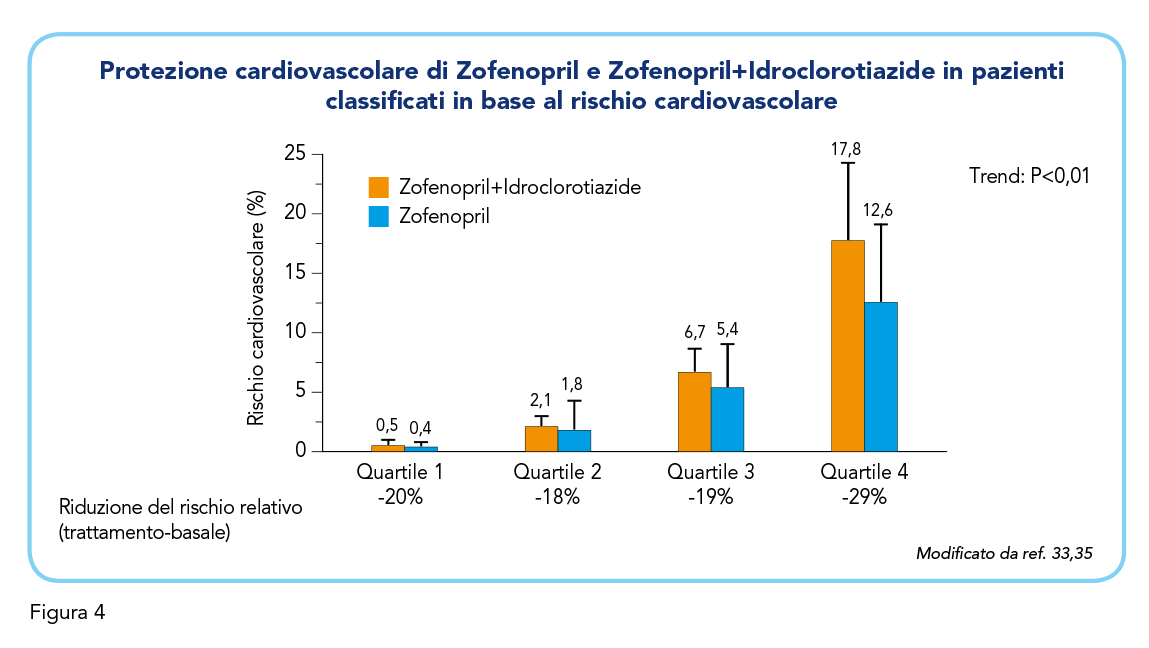
Una strategia a due farmaci ad azione sinergica può rivelarsi estremamente utile in quei pazienti che esibiscono uno o più fattori di alto rischio cardiovascolare, oltre che a migliorare la compliance dei pazienti alla terapia. Uno studio suggerisce che il trattamento combinato di Zofenopril+Idroclorotiazide sia associato a una maggiore efficacia antipertensiva rispetto alla monoterapia con Zofenopril, indipendentemente dalle fasce di rischio cardiovascolare stimate secondo il punteggio HEART (History, Electrocardiogram, Age, Risk factors, and Troponin). La differenza tra il trattamento combinato e la monoterapia è stata particolarmente evidente per il gruppo di pazienti a rischio più elevato (Figura 4) (35).
Riguardo la sicurezza e la tollerabilità di questa combinazione, i più comuni effetti avversi osservati sono quelli attesi durante il trattamento con un ACE-inibitore, cioè vertigini, cefalea e tosse (generalmente di gravità lieve o moderata). La tollerabilità complessiva di Zofenopril+Idroclorotiazide è simile a quella della monoterapia (33).
3.7 Progetto SMILE (Survival of Myocardial Infarction Long-term Evaluation): efficacia cardioprotettiva di Zofenopril nei pazienti post-infarto miocardico
Gli studi SMILE sono un gruppo di studi clinici che, nel corso degli ultimi decenni, hanno dimostrato che il beneficio dell’impiego di Zofenopril va al di là del controllo pressorio (13). Lo studio pilota SMILE (1988-1989) ha studiato sicurezza ed efficacia del trattamento a lungo termine con questo ACE-inibitore iniziando la terapia entro 24 ore dall’insorgenza dei sintomi in 204 pazienti con infarto miocardico acuto e non sottoposti a trattamento trombolitico (36). Zofenopril ha mostrato risultati preliminari favorevoli a livello di protezione cardiovascolare (i.e. riduzione della pressione sanguigna, dell’incidenza di insufficienza ventricolare sinistra acuta e di aritmie ventricolari, riduzione del numero di episodi anginosi e aumento della frazione di eiezione sinistra) senza causare eventi clinici o biochimici avversi irreversibili. La somministrazione precoce di Zofenopril dimostrava dunque, per la prima volta, di costituire una forma di terapia sicura nei pazienti che avevano subito infarto miocardico acuto, in particolare quando l’evento risultava complicato da ulteriori segni clinici di disfunzione cardiaca. Sulla base di questi risultati, sono stati avviati i successivi studi SMILE.
- SMILE-1 (17): Zofenopril è efficace nel ridurre il rischio di eventi cardiovascolari gravi post-infarto
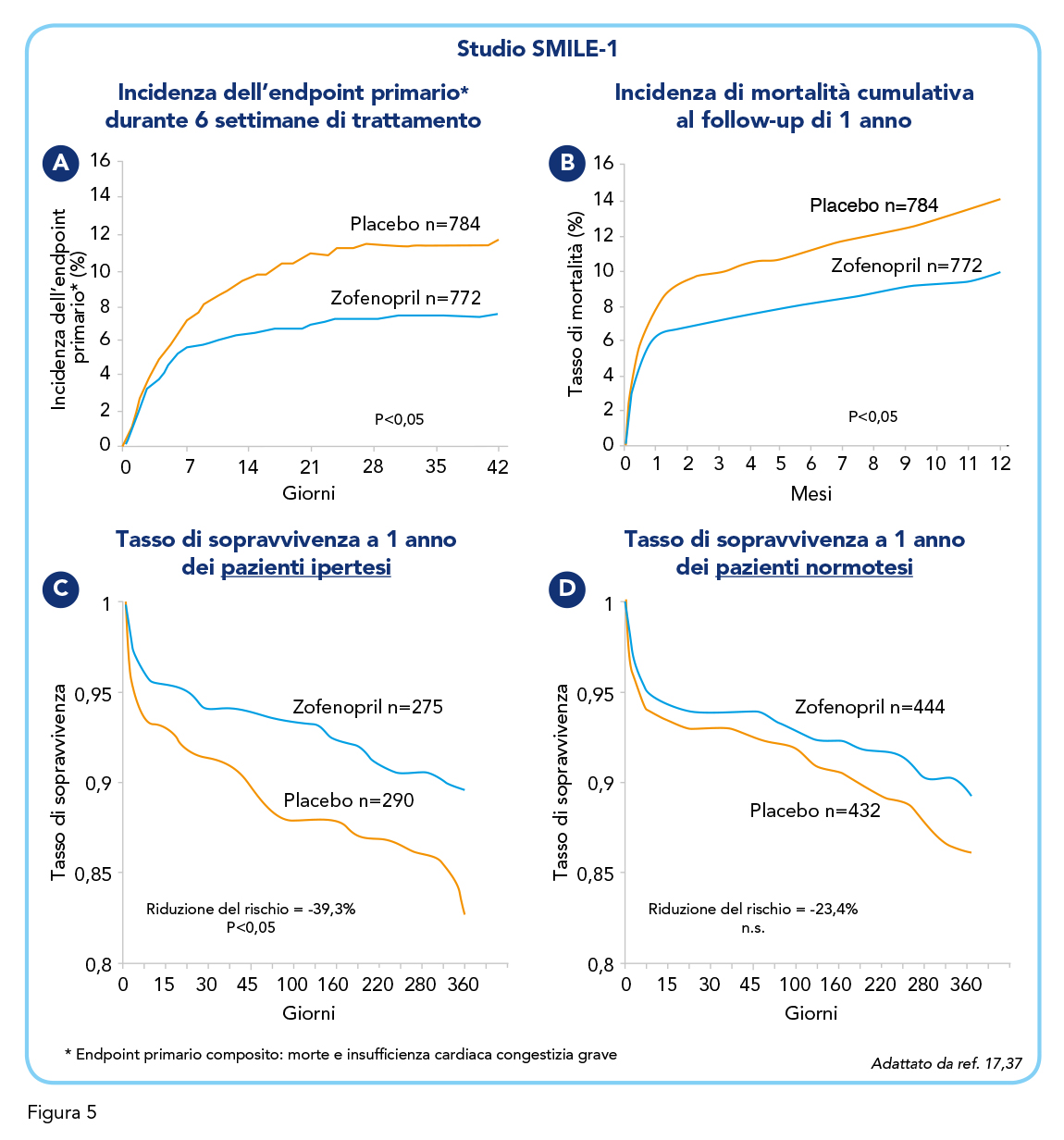
Lo studio SMILE-1 (1991-1992) ha valutato su ampia scala l’efficacia di Zofenopril osservata nello studio pilota. Si trattava di un disegno randomizzato, in doppio cieco e controllato su una coorte di 1.556 pazienti con confermato infarto miocardico acuto e non sottoposti a terapia trombolitica. 772 pazienti sono stati assegnati alla terapia con Zofenopril e confrontati con 784 pazienti assegnati al placebo. Il trattamento, intrapreso entro 24 ore dall’insorgenza dei sintomi di infarto miocardico anteriore acuto, iniziava alla dose di 7,5 mg, ripetuta dopo 12 ore e poi progressivamente titolata fino alla dose target di 30 mg due volte al giorno, sempre verificando che la pressione sistolica rimanesse al di sopra di 100 mmHg. I pazienti sono stati seguiti per tutta la loro permanenza ospedaliera, rivalutati dopo 4 settimane e poi nuovamente alla fine del periodo di trattamento (in media 6 settimane ± 3 giorni). L’endpoint primario composito era costituito da mortalità e da insorgenza di insufficienza cardiaca congestizia grave: l’una o l’altra si sono verificate in 55 pazienti nel gruppo Zofenopril (7,1%) e in 83 del gruppo placebo (10,6%), per una riduzione del 34% del rischio di eventi cardiovascolari severi nel gruppo Zofenopril (P<0,05; Figura 5A). Tale riduzione del rischio era principalmente dovuta ad una minor incidenza di insufficienza cardiaca congestizia grave, mentre la mortalità per tutte le cause a 6 settimane è risultata del 6,5% nel gruppo Zofenopril vs 8,3% nel gruppo placebo, equivalente ad una riduzione del rischio del 22% nel gruppo Zofenopril (n.s.). Nella valutazione della mortalità a 1 anno, si è evidenziato come i pazienti che avevano seguito la terapia con Zofenopril per 6 settimane mostrassero una riduzione del 29% dell’incidenza di mortalità (Zofenopril: 10,0% vs Placebo: 14,1; P<0,05; Figura 5B). Zofenopril si rivela dunque un farmaco con ottima attività di protezione cardiovascolare nei pazienti post-infarto.
Un’analisi post-hoc dello studio SMILE-1 ha confrontato gli esiti cardiovascolari del trattamento con Zofenopril in pazienti con e senza storia di ipertensione (37). Come nello studio principale, è stato messo a confronto il rischio relativo combinato di mortalità e insufficienza cardiaca congestizia severa dopo 6 settimane di trattamento e a 1 anno. Nei pazienti ipertesi, tale rischio relativo è risultato di 0,60 a 6 settimane e di 0,61 a 1 anno, contro un rischio, nei normotesi, di 0,89 e 0,77 a 6 settimane e a 1 anno rispettivamente (Figura 5C e 5D). Questa analisi suggerisce che il beneficio della somministrazione precoce di Zofenopril nei pazienti con infarto miocardico acuto sia significativamente maggiore nei pazienti con storia di ipertensione e perciò più soggetti a possibili complicazioni cardiovascolari future (37). Ulteriori sottoanalisi dello studio SMILE-1 hanno rivelato che Zofenopril riduce significativamente l’incidenza dell’endpoint primario combinato (mortalità e insufficienza cardiaca congestizia grave a 6 settimane) anche nelle sottopopolazioni di pazienti diabetici (38), pazienti con sindrome metabolica (39), pazienti con infarto del miocardio senza sopraslivellamento del tratto ST (40) e pazienti con ipercolesterolemia (41). In conclusione, il trattamento con Zofenopril ha migliorato significativamente l’esito a breve e a lungo termine quando questo farmaco è stato iniziato entro 24 ore dall’insorgenza dell’infarto miocardico anteriore acuto e continuato per 6 settimane.
- SMILE-2 (42): Zofenopril mostra un minor rischio relativo di ipotensione rispetto a Lisinopril
Il successivo studio SMILE-2 (1998-1999) ha studiato la sicurezza e la tollerabilità della somministrazione precoce di due ACE-inibitori – Zofenopril e Lisinopril – nei pazienti con infarto miocardico acuto. Questo studio, di fase III e condotto in 155 centri in Europa e Russia, aveva un disegno randomizzato, a doppio cieco, con gruppi paralleli e ha coinvolto complessivamente 1.024 pazienti tra i 18 e 75 anni. L’endpoint primario consisteva nel verificarsi di ipotensione grave (pressione arteriosa sistolica < 90 mmHg su due misurazioni consecutive a distanza di almeno 1 ora l’una dall’altra). L’incidenza di ipotensione grave correlata al farmaco è stata significativamente inferiore nel gruppo Zofenopril rispetto a Lisinopril (6,7% vs 9,8%; P<0,05). Sono poi stati valutati gli endpoint secondari relativi all’incidenza delle principali complicazioni cardiovascolari: mortalità cumulativa a 6 settimane, incidenza di insufficienza cardiaca grave, frazione di eiezione del ventricolo sinistro a 6 settimane, necessità di procedure di rivascolarizzazione di salvataggio, incidenza di angina pectoris, incidenza di re-infarto e proporzione di pazienti con deterioramento della funzione renale. I due ACE-inibitori non hanno mostrato differenze significative nell’incidenza di mortalità e delle principali complicazioni cardiovascolari. In conclusione, a parità di protezione cardiovascolare, Zofenopril ha dimostrato un rischio relativo inferiore di ipotensione grave nei pazienti con infarto miocardico.
- SMILE-ISCHEMIA (43): Zofenopril riduce il carico ischemico totale nei pazienti post-infarto con funzione ventricolare normale
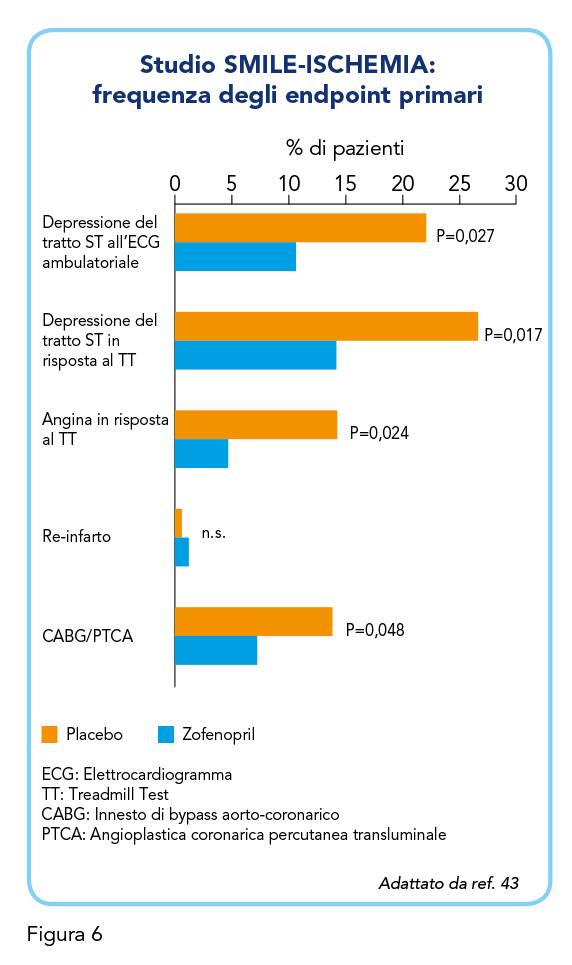
Il successivo studio SMILE-ISCHEMIA (1998-2001) è stato condotto per indagare gli effetti del trattamento con Zofenopril sull’entità del carico ischemico del miocardio in pazienti con funzione ventricolare sinistra intatta a seguito di infarto miocardico acuto. Questo studio, in doppio cieco e randomizzato, ha confrontato 177 pazienti assegnati al trattamento con Zofenopril e 172 assegnati al placebo. Al momento della randomizzazione, le caratteristiche demografiche e cliniche (e.g. gli esiti dell’ECG, il tempo trascorso dall’infarto miocardico acuto, la pressione sanguigna, la presenza di ipercolesterolemia) sono risultate comparabili tra i due gruppi. Quasi la metà dei pazienti reclutati, per ciascun gruppo, era iperteso. La dose iniziale del farmaco di studio era di 7,5 mg due volte al giorno, poi progressivamente raddoppiata fino alla dose finale di 30 mg due volte al giorno se la pressione sanguigna sistolica rimaneva maggiore a 100 mmHg e non vi erano segni o sintomi di ipotensione. La frequenza dell’endpoint primario, valutato come carico ischemico totale, è risultato del 20,3% nei pazienti trattati con Zofenopril contro i 35,9% nei pazienti con placebo (P=0,001), mostrando quindi un vantaggio significativo nell’utilizzo di Zofenopril. La Figura 6 mostra come gli eventi cardiovascolari principali, valutati singolarmente, siano risultati meno frequenti nel gruppo Zofenopril rispetto al gruppo placebo. Inoltre, tra i pazienti trattati con Zofenopril, una percentuale significativamente inferiore rispetto al gruppo placebo ha presentato alterazioni ischemiche dell’ECG (10,6% vs 19,7%), dolore anginoso (3,3% vs 9,9%) o aritmie significative (2,7% vs 7,2%). La frequenza di effetti avversi con Zofenopril è risultata comparabile a quella del placebo, mentre la percentuale totale di eventi gravi (morte, sviluppo o peggioramento di insufficienza cardiaca congestizia, ipotensione severa, pressione alta) è stata di 4,5% nel gruppo Zofenopril contro il 12,7% nel gruppo placebo.
I risultati dello studio SMILE-ISCHEMIA hanno mostrato che un trattamento di breve durata con Zofenopril in pazienti con infarto miocardico recente e con funzione ventricolare conservata ha ridotto il carico ischemico globale del 44% e gli esiti combinati del 65%. Questi risultati sono in linea con quelli ottenuti nello studio SMILE-1.
- SMILE-4 (19,44,45): Zofenopril+ASA riduce il rischio di eventi cardiovascolari maggiori rispetto a Ramipril+ASA nei pazienti post-infarto con disfunzione ventricolare sinistra
Lo studio SMILE-4 (2005-2009) è uno studio di fase III, randomizzato in doppio cieco, multicentrico e a gruppi paralleli che ha confrontato gli esiti cardiovascolari in seguito al trattamento con Zofenopril+ASA (n=389) vs Ramipril+ASA (n=382) in pazienti post-infarto con disfunzione ventricolare sinistra. Il gruppo assegnato a Zofenopril ha mostrato una riduzione del 30% del rischio di outcome cardiovascolare grave (i.e. mortalità e ospedalizzazione per cause cardiovascolari) rispetto al gruppo trattato con Ramipril. Il follow-up a lungo termine ha mostrato il perdurare di un miglior effetto cardioprotettivo del trattamento precoce con Zofenopril per molti anni (44,45).
La somministrazione di una terapia standard come ASA, in aggiunta a Zofenopril, può risultare appropriata e benefica in pazienti che hanno subito infarto del miocardio acuto. Infatti, sebbene ASA interagisca con la via delle prostaglandine attivata dalla bradichinina, gli ACE-inibitori con gruppo sulfidrilico mantengono i loro benefici cardiovascolari (19,20). L’azione protettiva determinata dalla presenza del gruppo sulfidrilico potrebbe quindi avere un effetto compensatorio nei riguardi di questa interazione.
- Analisi complessiva degli studi SMILE (46): Zofenopril ha un effetto cardioprotettivo nei pazienti post-infarto miocardico
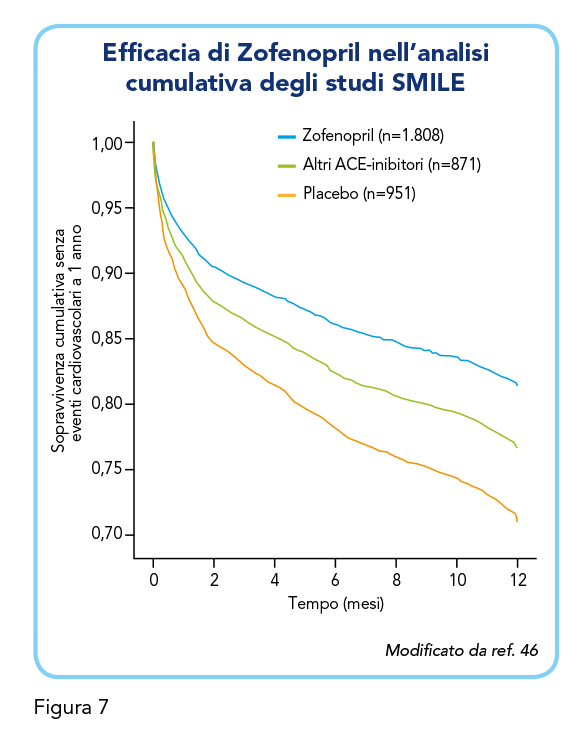
Gli autori degli studi SMILE hanno poi effettuato un’analisi dell’efficacia cumulativa di Zofenopril (2015) di tutti i dati individuali dei singoli studi SMILE sopraelencati, per un totale di 3.630 pazienti con infarto miocardico acuto. L’insorgenza complessiva di esiti cardiovascolari maggiori è risultata ridotta significativamente del 40% nel trattamento con Zofenopril rispetto al placebo e del 23% rispetto ad altri ACE-inibitori a 1 anno dall’inizio del trattamento (Figura 7). Rispetto al placebo, il beneficio di Zofenopril era già evidente a 6 settimane, con una riduzione del 28% del rischio di morte e/o ospedalizzazione per cause cardiovascolari.
Conclusioni
Zofenopril è un farmaco ACE-inibitore che agisce sul SRAA attraverso l’inibizione dell’enzima ACE, responsabile della conversione di angiotensina I in angiotensina II. A questa sua attività consegue una riduzione della pressione e un effetto vasodilatatorio e di protezione cardiovascolare indotti da una ridotta attività dell’angiotensina II e di altre cascate ormonali più a valle, quali il rilascio di aldosterone. Grazie anche alla presenza del gruppo sulfidrilico, Zofenopril possiede alcune peculiarità tra cui si annoverano un’elevata lipofilia, un alto grado di penetrazione tissutale, una maggiore affinità per l’ACE tissutale e un legame di lunga durata con esso e, infine, un significativo effetto antiossidante e vasculoprotettivo (13,14).
Zofenopril è indicato nel trattamento dell’ipertensione essenziale da lieve a moderata e nei pazienti che hanno subito di recente infarto miocardico acuto. Gli ACE-inibitori sono tra i farmaci più utilizzati in questi contesti e la loro efficacia e sicurezza sono ben documentate. Zofenopril può essere utilizzato in concomitanza ad altri farmaci quali altri antipertensivi, ASA e diuretici per produrre un effetto benefico sinergico per le popolazioni a più alto rischio o più resistenti alla terapia antipertensiva, migliorando inoltre la compliance al trattamento. Si richiede cautela di utilizzo in alcune popolazioni speciali che possono essere più soggette agli effetti avversi tipicamente associati agli ACE-inibitori. L’efficacia cardioprotettiva di Zofenopril è supportata dalle evidenze della serie di studi SMILE che nelle ultime due decadi hanno solidificato le basi per l’utilizzo di questo farmaco nei pazienti con recente infarto miocardico acuto.
Bibliografia
- Ames MK, Atkins CE, Pitt B. The renin-angiotensin-aldosterone system and its suppression. J Vet Intern Med. 2019 Mar;33(2):363–82.
- Patel S, Rauf A, Khan H, Abu-Izneid T. Renin-angiotensin-aldosterone (RAAS): The ubiquitous system for homeostasis and pathologies. Biomed Pharmacother. 2017 Oct;94:317–25.
- Laurent S. Antihypertensive drugs. Pharmacol Res. 2017 Oct;124:116–25.
- Ram CVS. Angiotensin receptor blockers: current status and future prospects. Am J Med. 2008 Aug;121(8):656–63.
- Borghi C, Rossi F, Trimarco B. Ruolo del sistema renina-angiotensina- aldosterone e dei farmaci che inibiscono tale sistema nelle malattie cardiovascolari: complessità e criticità. :29.
- Piepho RW. Overview of the angiotensin-converting-enzyme inhibitors. American Journal of Health-System Pharmacy. 2000 Oct 1;57(suppl_1):S3–7.
- Dzau VJ. Mechanism of action of angiotensin-converting enzyme (ACE) inhibitors in hypertension and heart failure. Role of plasma versus tissue ACE. Drugs. 1990;39 Suppl 2:11–6.
- Herman LL, Padala SA, Ahmed I, Bashir K. Angiotensin Converting Enzyme Inhibitors (ACEI). In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 [cited 2022 Jul 6]. Available from: http://www.ncbi.nlm.nih.gov/books/NBK431051/
- Petrie MC, Padmanabhan N, McDonald JE, Hillier C, Connell JM, McMurray JJ. Angiotensin converting enzyme (ACE) and non-ACE dependent angiotensin II generation in resistance arteries from patients with heart failure and coronary heart disease. J Am Coll Cardiol. 2001 Mar 15;37(4):1056–61.
- Tropeano AI, Boutouyrie P, Pannier B, Joannides R, Balkestein E, Katsahian S, et al. Brachial pressure-independent reduction in carotid stiffness after long-term angiotensin-converting enzyme inhibition in diabetic hypertensives. Hypertension. 2006 Jul;48(1):80–6.
- Agabiti-Rosei E, Heagerty AM, Rizzoni D. Effects of antihypertensive treatment on small artery remodelling. J Hypertens. 2009 Jun;27(6):1107–14.
- Lewis EJ, Hunsicker LG, Bain RP, Rohde RD. The effect of angiotensin-converting-enzyme inhibition on diabetic nephropathy. The Collaborative Study Group. N Engl J Med. 1993 Nov 11;329(20):1456–62.
- Borghi C, Omboni S. Angiotensin-Converting Enzyme Inhibition: Beyond Blood Pressure Control-The Role of Zofenopril. Adv Ther. 2020 Oct;37(10):4068–85.
- Borghi C, Ambrosio G, Van De Borne P, Mancia G. Zofenopril: Blood pressure control and cardio-protection. Cardiol J. 2022;29(2):305–18.
- Chopra M, Beswick H, Clapperton M, Dargie HJ, Smith WE, McMurray J. Antioxidant effects of angiotensin-converting enzyme (ACE) inhibitors: free radical and oxidant scavenging are sulfhydryl dependent, but lipid peroxidation is inhibited by both sulfhydryl- and nonsulfhydryl-containing ACE inhibitors. J Cardiovasc Pharmacol. 1992 Mar;19(3):330–40.
- Napoli C, Bruzzese G, Ignarro LJ, Crimi E, de Nigris F, Williams-Ignarro S, et al. Long-term treatment with sulfhydryl angiotensin-converting enzyme inhibition reduces carotid intima-media thickening and improves the nitric oxide/oxidative stress pathways in newly diagnosed patients with mild to moderate primary hypertension. Am Heart J. 2008 Dec;156(6):1154.e1-8.
- Ambrosioni E, Borghi C, Magnani B. The Effect of the Angiotensin-Converting–Enzyme Inhibitor Zofenopril on Mortality and Morbidity after Anterior Myocardial Infarction. N Engl J Med. 1995 Jan 12;332(2):80–5.
- Indications for ACE inhibitors in the early treatment of acute myocardial infarction: systematic overview of individual data from 100,000 patients in randomized trials. ACE Inhibitor Myocardial Infarction Collaborative Group. Circulation. 1998 Jun 9;97(22):2202–12.
- Borghi C, Ambrosioni E, Novo S, Vinereanu D, Ambrosio G, SMILE-4 Working Party. Comparison between zofenopril and ramipril in combination with acetylsalicylic acid in patients with left ventricular systolic dysfunction after acute myocardial infarction: results of a randomized, double-blind, parallel-group, multicenter, European study (SMILE-4). Clin Cardiol. 2012;35(7):416–23.
- Zhu B qing, Sievers RE, Browne AEM, Lee RJ, Chatterjee K, Grossman W, et al. Comparative effects of aspirin with ACE inhibitor or angiotensin receptor blocker on myocardial infarction and vascular function. J Renin Angiotensin Aldosterone Syst. 2003 Mar;4(1):31–7.
- Subissi A, Evangelista S, Giachetti A. Preclinical Profile of Zofenopril: An Angiotensin Converting Enzyme Inhibitor with Peculiar Cardioprotective Properties. Cardiovascular Drug Reviews. 1999;17(2):115–33.
- Donnarumma E, Ali MJ, Rushing AM, Scarborough AL, Bradley JM, Organ CL, et al. Zofenopril Protects Against Myocardial Ischemia–Reperfusion Injury by Increasing Nitric Oxide and Hydrogen Sulfide Bioavailability. Journal of the American Heart Association. 5(7):e003531.
- Brugts JJ, Arima H, Remme W, Bertrand M, Ferrari R, Fox K, et al. The incidence and clinical predictors of ACE-inhibitor induced dry cough by perindopril in 27,492 patients with vascular disease. Int J Cardiol. 2014 Oct 20;176(3):718–23.
- Omboni S, Borghi C. Zofenopril and incidence of cough: a review of published and unpublished data. Ther Clin Risk Manag. 2011;7:459–71.
- Malacco E, Castiglioni G, Corradi L, Cristofari M, Fogari R, Pisani A, et al. Dose-Response Relationship of Zofenopril in Essential Hypertension. Clin Drug Investig. 2002 Jan 1;22(1):9–15.
- Mallion JM. An evaluation of the initial and long-term antihypertensive efficacy of zofenopril compared with enalapril in mild to moderate hypertension. Blood Press Suppl. 2007 Oct;2:13–8.
- Malacco E, Piazza S, Omboni S, Zofenopril Study Group. Zofenopril versus Lisinopril in the Treatment of Essential Hypertension in Elderly Patients : A Randomised, Double-Blind, Multicentre Study. Clin Drug Investig. 2005;25(3):175–82.
- Nilsson P. Antihypertensive efficacy of zofenopril compared with atenolol in patients with mild to moderate hypertension. Blood Press Suppl. 2007 Oct;2:25–30.
- Leonetti G, Rappelli A, Omboni S, on Behalf of the Study Group. A similar 24‐h blood pressure control is obtained by zofenopril and candesartan in primary hypertensive patients. Blood Pressure. 2006 Jan 1;15(sup1):18–26.
- Narkiewicz K. Comparison of home and office blood pressure in hypertensive patients treated with zofenopril or losartan. Blood Press Suppl. 2007 Oct;2:7–12.
- Farsang C. Blood pressure control and response rates with zofenopril compared with amlodipine in hypertensive patients. Blood Press Suppl. 2007 Oct;2:19–24.
- Williams B, Mancia G, Spiering W, Agabiti Rosei E, Azizi M, Burnier M, et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension. J Hypertens. 2018 Oct;36(10):1953–2041.
- Omboni S, Malacco E, Parati G. Zofenopril Plus Hydrochlorothiazide Fixed Combination in the Treatment of Hypertension and Associated Clinical Conditions. Cardiovascular Therapeutics. 2009;27(4):275–88.
- Parati G, Omboni S, Malacco E, on Behalf of the Study Group. Antihypertensive efficacy of zofenopril and hydrochlorothiazide combination on ambulatory blood pressure. Blood Pressure. 2006 Jan 1;15(sup1):7–17.
- Malacco E, Omboni S. Antihypertensive effect of zofenopril plus hydrochlorothiazide versus zofenopril monotherapy in patients with essential hypertension according to their cardiovascular risk level: A post hoc analysis. Current Therapeutic Research. 2008 Jun 1;69(3):232–42.
- Ambrosioni E, Borghi C, Magnani B. Early treatment of acute myocardial infarction with angiotensin-converting enzyme inhibition: safety considerations. SMILE pilot study working party. Am J Cardiol. 1991 Nov 18;68(14):101D-110D.
- Borghi C, Bacchelli S, Esposti DD, Bignamini A, Magnani B, Ambrosioni E. Effects of the administration of an angiotensin-converting enzyme inhibitor during the acute phase of myocardial infarction in patients with arterial hypertension. SMILE Study Investigators. Survival of Myocardial Infarction Long-term Evaluation. Am J Hypertens. 1999 Jul;12(7):665–72.
- Borghi C, Bacchelli S, Esposti DD, Ambrosioni E, SMILE Study. Effects of the early ACE inhibition in diabetic nonthrombolyzed patients with anterior acute myocardial infarction. Diabetes Care. 2003 Jun;26(6):1862–8.
- Borghi C, Cicero AFG, Ambrosioni E. Effects of early treatment with zofenopril in patients with myocardial infarction and metabolic syndrome: the SMILE Study. Vasc Health Risk Manag. 2008;4(3):665–71.
- Borghi C, Bacchelli S, Esposti DD, Ambrosioni E. Effects of early angiotensin-converting enzyme inhibition in patients with non–ST-elevation acute anterior myocardial infarction. American Heart Journal. 2006 Sep 1;152(3):470–7.
- Borghi C, Cicero AFG, Bacchelli S, Esposti DD, Ambrosioni E, Survival of Myocardial Infarction Long-term Evaluation (SMILE) Study. Serum cholesterol levels on admission and survival in patients with acute myocardial infarction treated with zofenopril: a post hoc analysis of the Survival of Myocardial Infarction Long-term Evaluation trial. Fundam Clin Pharmacol. 2009 Oct;23(5):641–8.
- Borghi C, Ambrosioni E, Survival of Myocardial Infarction Long-term Evaluation-2 Working Party. Double-blind comparison between zofenopril and lisinopril in patients with acute myocardial infarction: results of the Survival of Myocardial Infarction Long-term Evaluation-2 (SMILE-2) study. Am Heart J. 2003 Jan;145(1):80–7.
- Borghi C, Ambrosioni E, Survival of Myocardial Infarction Long-term Evaluation Study Group. Effects of zofenopril on myocardial ischemia in post-myocardial infarction patients with preserved left ventricular function: the Survival of Myocardial Infarction Long-term Evaluation (SMILE)-ISCHEMIA study. Am Heart J. 2007 Mar;153(3):445.e7-14.
- Borghi C, Omboni S, Novo S, Vinereanu D, Ambrosio G, Ambrosioni E. Early Treatment With Zofenopril and Ramipril in Combination With Acetyl Salicylic Acid in Patients With Left Ventricular Systolic Dysfunction After Acute Myocardial Infarction: Results of a 5-Year Follow-up of Patients of the SMILE-4 Study. J Cardiovasc Pharmacol. 2017 May;69(5):298–304.
- Borghi C, Omboni S, Novo S, Vinereanu D, Ambrosio G, Ambrosioni E. Zofenopril and ramipril in patients with left ventricular systolic dysfunction after acute myocardial infarction: A propensity analysis of the Survival of Myocardial Infarction Long-term Evaluation (SMILE) 4 study. J Renin Angiotensin Aldosterone Syst. 2016 Oct 5;17(4):1470320316656480.
- Borghi C, Omboni S, Reggiardo G, Bacchelli S, Degli Esposti D, Ambrosioni E. Cardioprotective role of zofenopril in patients with acute myocardial infarction: a pooled individual data analysis of four randomised, double-blind, controlled, prospective studies. Open Heart. 2015 Sep 8;2(1):e000220.
- Sistema Renina-Angiotensina-Aldosterone (SRAA) e ipertensione
Il Sistema Renina-Angiotensina-Aldosterone (SRAA) è un meccanismo ormonale di vitale importanza per la regolazione della pressione sanguigna e l’omeostasi idroelettrolitica. Il sistema viene innescato dalla secrezione dell’enzima renina, prodotto dai reni in risposta a stimoli quali ridotta pressione sanguigna, ipovolemia o scarsità di sodio (1). Al suo rilascio, consegue una reazione a catena che conduce alla produzione di angiotensina II ad opera dell’enzima di conversione dell’angiotensina (ACE), presente nelle cellule endoteliali di piccoli e grandi vasi. Angiotensina II è un potente vasocostrittore, attiva il sistema simpatico e stimola la secrezione surrenalica di aldosterone con conseguente ritenzione di sodio (1). L’angiotensina II può essere sia circolante che tissutale ed è responsabile dell’aumento della pressione sanguigna attraverso l’attivazione del suo recettore di tipo 1 (AT1) (3). ACE non è l’unico enzima che media la produzione di angiotensina II: anche il complesso enzimatico CAGE (enzima generante angiotensina II chemiostatico-sensibile), la chimasi e la catepsina G possono convertire angiotensina I in angiotensina II (4,5). Fondamentale è anche l’azione dell’aldosterone, ormone terminale del SRAA, che regola l’equilibrio dei liquidi corporei e di vari elettroliti, tra cui sodio e potassio (1). Il SRAA regola dunque la pressione sanguigna, mantiene la tonicità vascolare e l’omeostasi idroelettrolitica corporea fondamentale per un corretto funzionamento di cuore e reni, senza rispettivi sovraccarichi (2). Tuttavia, la sua attivazione cronica, in molteplici patologie, comporta svariati effetti negativi, soprattutto a livello cardiovascolare.
L’iperattivazione del SRAA ha un’azione fortemente vasocostrittiva, ipertrofica, pro-fibrotica e pro-infiammatoria, a livello della muscolatura liscia, e conduce all’ipertensione sistemica e al rimodellamento dei tessuti cardiovascolari e renali. Inoltre favorisce l’insorgenza e la progressione del danno cardiovascolare in patologie quali ipertensione, infarto miocardico acuto e insufficienza cardiaca cronica. L’attivazione cronica del SRAA è anche coinvolta nello sviluppo di malattie renali croniche, complicazioni epatiche (alimentate dall’azione pro-infiammatoria), obesità (per l’azione sugli adipociti), diabete e disturbi del sistema nervoso (2). Di fatto, la disregolazione del SRAA alimenta il rischio cardiovascolare e di danno d’organo a cui conseguono eventi clinici anche fatali. Per questa ragione, sono molti i farmaci ideati per agire sull’iperattivazione del SRAA: gli ACE-inibitori impediscono la conversione di angiotensina I in angiotensina II; i sartani bloccano il legame dell’angiotensina II al suo recettore AT1; e, infine, gli antagonisti dei recettori dei mineralcorticoidi agiscono a valle, frenando le conseguenze dell’azione dell’aldosterone.
- Farmaci antipertensivi: gli ACE-inibitori
Il primo farmaco ACE-inibitore messo in commercio per il trattamento dell’ipertensione è stato captopril, nel 1980, seguito rapidamente da numerosi altri quali enalapril, perindopril, lisinopril, ramipril, quinapril, benazepril, cilazapril, trandolapril, fosinopril, moexipril, imidapril e zofenopril (3). Tutte queste sono molecole analoghe alla 2-metilpropionil-L-prolina (6). Il target molecolare di questa classe di medicinali è l’enzima ACE, responsabile della conversione da angiotensina I ad angiotensina II. ACE è una zinco-metalloproteinasi, generalmente ancorata alla membrana cellulare – solo una piccola parte viene rilasciata in circolo – e localizzata in vari tessuti i cui principali sono l’endotelio, di piccoli e grandi vasi, e i tessuti polmonari (3,7).
Dato il suo strategico posizionamento, ACE regola la quantità di angiotensina II circolante, la quale ha un ruolo di potente vasocostrittore. Di conseguenza, gli ACE-inibitori attuano un significativo effetto vasodilatatore che riduce la resistenza anche di piccole arteriole. La riduzione di angiotensina II aumenta la natriuresi, abbassa la pressione sanguigna e previene il rimodellamento del muscolo liscio e dei miociti cardiaci; ne consegue una riduzione della pressione arteriosa e venosa che riduce il pre- e il post-carico del cuore (8). La gittata e il battito cardiaco rimangono invariati e non viene riportata ipotensione posturale. Inoltre, gli ACE-inibitori interferiscono con la degradazione della bradichinina ossia un peptide, anch’esso substrato di ACE, che induce la vasodilatazione stimolando il rilascio di ossido nitrico (3,6).
Le caratteristiche farmacocinetiche e farmacodinamiche di ciascun ACE-inibitore dipendono dalla loro specifica affinità, potenza, lipofilia e ritenzione da parte dei tessuti che esprimono ACE; tali fattori ne determinano il perdurare dell’inibizione. Sebbene gli ACE-inibitori non agiscano sulla produzione di angiotensina II che si verifica per vie enzimatiche alternative – le quali potrebbero attenuare l’effetto antipertensivo nel lungo termine (9) –, questa classe di farmaci dimostra un adeguato controllo pressorio per mesi o anni. Tale effetto sembra essere dovuto alla mancata degradazione di peptidi vasodilatatori, tra cui la bradichinina (3).
L’efficacia terapeutica antipertensiva degli ACE-inibitori riduce il rischio di quelle problematiche cardiovascolari e coronariche tipicamente associate ad elevati valori di pressione sanguigna (8). La loro azione correla con una riduzione dell’ipertrofia ventricolare sinistra, una riduzione dell’irrigidimento di piccole e grandi arterie e un miglioramento della funzione endoteliale (10,11). Inoltre, alcuni ACE-inibitori sembrano esercitare un effetto nefroprotettivo nei pazienti con nefropatia diabetica, grazie all’efficace riduzione della pressione sanguigna (3,12).
- Zofenopril
3.1. Indicazioni e posologia
Zofenopril è un farmaco ACE-inibitore indicato per il trattamento dell’ipertensione essenziale in forma lieve e moderata, con solide evidenze di efficacia e sicurezza. Inoltre, i dati raccolti nel contesto degli studi SMILE hanno mostrato che l’impiego di questo ACE-inibitore può essere esteso anche al di là del controllo pressorio (13). Zofenopril è infatti indicato nel trattamento, iniziato entro le prime 24 ore, di pazienti che hanno subito un infarto miocardico acuto, con o senza sintomi di scompenso, emodinamicamente stabili e che non sono stati sottoposti a terapia con trombolitici. Zofenopril riduce il rischio di eventi cardiovascolari maggiori e la sua efficacia cardioprotettiva dipende anche dalla peculiare struttura chimica contenente un gruppo sulfidrilico (Figura 1) che conferisce una potente azione antiossidante, protettiva per l’endotelio e atta a rallentare il progredire dell’aterosclerosi (13-16).
Nei pazienti ipertesi, Zofenopril viene titolato a dosi crescenti a partire da 15 mg una volta al giorno a intervalli di 4 settimane. Il dosaggio va aggiustato in base alla risposta pressoria e risulta solitamente efficace alla dose di 30 mg, sempre una volta al giorno. La dose massima giornaliera che può essere raggiunta è di 60 mg, somministrabile singolarmente o in due dosi da 30 mg. Qualora non si raggiungesse il target pressorio, possono essere aggiunti altri farmaci antipertensivi (e.g. diuretici). Una combinazione dalla comprovata efficacia è quella con Idroclorotiazide, diuretico dal meccanismo d’azione complementare e con scarsa o nessuna interferenza sulla biodisponibilità reciproca.
I pazienti ipertesi con compromissione renale possono essere più suscettibili ad alcuni degli effetti avversi degli ACE-inibitori (e.g. ipotensione, iperkaliemia, neutropenia) (6,8): se la clearance di creatinina risulta > 45 mL/min, non sono richiesti aggiustamenti posologici; se si dovesse scendere al di sotto di questa soglia, la dose terapeutica di Zofenopril va dimezzata, senza modificare il regime posologico di una volta al giorno. Questo stesso procedimento di valutazione, somministrazione della terapia e cautele speciali va attuato anche nel caso di pazienti anziani. Se un paziente adulto presenta un danno renale grave ed è sottoposto a dialisi, il regime posologico diventa un quarto di quello del paziente con funzionalità renale normale. Nel caso di compromissione epatica lieve e moderata, è previsto un dimezzamento della dose normale mentre, in presenza di insufficienza epatica, Zofenopril è controindicato. Infine, efficacia e sicurezza di questo farmaco non sono state stabilite al di sotto dei 18 anni, popolazione che, pertanto, non va trattata con Zofenopril.
L’efficacia cardioprotettiva e di prevenzione degli eventi cardiovascolari maggiori di Zofenopril nei pazienti con infarto miocardico post-acuto è stata dimostrata nei quattro studi randomizzati e controllati del programma SMILE che hanno coinvolto oltre 3.600 pazienti (13). La presenza di un gruppo sulfidrilico nella struttura chimica di Zofenopril contribuisce a tali proprietà cardioprotettive e conferisce un elevato potere antiossidante che lo contraddistingue dalla maggior parte degli ACE-inibitori. Nei pazienti che hanno subito recente infarto miocardico, il trattamento con Zofenopril deve iniziare entro 24 ore dall’evento e perdurare per almeno 6 settimane (17). Numerosi studi hanno mostrato una riduzione del rischio di mortalità e morbilità quando gli ACE-inibitori vengono somministrati nella fase acuta dell’infarto miocardico (13). Secondo un’ampia meta-analisi effettuata sui dati di circa 100.000 pazienti trattati con ACE-inibitori nelle prime 24 ore dall’evento di post-infarto miocardico (18), i benefici di questo intervento precoce sono presumibilmente dovuti a un ruolo positivo del rimodellamento tissutale e sono proporzionalmente maggiori nei sottogruppi a rischio più elevato (13,18). Tali benefici sono inoltre complementari a quelli osservati successivamente negli studi di terapia prolungata con ACE-inibitori iniziata diversi giorni o settimane dopo l’infarto in pazienti con evidenza di insufficienza cardiaca o disfunzione ventricolare sinistra (13,18). La titolazione di Zofenopril in questa tipologia di pazienti prevede una dose iniziale di 7,5 mg ogni 12 ore (1° e 2° giorno) che va poi aumentata a 15 mg ogni 12 ore (3° e 4° giorno) e, infine, aumentata ancora a 30 mg ogni 12 ore (dal 5° giorno in poi). Eccezione a questa titolazione è il caso in cui si manifesti bassa pressione sistolica (≤ 120 mmHg) all’inizio del trattamento o nei primi 3 giorni successivi all’infarto: in questo caso la dose non va aumentata. Se la pressione sistolica dovesse risultare ≤ 100 mmHg (ipotensione), si può proseguire il trattamento con l’ultima dose tollerata; se invece questa dovesse scendere sotto i 90 mmHg per due misurazioni consecutive a meno di 1 ora di distanza, la terapia con Zofenopril va interrotta. Trascorse 6 settimane, la condizione del paziente va rivalutata e il farmaco deve essere sospeso nei casi in cui non vi siano più segni di disfunzione ventricolare o scompenso. La terapia con Zofenopril non è indicata nei pazienti con infarto miocardico che presentano compromissione epatica o renale o sono sottoposti a dialisi. Zofenopril va inoltre utilizzato con cautela nei pazienti con infarto al di sopra dei 75 anni. Qualora considerato appropriato, è possibile somministrare al paziente che ha subito infarto miocardico acuto altre terapie standard, tra cui l’acido acetilsalicilico (ASA). Gli ACE-inibitori sulfidrilici come Zofenopril mantengono i loro benefici cardiovascolari anche in presenza di inibitori della cicloossigenasi quali ASA (19,20). Inoltre, lo studio SMILE-4 ha dimostrato che la combinazione Zofenopril+ASA conferisce una migliore protezione cardiovascolare rispetto all’associazione di ASA con Ramipril (19).
3.2. Meccanismo d’azione
Zofenopril è un ACE-inibitore sulfidrilico caratterizzato da elevata lipofilia, da un alto grado di penetrazione tissutale di lunga durata, da un’inibizione selettiva dell’ACE del tessuto cardiaco e da una potente attività antiossidante (21). La presenza del gruppo sulfidrilico conferisce un’elevata affinità allo zinco situato nel sito di legame di ACE (13). Somministrato alle dosi di 30 mg e 60 mg, Zofenopril riduce l’attività plasmatica di ACE del 53,4% e del 74,4%, rispettivamente. Attraverso l’inibizione di questo enzima chiave del SRAA, Zofenopril riduce la produzione di angiotensina II e aumenta i livelli di bradichinina (Figura 2). Per quanto riguarda l’angiotensina II, una molecola dalle note proprietà vasocostrittrici e di ritenzione salina, la sua diminuzione comporta un aumento della natriuresi, una riduzione della pressione sanguigna e previene il rimodellamento della muscolatura liscia e dei miociti cardiaci, con conseguenti benefici cardiovascolari (8). Parallelamente, Zofenopril inibisce la degradazione della bradichinina (mediatore del sistema callicreina-chinina) che, aumentando in concentrazione, stimola i recettori B2 (recettori della bradichinina di tipo 2) espressi a livello endoteliale e della muscolatura liscia. Questo meccanismo favorisce il secondario rilascio di mediatori vasodilatatori tra cui ossido nitrico (NO), prostaglandine e fattore iperpolarizzante di derivazione endoteliale (13), contribuendo così al beneficio endoteliale e all’effetto antipertensivo.
In studi preclinici e clinici, Zofenopril ha dimostrato di esercitare un’azione vasculoprotettiva e cardioprotettiva indipendente dai suoi potenti effetti di riduzione della pressione arteriosa attraverso il blocco dello SRAA (22). Zofenopril agisce da donatore di idrogeno solforato (H2S), una molecola di segnalazione citoprotettiva che, in cooperazione con NO, mantiene l’omeostasi fisiologica sia nel cuore che nella circolazione e protegge dalle lesioni da ischemia-riperfusione miocardica (13,22). L’aumentata biodisponibilità di H2S determinata da Zofenopril attiva l’enzima eNOS (ossido nitrico sintasi endoteliale) favorendo ulteriormente il rilascio di NO a livello endoteliale. Zofenopril contribuisce anche all’aumentata espressione di enzimi antiossidanti quali Trx-1, GPx-1 e SOD-1 (13,22). Globalmente, questo meccanismo potenzia la difesa antiossidante del tessuto e previene la formazione di specie reattive dell’ossigeno in seguito alla lesione ischemica, proteggendo di conseguenza l’endotelio da possibili danni. Invero, una peculiarità dimostrata da Zofenopril è quella di rallentare il progredire dell’aterosclerosi, come dimostrato in uno studio clinico randomizzato su 48 pazienti con ipertensione da lieve a moderata (16). Si è osservata una minore progressione dell’ispessimento dell’intima media carotidea fino a 5 anni nel gruppo trattato con Zofenopril rispetto a un altro ACE-inibitore, Enalapril, accompagnata da un miglioramento dei marker plasmatici di NO/stress ossidativo (16).
3.3. Farmacocinetica
Zofenopril è una molecola altamente lipofilica, caratteristica che determina diverse delle sue proprietà farmacocinetiche come l’assorbimento orale, un grado apprezzabile di escrezione biliare e, probabilmente più importante, una maggiore penetrazione nei tessuti (21). Viene somministrato per via orale in forma di profarmaco come Zofenopril calcio, e la sua AUC non varia significativamente in seguito ad assunzione concomitante di cibo. L’assorbimento è rapido e completo, come anche la successiva conversione in zofenoprilato, il composto sulfidrile libero derivato dall’idrolisi del tio-estere. Il picco della concentrazione ematica viene raggiunto dopo 1,5 ore da un’assunzione orale singola, con cinetica lineare e senza accumulo anche a seguito di 3 settimane di somministrazione giornaliera di 15-60 mg. Il volume di distribuzione è di 96 litri allo steady-state e il legame alle proteine plasmatiche è pari all’88%. Lo zofenoprilato è il principale sottoprodotto del metabolismo di Zofenopril calcio (22%), assieme ad altri sette metaboliti; la sua emivita corrisponde a 5,5 ore e la sua cleareance in tutto l’organismo è di 1.300 mL/min. Sia Zofenopril calcio che zofenoprilato subiscono eliminazione per doppia via (biliare e renale): nel caso del profarmaco questa corrisponde rispettivamente al 69% tramite feci e al 26% tramite urine; nel caso del metabolita attivo è, invece, il 76% tramite feci e il 16% tramite urine.
3.4. Sicurezza e tollerabilità
Gli ACE-inibitori sono tra i medicinali più utilizzati nel trattamento dell’ipertensione e del post-infarto miocardico e il loro utilizzo ha mostrato comprovate evidenze di sicurezza e tollerabilità. Zofenopril è ben tollerato anche a dosi elevate (8), ma richiede specifiche cautele nei pazienti con deplezione di liquidi ed elettroliti, scompenso cardiaco o compromissione renale, poiché può condurre a ipotensione sintomatica (si veda la posologia in RCP). Gli effetti avversi più comuni sono: capogiri, cefalea, nausea/vomito, stanchezza e tosse secca. Quest’ultima, in particolare, è il motivo più frequente di interruzione del trattamento con ACE-inibitori, con un’incidenza stimata che arriva fino al 10% dei pazienti trattati (23,24). Zofenopril, tuttavia, ha mostrato un’incidenza relativamente bassa di tosse secca persistente con una frequenza del 2,4% secondo la revisione di dati individuali, sia pubblicati che inediti, provenienti da studi randomizzati in doppio cieco e da studi post-marketing, per un totale di circa 6.000 pazienti ipertesi (24). La tosse correlata all’impiego di Zofenopril, comunque, era generalmente di intensità lieve o moderata e tendeva a verificarsi più spesso solo all’inizio del trattamento, nei primi 6 mesi (24). La combinazione con Idroclorotiazide non sembrava aumentare significativamente la possibilità di tosse nei pazienti trattati con Zofenopril, con un’incidenza osservata pari al 3,0% (24). Infine, l’incidenza complessiva di tosse osservata in studi randomizzati in doppio cieco sull’impego di Zofenopril nel trattamento di pazienti post-infarto miocardico (n=1.455) è risultata pari al 3,6% (24), confermandosi un farmaco ben tollerato anche in questa categoria di pazienti. Globalmente, una ridotta incidenza di tosse può migliorare la compliance del paziente alla terapia antipertensiva.
Zofenopril è controindicato nei casi di: 1) ipersensibilità al farmaco, agli eccipienti o a qualsiasi altro ACE-inibitore; 2) familiarità o episodi pregressi di edema angioneurotico; 3) grave compromissione epatica; 4) secondo e terzo semestre di gravidanza; 5) stenosi bilaterale dell’arteria renale (o unilaterale in caso di rene singolo); 6) utilizzo concomitante con Aliskiren nei pazienti con diabete mellito o compromissione renale (velocità di filtrazione glomerulare < 60 mL/min/1,73 m2) o parallelamente a Sacubritil/Valsartan (anche a meno di 36 ore dall’ultima dose).
Alcuni pazienti trattati con ACE-inibitori hanno manifestato angioedema come reazione da ipersensibilità. È una reazione avversa rara che può avvenire principalmente nelle prime settimane di trattamento e spiegabile da un aumento delle concentrazioni di bradichinina e da un possibile aumento delle concentrazioni di altri peptidi, come la sostanza P (3).
Zofenopril inibisce il rilascio dell’aldosterone (6) e può dunque influire sui livelli di potassio, sebbene questo rimanga generalmente entro i valori sicuri. Pertanto si sconsiglia l’utilizzo concomitante di Zofenopril con agenti che aumentano il potassio sierico in presenza di grave compromissione renale o di diabete (3).
In alcune categorie sensibili di pazienti (con problematiche renali, collagenopatie vascolari, in trattamento con immunosoppressivi) sono stati riscontrati casi di trombocitopenia/agranulocitosi/neutropenia o anemia; si consiglia dunque un frequente monitoraggio della conta dei globuli bianchi e della conta ematica.
L’utilizzo concomitante di Zofenopril e altri farmaci antipertensivi (e.g. calcio-antagonisti, alfa- o beta-bloccanti) deve essere condotto con cautela per tenere sotto controllo possibili effetti antipertensivi additivi o di potenziamento. Inoltre, Zofenopril può essere utilizzato in concomitanza con terapie standard quali ASA (come indicato in RCP). Zofenopril sembra infatti mantenere le sua proprietà di protezione cardiovascolare anche in presenza di inibitori della cicloossigenasi (19). Infine, l’utilizzo concomitante con FANS (Farmaci Antinfiammatori Non Steroidei) può ridurre l’effetto antipertensivo degli ACE-inibitori.
3.5 Studi sull’efficacia antipertensiva di Zofenopril
Svariati studi hanno caratterizzato la capacità di Zofenopril di ridurre la pressione arteriosa. In termini di dosaggio, uno di questi studi (25) ha valutato l’efficacia antipertensiva e la sicurezza di Zofenopril tra i 7,5 e i 60 mg (dose massima indicata in RCP). Sono stati reclutati 211 pazienti con pressione diastolica compresa tra i 95 e i 110 mmHg e, dopo 2 settimane di placebo, 43 pazienti hanno iniziato a ricevere Zofenopril alla dose di 7,5 mg, 39 alla dose di 15 mg, 44 alla dose di 30 mg, 42 alla dose di 60 mg e 43 hanno ricevuto il placebo (si ricorda, ai fini dell’applicazione clinica, di seguire la titolazione prevista dall’RCP del farmaco). Nel gruppo trattato con Zofenopril, la pressione diastolica media è diminuita nelle 24 ore secondo un andamento dose-dipendente e con un effetto più pronunciato durante il giorno rispetto alla notte (Figura 3). Una significativa riduzione della pressione diastolica diurna e notturna è stata ottenuta con zofenopril 60 mg. Le dosi che hanno indotto un maggiore effetto antipertensivo sono state quelle di 30 mg e di 60 mg, rispettivamente con il 54,3% e il 69,4% dei pazienti in cui la pressione diastolica si è normalizzata. Infine, le analisi laboratoriali non hanno evidenziato alcun problema di sicurezza del farmaco.
In seguito, altri studi hanno confrontato Zofenopril con altri farmaci antipertensivi di comune utilizzo quali altri ACE-inibitori, sartani, beta-bloccanti o calcio-antagonisti. Rispetto a Enalapril, Zofenopril ha mostrato un effetto antipertensivo più pronunciato durante le prime 4 settimane di trattamento in pazienti con ipertensione da lieve a moderata (26). Questa differenza si è annullata nelle settimane successive anche grazie alla possibilità, prevista dal disegno di studio, di aumentare il dosaggio da 30 a 60 mg/die per Zofenopril, e da 20 a 40 mg/die per Enalapril. Questo raddoppiamento della dose è stato necessario in una maggiore proporzione di pazienti del gruppo Enalapril, rispetto al gruppo Zofenopril. La frequenza di effetti collaterali è risultata anch’essa comparabile, anche se la gravità degli eventi avversi era significativamente più lieve con Zofenopril. Inoltre, Zofenopril eguaglia l’efficacia antipertensiva di Lisinopril, un ulteriore ACE-inibitore, nei pazienti anziani (27). Rispetto, invece, ad Atenololo (beta-bloccante), oltre che essere più rapido in efficacia, Zofenopril risulta anche meglio tollerato (28). In questo studio, sono stati reclutati 304 pazienti di mezza età o anziani con ipertensione lieve o moderata. Dopo 4 settimane, la riduzione della pressione sanguigna è risultata significativamente maggiore con Zofenopril 30 mg/die rispetto ad Atenololo 50 mg/die (sistolica/diastolica: -15,6/-13,5 mmHg vs. -13,1/-11,8 mmHg). A seguito della possibilità di raddoppiare il dosaggio, gli esiti a 12 settimane sono risultati comparabili tra i due farmaci, anche se una maggiore percentuale di pazienti del gruppo Zofenopril ha raggiunto valori di pressione diastolica da seduti < 90 mmHg. In termini di tollerabilità, Zofenopril ha dimostrato un profilo migliore, con solo 14 individui con effetti avversi segnalati (9,1%) contro i 30 del gruppo Atenololo (20,8%).
Confrontando Zofenopril con diversi rappresentanti della classe dei sartani, questo ha mostrato di eguagliare Candesartan in entità e andamento della riduzione della pressione nei pazienti ipertesi nelle 24 ore (29) e di superare Losartan in efficacia durante il primo mese di trattamento (30). Per quest’ultimo studio sono stati arruolati 375 pazienti con ipertensione lieve o moderata. Sebbene l’entità di riduzione della pressione sanguigna, misurata presso uno studio clinico o in forma domiciliare, fosse equivalente a 12 settimane e a 3 mesi (con pari tollerabilità al trattamento), Zofenopril si è mostrato più efficace nel raggiungere livelli pressori inferiori durante il primo mese dello studio. Inoltre, la percentuale di pazienti ad aver necessitato un aumento della dose (da 30 a 60 mg per Zofenopril e da 50 a 100 mg per Losartan) era minore nel gruppo Zofenopril (33,1% vs 42,1%).
In ultimo, Zofenopril ha mostrato proprietà antipertensive pari a quelle di Amlodipina, farmaco calcio-antagonista (31). Lo studio in questione ha valutato, ad intervalli di 2 settimane, i valori pressori di 303 pazienti con ipertensione da lieve a moderata. Entrambi i farmaci hanno ridotto ad andamento comparabile la pressione sia sistolica che diastolica, fino a ridurla di almeno 10 mmHg a 12 settimane di trattamento.
3.6 Studi sull’associazione di Zofenopril a un diuretico (Idroclorotiazide)
Una problematica diffusa riguarda quei pazienti che, in trattamento monoterapico per l’ipertensione, non riescono a raggiungere valori pressori target. Di conseguenza, le linee guida ESC/ESH del 2018 consigliano, tra le varie possibili, la combinazione di un ACE-inibitore con un diuretico (32). I due farmaci hanno un effetto sinergico sul SRAA inibendo la produzione di angiotensina II, a monte, e sulla ritenzione di sodio e acqua da parte dei reni, a valle. La somministrazione concomitante di Zofenopril e Idroclorotiazide è un’associazione fissa e approvata in diversi paesi europei per la gestione dell’ipertensione da lieve a moderata (33). L’efficacia e la sicurezza di questa combinazione sono state testate in vari studi clinici; ne è un esempio l’indagine in cui sono stati confrontati gli effetti sulla pressione arteriosa di un trattamento randomizzato in doppio cieco di 12 settimane con Zofenopril (15, 30 o 60 mg) o Idroclorotiazide (12,5 o 25 mg) con quelli delle loro combinazioni (34). La riduzione della pressione sanguigna indotta dal trattamento combinato è risultata maggiore rispetto all’impiego dei due farmaci singoli, senza comportare una variazione nella manifestazione di effetti avversi che sono risultati perlopiù di lieve intensità. Questo studio ha inoltre dimostrato che la combinazione Zofenopril+Idroclorotiazide svolge un controllo pressorio regolare e omogeneo, come si è potuto osservare monitorando l’indice di variazione della pressione arteriosa nelle 24 ore (33,34). Si ricorda al lettore di applicare sempre dosaggi e posologia come da indicazione in RCP.
Una strategia a due farmaci ad azione sinergica può rivelarsi estremamente utile in quei pazienti che esibiscono uno o più fattori di alto rischio cardiovascolare, oltre che a migliorare la compliance dei pazienti alla terapia. Uno studio suggerisce che il trattamento combinato di Zofenopril+Idroclorotiazide sia associato a una maggiore efficacia antipertensiva rispetto alla monoterapia con Zofenopril, indipendentemente dalle fasce di rischio cardiovascolare stimate secondo il punteggio HEART (History, Electrocardiogram, Age, Risk factors, and Troponin). La differenza tra il trattamento combinato e la monoterapia è stata particolarmente evidente per il gruppo di pazienti a rischio più elevato (Figura 4) (35).
Riguardo la sicurezza e la tollerabilità di questa combinazione, i più comuni effetti avversi osservati sono quelli attesi durante il trattamento con un ACE-inibitore, cioè vertigini, cefalea e tosse (generalmente di gravità lieve o moderata). La tollerabilità complessiva di Zofenopril+Idroclorotiazide è simile a quella della monoterapia (33).
3.7 Progetto SMILE (Survival of Myocardial Infarction Long-term Evaluation): efficacia cardioprotettiva di Zofenopril nei pazienti post-infarto miocardico
Gli studi SMILE sono un gruppo di studi clinici che, nel corso degli ultimi decenni, hanno dimostrato che il beneficio dell’impiego di Zofenopril va al di là del controllo pressorio (13). Lo studio pilota SMILE (1988-1989) ha studiato sicurezza ed efficacia del trattamento a lungo termine con questo ACE-inibitore iniziando la terapia entro 24 ore dall’insorgenza dei sintomi in 204 pazienti con infarto miocardico acuto e non sottoposti a trattamento trombolitico (36). Zofenopril ha mostrato risultati preliminari favorevoli a livello di protezione cardiovascolare (i.e. riduzione della pressione sanguigna, dell’incidenza di insufficienza ventricolare sinistra acuta e di aritmie ventricolari, riduzione del numero di episodi anginosi e aumento della frazione di eiezione sinistra) senza causare eventi clinici o biochimici avversi irreversibili. La somministrazione precoce di Zofenopril dimostrava dunque, per la prima volta, di costituire una forma di terapia sicura nei pazienti che avevano subito infarto miocardico acuto, in particolare quando l’evento risultava complicato da ulteriori segni clinici di disfunzione cardiaca. Sulla base di questi risultati, sono stati avviati i successivi studi SMILE.
- SMILE-1 (17): Zofenopril è efficace nel ridurre il rischio di eventi cardiovascolari gravi post-infarto
Lo studio SMILE-1 (1991-1992) ha valutato su ampia scala l’efficacia di Zofenopril osservata nello studio pilota. Si trattava di un disegno randomizzato, in doppio cieco e controllato su una coorte di 1.556 pazienti con confermato infarto miocardico acuto e non sottoposti a terapia trombolitica. 772 pazienti sono stati assegnati alla terapia con Zofenopril e confrontati con 784 pazienti assegnati al placebo. Il trattamento, intrapreso entro 24 ore dall’insorgenza dei sintomi di infarto miocardico anteriore acuto, iniziava alla dose di 7,5 mg, ripetuta dopo 12 ore e poi progressivamente titolata fino alla dose target di 30 mg due volte al giorno, sempre verificando che la pressione sistolica rimanesse al di sopra di 100 mmHg. I pazienti sono stati seguiti per tutta la loro permanenza ospedaliera, rivalutati dopo 4 settimane e poi nuovamente alla fine del periodo di trattamento (in media 6 settimane ± 3 giorni). L’endpoint primario composito era costituito da mortalità e da insorgenza di insufficienza cardiaca congestizia grave: l’una o l’altra si sono verificate in 55 pazienti nel gruppo Zofenopril (7,1%) e in 83 del gruppo placebo (10,6%), per una riduzione del 34% del rischio di eventi cardiovascolari severi nel gruppo Zofenopril (P<0,05; Figura 5A). Tale riduzione del rischio era principalmente dovuta ad una minor incidenza di insufficienza cardiaca congestizia grave, mentre la mortalità per tutte le cause a 6 settimane è risultata del 6,5% nel gruppo Zofenopril vs 8,3% nel gruppo placebo, equivalente ad una riduzione del rischio del 22% nel gruppo Zofenopril (n.s.). Nella valutazione della mortalità a 1 anno, si è evidenziato come i pazienti che avevano seguito la terapia con Zofenopril per 6 settimane mostrassero una riduzione del 29% dell’incidenza di mortalità (Zofenopril: 10,0% vs Placebo: 14,1; P<0,05; Figura 5B). Zofenopril si rivela dunque un farmaco con ottima attività di protezione cardiovascolare nei pazienti post-infarto.
Un’analisi post-hoc dello studio SMILE-1 ha confrontato gli esiti cardiovascolari del trattamento con Zofenopril in pazienti con e senza storia di ipertensione (37). Come nello studio principale, è stato messo a confronto il rischio relativo combinato di mortalità e insufficienza cardiaca congestizia severa dopo 6 settimane di trattamento e a 1 anno. Nei pazienti ipertesi, tale rischio relativo è risultato di 0,60 a 6 settimane e di 0,61 a 1 anno, contro un rischio, nei normotesi, di 0,89 e 0,77 a 6 settimane e a 1 anno rispettivamente (Figura 5C e 5D). Questa analisi suggerisce che il beneficio della somministrazione precoce di Zofenopril nei pazienti con infarto miocardico acuto sia significativamente maggiore nei pazienti con storia di ipertensione e perciò più soggetti a possibili complicazioni cardiovascolari future (37). Ulteriori sottoanalisi dello studio SMILE-1 hanno rivelato che Zofenopril riduce significativamente l’incidenza dell’endpoint primario combinato (mortalità e insufficienza cardiaca congestizia grave a 6 settimane) anche nelle sottopopolazioni di pazienti diabetici (38), pazienti con sindrome metabolica (39), pazienti con infarto del miocardio senza sopraslivellamento del tratto ST (40) e pazienti con ipercolesterolemia (41). In conclusione, il trattamento con Zofenopril ha migliorato significativamente l’esito a breve e a lungo termine quando questo farmaco è stato iniziato entro 24 ore dall’insorgenza dell’infarto miocardico anteriore acuto e continuato per 6 settimane.
- SMILE-2 (42): Zofenopril mostra un minor rischio relativo di ipotensione rispetto a Lisinopril
Il successivo studio SMILE-2 (1998-1999) ha studiato la sicurezza e la tollerabilità della somministrazione precoce di due ACE-inibitori – Zofenopril e Lisinopril – nei pazienti con infarto miocardico acuto. Questo studio, di fase III e condotto in 155 centri in Europa e Russia, aveva un disegno randomizzato, a doppio cieco, con gruppi paralleli e ha coinvolto complessivamente 1.024 pazienti tra i 18 e 75 anni. L’endpoint primario consisteva nel verificarsi di ipotensione grave (pressione arteriosa sistolica < 90 mmHg su due misurazioni consecutive a distanza di almeno 1 ora l’una dall’altra). L’incidenza di ipotensione grave correlata al farmaco è stata significativamente inferiore nel gruppo Zofenopril rispetto a Lisinopril (6,7% vs 9,8%; P<0,05). Sono poi stati valutati gli endpoint secondari relativi all’incidenza delle principali complicazioni cardiovascolari: mortalità cumulativa a 6 settimane, incidenza di insufficienza cardiaca grave, frazione di eiezione del ventricolo sinistro a 6 settimane, necessità di procedure di rivascolarizzazione di salvataggio, incidenza di angina pectoris, incidenza di re-infarto e proporzione di pazienti con deterioramento della funzione renale. I due ACE-inibitori non hanno mostrato differenze significative nell’incidenza di mortalità e delle principali complicazioni cardiovascolari. In conclusione, a parità di protezione cardiovascolare, Zofenopril ha dimostrato un rischio relativo inferiore di ipotensione grave nei pazienti con infarto miocardico.
- SMILE-ISCHEMIA (43): Zofenopril riduce il carico ischemico totale nei pazienti post-infarto con funzione ventricolare normale
Il successivo studio SMILE-ISCHEMIA (1998-2001) è stato condotto per indagare gli effetti del trattamento con Zofenopril sull’entità del carico ischemico del miocardio in pazienti con funzione ventricolare sinistra intatta a seguito di infarto miocardico acuto. Questo studio, in doppio cieco e randomizzato, ha confrontato 177 pazienti assegnati al trattamento con Zofenopril e 172 assegnati al placebo. Al momento della randomizzazione, le caratteristiche demografiche e cliniche (e.g. gli esiti dell’ECG, il tempo trascorso dall’infarto miocardico acuto, la pressione sanguigna, la presenza di ipercolesterolemia) sono risultate comparabili tra i due gruppi. Quasi la metà dei pazienti reclutati, per ciascun gruppo, era iperteso. La dose iniziale del farmaco di studio era di 7,5 mg due volte al giorno, poi progressivamente raddoppiata fino alla dose finale di 30 mg due volte al giorno se la pressione sanguigna sistolica rimaneva maggiore a 100 mmHg e non vi erano segni o sintomi di ipotensione. La frequenza dell’endpoint primario, valutato come carico ischemico totale, è risultato del 20,3% nei pazienti trattati con Zofenopril contro i 35,9% nei pazienti con placebo (P=0,001), mostrando quindi un vantaggio significativo nell’utilizzo di Zofenopril. La Figura 6 mostra come gli eventi cardiovascolari principali, valutati singolarmente, siano risultati meno frequenti nel gruppo Zofenopril rispetto al gruppo placebo. Inoltre, tra i pazienti trattati con Zofenopril, una percentuale significativamente inferiore rispetto al gruppo placebo ha presentato alterazioni ischemiche dell’ECG (10,6% vs 19,7%), dolore anginoso (3,3% vs 9,9%) o aritmie significative (2,7% vs 7,2%). La frequenza di effetti avversi con Zofenopril è risultata comparabile a quella del placebo, mentre la percentuale totale di eventi gravi (morte, sviluppo o peggioramento di insufficienza cardiaca congestizia, ipotensione severa, pressione alta) è stata di 4,5% nel gruppo Zofenopril contro il 12,7% nel gruppo placebo.
I risultati dello studio SMILE-ISCHEMIA hanno mostrato che un trattamento di breve durata con Zofenopril in pazienti con infarto miocardico recente e con funzione ventricolare conservata ha ridotto il carico ischemico globale del 44% e gli esiti combinati del 65%. Questi risultati sono in linea con quelli ottenuti nello studio SMILE-1.
- SMILE-4 (19,44,45): Zofenopril+ASA riduce il rischio di eventi cardiovascolari maggiori rispetto a Ramipril+ASA nei pazienti post-infarto con disfunzione ventricolare sinistra
Lo studio SMILE-4 (2005-2009) è uno studio di fase III, randomizzato in doppio cieco, multicentrico e a gruppi paralleli che ha confrontato gli esiti cardiovascolari in seguito al trattamento con Zofenopril+ASA (n=389) vs Ramipril+ASA (n=382) in pazienti post-infarto con disfunzione ventricolare sinistra. Il gruppo assegnato a Zofenopril ha mostrato una riduzione del 30% del rischio di outcome cardiovascolare grave (i.e. mortalità e ospedalizzazione per cause cardiovascolari) rispetto al gruppo trattato con Ramipril. Il follow-up a lungo termine ha mostrato il perdurare di un miglior effetto cardioprotettivo del trattamento precoce con Zofenopril per molti anni (44,45).
La somministrazione di una terapia standard come ASA, in aggiunta a Zofenopril, può risultare appropriata e benefica in pazienti che hanno subito infarto del miocardio acuto. Infatti, sebbene ASA interagisca con la via delle prostaglandine attivata dalla bradichinina, gli ACE-inibitori con gruppo sulfidrilico mantengono i loro benefici cardiovascolari (19,20). L’azione protettiva determinata dalla presenza del gruppo sulfidrilico potrebbe quindi avere un effetto compensatorio nei riguardi di questa interazione.
- Analisi complessiva degli studi SMILE (46): Zofenopril ha un effetto cardioprotettivo nei pazienti post-infarto miocardico
Gli autori degli studi SMILE hanno poi effettuato un’analisi dell’efficacia cumulativa di Zofenopril (2015) di tutti i dati individuali dei singoli studi SMILE sopraelencati, per un totale di 3.630 pazienti con infarto miocardico acuto. L’insorgenza complessiva di esiti cardiovascolari maggiori è risultata ridotta significativamente del 40% nel trattamento con Zofenopril rispetto al placebo e del 23% rispetto ad altri ACE-inibitori a 1 anno dall’inizio del trattamento (Figura 7). Rispetto al placebo, il beneficio di Zofenopril era già evidente a 6 settimane, con una riduzione del 28% del rischio di morte e/o ospedalizzazione per cause cardiovascolari.
Conclusioni
Zofenopril è un farmaco ACE-inibitore che agisce sul SRAA attraverso l’inibizione dell’enzima ACE, responsabile della conversione di angiotensina I in angiotensina II. A questa sua attività consegue una riduzione della pressione e un effetto vasodilatatorio e di protezione cardiovascolare indotti da una ridotta attività dell’angiotensina II e di altre cascate ormonali più a valle, quali il rilascio di aldosterone. Grazie anche alla presenza del gruppo sulfidrilico, Zofenopril possiede alcune peculiarità tra cui si annoverano un’elevata lipofilia, un alto grado di penetrazione tissutale, una maggiore affinità per l’ACE tissutale e un legame di lunga durata con esso e, infine, un significativo effetto antiossidante e vasculoprotettivo (13,14).
Zofenopril è indicato nel trattamento dell’ipertensione essenziale da lieve a moderata e nei pazienti che hanno subito di recente infarto miocardico acuto. Gli ACE-inibitori sono tra i farmaci più utilizzati in questi contesti e la loro efficacia e sicurezza sono ben documentate. Zofenopril può essere utilizzato in concomitanza ad altri farmaci quali altri antipertensivi, ASA e diuretici per produrre un effetto benefico sinergico per le popolazioni a più alto rischio o più resistenti alla terapia antipertensiva, migliorando inoltre la compliance al trattamento. Si richiede cautela di utilizzo in alcune popolazioni speciali che possono essere più soggette agli effetti avversi tipicamente associati agli ACE-inibitori. L’efficacia cardioprotettiva di Zofenopril è supportata dalle evidenze della serie di studi SMILE che nelle ultime due decadi hanno solidificato le basi per l’utilizzo di questo farmaco nei pazienti con recente infarto miocardico acuto.
Bibliografia
- Ames MK, Atkins CE, Pitt B. The renin-angiotensin-aldosterone system and its suppression. J Vet Intern Med. 2019 Mar;33(2):363–82.
- Patel S, Rauf A, Khan H, Abu-Izneid T. Renin-angiotensin-aldosterone (RAAS): The ubiquitous system for homeostasis and pathologies. Biomed Pharmacother. 2017 Oct;94:317–25.
- Laurent S. Antihypertensive drugs. Pharmacol Res. 2017 Oct;124:116–25.
- Ram CVS. Angiotensin receptor blockers: current status and future prospects. Am J Med. 2008 Aug;121(8):656–63.
- Borghi C, Rossi F, Trimarco B. Ruolo del sistema renina-angiotensina- aldosterone e dei farmaci che inibiscono tale sistema nelle malattie cardiovascolari: complessità e criticità. :29.
- Piepho RW. Overview of the angiotensin-converting-enzyme inhibitors. American Journal of Health-System Pharmacy. 2000 Oct 1;57(suppl_1):S3–7.
- Dzau VJ. Mechanism of action of angiotensin-converting enzyme (ACE) inhibitors in hypertension and heart failure. Role of plasma versus tissue ACE. Drugs. 1990;39 Suppl 2:11–6.
- Herman LL, Padala SA, Ahmed I, Bashir K. Angiotensin Converting Enzyme Inhibitors (ACEI). In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 [cited 2022 Jul 6]. Available from: http://www.ncbi.nlm.nih.gov/books/NBK431051/
- Petrie MC, Padmanabhan N, McDonald JE, Hillier C, Connell JM, McMurray JJ. Angiotensin converting enzyme (ACE) and non-ACE dependent angiotensin II generation in resistance arteries from patients with heart failure and coronary heart disease. J Am Coll Cardiol. 2001 Mar 15;37(4):1056–61.
- Tropeano AI, Boutouyrie P, Pannier B, Joannides R, Balkestein E, Katsahian S, et al. Brachial pressure-independent reduction in carotid stiffness after long-term angiotensin-converting enzyme inhibition in diabetic hypertensives. Hypertension. 2006 Jul;48(1):80–6.
- Agabiti-Rosei E, Heagerty AM, Rizzoni D. Effects of antihypertensive treatment on small artery remodelling. J Hypertens. 2009 Jun;27(6):1107–14.
- Lewis EJ, Hunsicker LG, Bain RP, Rohde RD. The effect of angiotensin-converting-enzyme inhibition on diabetic nephropathy. The Collaborative Study Group. N Engl J Med. 1993 Nov 11;329(20):1456–62.
- Borghi C, Omboni S. Angiotensin-Converting Enzyme Inhibition: Beyond Blood Pressure Control-The Role of Zofenopril. Adv Ther. 2020 Oct;37(10):4068–85.
- Borghi C, Ambrosio G, Van De Borne P, Mancia G. Zofenopril: Blood pressure control and cardio-protection. Cardiol J. 2022;29(2):305–18.
- Chopra M, Beswick H, Clapperton M, Dargie HJ, Smith WE, McMurray J. Antioxidant effects of angiotensin-converting enzyme (ACE) inhibitors: free radical and oxidant scavenging are sulfhydryl dependent, but lipid peroxidation is inhibited by both sulfhydryl- and nonsulfhydryl-containing ACE inhibitors. J Cardiovasc Pharmacol. 1992 Mar;19(3):330–40.
- Napoli C, Bruzzese G, Ignarro LJ, Crimi E, de Nigris F, Williams-Ignarro S, et al. Long-term treatment with sulfhydryl angiotensin-converting enzyme inhibition reduces carotid intima-media thickening and improves the nitric oxide/oxidative stress pathways in newly diagnosed patients with mild to moderate primary hypertension. Am Heart J. 2008 Dec;156(6):1154.e1-8.
- Ambrosioni E, Borghi C, Magnani B. The Effect of the Angiotensin-Converting–Enzyme Inhibitor Zofenopril on Mortality and Morbidity after Anterior Myocardial Infarction. N Engl J Med. 1995 Jan 12;332(2):80–5.
- Indications for ACE inhibitors in the early treatment of acute myocardial infarction: systematic overview of individual data from 100,000 patients in randomized trials. ACE Inhibitor Myocardial Infarction Collaborative Group. Circulation. 1998 Jun 9;97(22):2202–12.
- Borghi C, Ambrosioni E, Novo S, Vinereanu D, Ambrosio G, SMILE-4 Working Party. Comparison between zofenopril and ramipril in combination with acetylsalicylic acid in patients with left ventricular systolic dysfunction after acute myocardial infarction: results of a randomized, double-blind, parallel-group, multicenter, European study (SMILE-4). Clin Cardiol. 2012;35(7):416–23.
- Zhu B qing, Sievers RE, Browne AEM, Lee RJ, Chatterjee K, Grossman W, et al. Comparative effects of aspirin with ACE inhibitor or angiotensin receptor blocker on myocardial infarction and vascular function. J Renin Angiotensin Aldosterone Syst. 2003 Mar;4(1):31–7.
- Subissi A, Evangelista S, Giachetti A. Preclinical Profile of Zofenopril: An Angiotensin Converting Enzyme Inhibitor with Peculiar Cardioprotective Properties. Cardiovascular Drug Reviews. 1999;17(2):115–33.
- Donnarumma E, Ali MJ, Rushing AM, Scarborough AL, Bradley JM, Organ CL, et al. Zofenopril Protects Against Myocardial Ischemia–Reperfusion Injury by Increasing Nitric Oxide and Hydrogen Sulfide Bioavailability. Journal of the American Heart Association. 5(7):e003531.
- Brugts JJ, Arima H, Remme W, Bertrand M, Ferrari R, Fox K, et al. The incidence and clinical predictors of ACE-inhibitor induced dry cough by perindopril in 27,492 patients with vascular disease. Int J Cardiol. 2014 Oct 20;176(3):718–23.
- Omboni S, Borghi C. Zofenopril and incidence of cough: a review of published and unpublished data. Ther Clin Risk Manag. 2011;7:459–71.
- Malacco E, Castiglioni G, Corradi L, Cristofari M, Fogari R, Pisani A, et al. Dose-Response Relationship of Zofenopril in Essential Hypertension. Clin Drug Investig. 2002 Jan 1;22(1):9–15.
- Mallion JM. An evaluation of the initial and long-term antihypertensive efficacy of zofenopril compared with enalapril in mild to moderate hypertension. Blood Press Suppl. 2007 Oct;2:13–8.
- Malacco E, Piazza S, Omboni S, Zofenopril Study Group. Zofenopril versus Lisinopril in the Treatment of Essential Hypertension in Elderly Patients : A Randomised, Double-Blind, Multicentre Study. Clin Drug Investig. 2005;25(3):175–82.
- Nilsson P. Antihypertensive efficacy of zofenopril compared with atenolol in patients with mild to moderate hypertension. Blood Press Suppl. 2007 Oct;2:25–30.
- Leonetti G, Rappelli A, Omboni S, on Behalf of the Study Group. A similar 24‐h blood pressure control is obtained by zofenopril and candesartan in primary hypertensive patients. Blood Pressure. 2006 Jan 1;15(sup1):18–26.
- Narkiewicz K. Comparison of home and office blood pressure in hypertensive patients treated with zofenopril or losartan. Blood Press Suppl. 2007 Oct;2:7–12.
- Farsang C. Blood pressure control and response rates with zofenopril compared with amlodipine in hypertensive patients. Blood Press Suppl. 2007 Oct;2:19–24.
- Williams B, Mancia G, Spiering W, Agabiti Rosei E, Azizi M, Burnier M, et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension. J Hypertens. 2018 Oct;36(10):1953–2041.
- Omboni S, Malacco E, Parati G. Zofenopril Plus Hydrochlorothiazide Fixed Combination in the Treatment of Hypertension and Associated Clinical Conditions. Cardiovascular Therapeutics. 2009;27(4):275–88.
- Parati G, Omboni S, Malacco E, on Behalf of the Study Group. Antihypertensive efficacy of zofenopril and hydrochlorothiazide combination on ambulatory blood pressure. Blood Pressure. 2006 Jan 1;15(sup1):7–17.
- Malacco E, Omboni S. Antihypertensive effect of zofenopril plus hydrochlorothiazide versus zofenopril monotherapy in patients with essential hypertension according to their cardiovascular risk level: A post hoc analysis. Current Therapeutic Research. 2008 Jun 1;69(3):232–42.
- Ambrosioni E, Borghi C, Magnani B. Early treatment of acute myocardial infarction with angiotensin-converting enzyme inhibition: safety considerations. SMILE pilot study working party. Am J Cardiol. 1991 Nov 18;68(14):101D-110D.
- Borghi C, Bacchelli S, Esposti DD, Bignamini A, Magnani B, Ambrosioni E. Effects of the administration of an angiotensin-converting enzyme inhibitor during the acute phase of myocardial infarction in patients with arterial hypertension. SMILE Study Investigators. Survival of Myocardial Infarction Long-term Evaluation. Am J Hypertens. 1999 Jul;12(7):665–72.
- Borghi C, Bacchelli S, Esposti DD, Ambrosioni E, SMILE Study. Effects of the early ACE inhibition in diabetic nonthrombolyzed patients with anterior acute myocardial infarction. Diabetes Care. 2003 Jun;26(6):1862–8.
- Borghi C, Cicero AFG, Ambrosioni E. Effects of early treatment with zofenopril in patients with myocardial infarction and metabolic syndrome: the SMILE Study. Vasc Health Risk Manag. 2008;4(3):665–71.
- Borghi C, Bacchelli S, Esposti DD, Ambrosioni E. Effects of early angiotensin-converting enzyme inhibition in patients with non–ST-elevation acute anterior myocardial infarction. American Heart Journal. 2006 Sep 1;152(3):470–7.
- Borghi C, Cicero AFG, Bacchelli S, Esposti DD, Ambrosioni E, Survival of Myocardial Infarction Long-term Evaluation (SMILE) Study. Serum cholesterol levels on admission and survival in patients with acute myocardial infarction treated with zofenopril: a post hoc analysis of the Survival of Myocardial Infarction Long-term Evaluation trial. Fundam Clin Pharmacol. 2009 Oct;23(5):641–8.
- Borghi C, Ambrosioni E, Survival of Myocardial Infarction Long-term Evaluation-2 Working Party. Double-blind comparison between zofenopril and lisinopril in patients with acute myocardial infarction: results of the Survival of Myocardial Infarction Long-term Evaluation-2 (SMILE-2) study. Am Heart J. 2003 Jan;145(1):80–7.
- Borghi C, Ambrosioni E, Survival of Myocardial Infarction Long-term Evaluation Study Group. Effects of zofenopril on myocardial ischemia in post-myocardial infarction patients with preserved left ventricular function: the Survival of Myocardial Infarction Long-term Evaluation (SMILE)-ISCHEMIA study. Am Heart J. 2007 Mar;153(3):445.e7-14.
- Borghi C, Omboni S, Novo S, Vinereanu D, Ambrosio G, Ambrosioni E. Early Treatment With Zofenopril and Ramipril in Combination With Acetyl Salicylic Acid in Patients With Left Ventricular Systolic Dysfunction After Acute Myocardial Infarction: Results of a 5-Year Follow-up of Patients of the SMILE-4 Study. J Cardiovasc Pharmacol. 2017 May;69(5):298–304.
- Borghi C, Omboni S, Novo S, Vinereanu D, Ambrosio G, Ambrosioni E. Zofenopril and ramipril in patients with left ventricular systolic dysfunction after acute myocardial infarction: A propensity analysis of the Survival of Myocardial Infarction Long-term Evaluation (SMILE) 4 study. J Renin Angiotensin Aldosterone Syst. 2016 Oct 5;17(4):1470320316656480.
- Borghi C, Omboni S, Reggiardo G, Bacchelli S, Degli Esposti D, Ambrosioni E. Cardioprotective role of zofenopril in patients with acute myocardial infarction: a pooled individual data analysis of four randomised, double-blind, controlled, prospective studies. Open Heart. 2015 Sep 8;2(1):e000220.
Related papers
La medicina tradizionale basa le sue scelte e soluzioni terapeutiche sulla dimostrazione della efficacia dei farmaci quale emerge dai risultati degli studi clinici controllati che selezionano le molecole più efficaci e dettano la strategia di impiego nei pazienti in cui si presume una maggiore efficacia. Nell’ambito di questa strategia di condotta è possibile identificare due [more info]
L’insostenibile leggerezza dell’essere, splendido romando di Milan Kundera, ha come tema principale la pesantezza esistenziale. Ogni persona vive una sola volta e non si ha mai la possibilità di valutare le proprie scelte, perciò diventa difficile capire se tutto ciò che si fa nella vita è giusto o sbagliato, perché non si ha modo di [more info]
Introduzione Le malattie cardiovascolari (CV) costituiscono una delle principali cause di mortalità in tutto il mondo. Secondo l’Organizzazione Mondiale della Sanità (OMS), nel 2019 circa il 32% delle morti globali è stato attribuito a malattie cardiovascolari (1). Tra queste, ruolo predominante gioca la malattia coronarica aterosclerotica, la quale rappresenta la prima causa di mortalità e [more info]