- Sistema Renina-Angiotensina-Aldosterone (SRAA) e ipertensione
Il Sistema Renina-Angiotensina-Aldosterone (SRAA) è un meccanismo ormonale di vitale importanza per la regolazione della pressione sanguigna e l’omeostasi idroelettrolitica. Il sistema viene innescato dalla secrezione dell’enzima renina, prodotto dai reni in risposta a stimoli quali ridotta pressione sanguigna, ipovolemia o scarsità di sodio (1). Al suo rilascio, consegue una reazione a catena che conduce alla produzione di angiotensina II ad opera dell’enzima di conversione dell’angiotensina (ACE), presente nelle cellule endoteliali di piccoli e grandi vasi. Angiotensina II è un potente vasocostrittore, attiva il sistema simpatico e stimola la secrezione surrenalica di aldosterone con conseguente ritenzione di sodio (1). L’angiotensina II può essere sia circolante che tissutale ed è responsabile dell’aumento della pressione sanguigna attraverso l’attivazione del suo recettore di tipo 1 (AT1) (3). ACE non è l’unico enzima che media la produzione di angiotensina II: anche il complesso enzimatico CAGE (enzima generante angiotensina II chemiostatico-sensibile), la chimasi e la catepsina G possono convertire angiotensina I in angiotensina II (4,5). Fondamentale è anche l’azione dell’aldosterone, ormone terminale del SRAA, che regola l’equilibrio dei liquidi corporei e di vari elettroliti, tra cui sodio e potassio (1). Il SRAA regola dunque la pressione sanguigna, mantiene la tonicità vascolare e l’omeostasi idroelettrolitica corporea fondamentale per un corretto funzionamento di cuore e reni, senza rispettivi sovraccarichi (2). Tuttavia, la sua attivazione cronica, in molteplici patologie, comporta svariati effetti negativi, soprattutto a livello cardiovascolare.
L’iperattivazione del SRAA ha un’azione fortemente vasocostrittiva, ipertrofica, pro-fibrotica e pro-infiammatoria, a livello della muscolatura liscia, e conduce all’ipertensione sistemica e al rimodellamento dei tessuti cardiovascolari e renali. Inoltre favorisce l’insorgenza e la progressione del danno cardiovascolare in patologie quali ipertensione, infarto miocardico acuto e insufficienza cardiaca cronica. L’attivazione cronica del SRAA è anche coinvolta nello sviluppo di malattie renali croniche, complicazioni epatiche (alimentate dall’azione pro-infiammatoria), obesità (per l’azione sugli adipociti), diabete e disturbi del sistema nervoso (2). Di fatto, la disregolazione del SRAA alimenta il rischio cardiovascolare e di danno d’organo a cui conseguono eventi clinici anche fatali. Per questa ragione, sono molti i farmaci ideati per agire sull’iperattivazione del SRAA: gli ACE-inibitori impediscono la conversione di angiotensina I in angiotensina II; i sartani bloccano il legame dell’angiotensina II al suo recettore AT1; e, infine, gli antagonisti dei recettori dei mineralcorticoidi agiscono a valle, frenando le conseguenze dell’azione dell’aldosterone.
- Farmaci antipertensivi: gli ACE-inibitori
Il primo farmaco ACE-inibitore messo in commercio per il trattamento dell’ipertensione è stato captopril, nel 1980, seguito rapidamente da numerosi altri quali enalapril, perindopril, lisinopril, ramipril, quinapril, benazepril, cilazapril, trandolapril, fosinopril, moexipril, imidapril e zofenopril (3). Tutte queste sono molecole analoghe alla 2-metilpropionil-L-prolina (6). Il target molecolare di questa classe di medicinali è l’enzima ACE, responsabile della conversione da angiotensina I ad angiotensina II. ACE è una zinco-metalloproteinasi, generalmente ancorata alla membrana cellulare – solo una piccola parte viene rilasciata in circolo – e localizzata in vari tessuti i cui principali sono l’endotelio, di piccoli e grandi vasi, e i tessuti polmonari (3,7).
Dato il suo strategico posizionamento, ACE regola la quantità di angiotensina II circolante, la quale ha un ruolo di potente vasocostrittore. Di conseguenza, gli ACE-inibitori attuano un significativo effetto vasodilatatore che riduce la resistenza anche di piccole arteriole. La riduzione di angiotensina II aumenta la natriuresi, abbassa la pressione sanguigna e previene il rimodellamento del muscolo liscio e dei miociti cardiaci; ne consegue una riduzione della pressione arteriosa e venosa che riduce il pre- e il post-carico del cuore (8). La gittata e il battito cardiaco rimangono invariati e non viene riportata ipotensione posturale. Inoltre, gli ACE-inibitori interferiscono con la degradazione della bradichinina ossia un peptide, anch’esso substrato di ACE, che induce la vasodilatazione stimolando il rilascio di ossido nitrico (3,6).
Le caratteristiche farmacocinetiche e farmacodinamiche di ciascun ACE-inibitore dipendono dalla loro specifica affinità, potenza, lipofilia e ritenzione da parte dei tessuti che esprimono ACE; tali fattori ne determinano il perdurare dell’inibizione. Sebbene gli ACE-inibitori non agiscano sulla produzione di angiotensina II che si verifica per vie enzimatiche alternative – le quali potrebbero attenuare l’effetto antipertensivo nel lungo termine (9) –, questa classe di farmaci dimostra un adeguato controllo pressorio per mesi o anni. Tale effetto sembra essere dovuto alla mancata degradazione di peptidi vasodilatatori, tra cui la bradichinina (3).
L’efficacia terapeutica antipertensiva degli ACE-inibitori riduce il rischio di quelle problematiche cardiovascolari e coronariche tipicamente associate ad elevati valori di pressione sanguigna (8). La loro azione correla con una riduzione dell’ipertrofia ventricolare sinistra, una riduzione dell’irrigidimento di piccole e grandi arterie e un miglioramento della funzione endoteliale (10,11). Inoltre, alcuni ACE-inibitori sembrano esercitare un effetto nefroprotettivo nei pazienti con nefropatia diabetica, grazie all’efficace riduzione della pressione sanguigna (3,12).
- Perindopril
3.1. Indicazioni e posologia
Perindopril è un farmaco ACE-inibitore indicato per il trattamento di ipertensione, insufficienza cardiaca sintomatica e coronaropatia stabile. La struttura e la formula chimica della molecola sono illustrate nella Figura 1.
Per i pazienti ipertesi, la posologia di Perindopril deve essere stabilita in base al profilo del paziente e alla risposta pressoria; tale farmaco può essere impiegato sia in monoterapia che in associazione con altre classi di antipertensivi. La posologia iniziale raccomandata è di 4 mg al mattino (una volta al giorno), eccetto nei pazienti con SRAA fortemente attivato (in particolare ipertensione renovascolare, deplezione salina e/o volemica, scompenso cardiaco o ipertensione grave) ove può verificarsi un’eccessiva riduzione della pressione arteriosa in seguito all’assunzione della dose iniziale. In tali pazienti, si raccomanda di iniziare il trattamento alla posologia di 2 mg e sotto controllo medico. In pazienti che sono contemporaneamente trattati con diuretici, è più probabile che si verifichi ipotensione sintomatica all’inizio della terapia; pertanto, si raccomanda cautela e, se possibile, di interrompere il diuretico 2 o 3 giorni prima di iniziare il trattamento con Perindopril. Se il diuretico non può essere sospeso, il trattamento con Perindopril deve essere iniziato alla posologia di 2 mg e la funzionalità renale e la potassiemia sierica devono essere tenute sotto controllo. Il dosaggio successivo di Perindopril deve essere adattato in funzione della risposta pressoria; se richiesto, il trattamento diuretico può essere reintrodotto. Nei pazienti anziani il trattamento deve essere iniziato alla posologia di 2 mg che, se necessario, può essere progressivamente aumentata a 4 mg dopo un mese di trattamento e quindi a 8 mg in base alla funzionalità renale.
Nei pazienti con insufficienza cardiaca sintomatica, si raccomanda che il trattamento con Perindopril – generalmente in associazione con un diuretico non risparmiatore di potassio e/o con digossina e/o con un beta-bloccante – sia istituito sotto stretto controllo medico alla posologia iniziale consigliata di 2 mg assunti al mattino. Se tollerata, tale posologia può essere aumentata dopo due settimane fino a 4 mg una volta al giorno, sempre al mattino. Gli aggiustamenti posologici devono avvenire in base alla risposta clinica individuale del paziente. Nei pazienti a rischio elevato di ipotensione sintomatica (e.g. pazienti con deplezione salina con o senza iponatremia, pazienti ipovolemici o pazienti in trattamento con dosi massive di diuretici) si deve procedere, ove possibile, a una correzione di tali fattori prima di intraprendere la terapia con Perindopril. La pressione arteriosa, la funzionalità renale e le concentrazioni plasmatiche di potassio devono essere controllate attentamente sia prima che durante il trattamento con Perindopril.
Nei pazienti con coronaropatia stabile, il trattamento con Perindopril deve essere iniziato alla posologia di 4 mg una volta al giorno per 2 settimane, poi aumentato fino a 8 mg una volta al giorno in base alla funzionalità renale e a condizione che la dose da 4 mg sia ben tollerata. Se durante il primo mese di trattamento si dovesse manifestare un episodio di angina pectoris instabile (sia esso severo o meno), deve essere effettuata un’attenta valutazione del rischio/beneficio prima di continuare il trattamento. I pazienti anziani devono iniziare il trattamento con 2 mg una volta al giorno per una settimana, da aumentare a 4 mg una volta al giorno nella settimana successiva, prima di passare a 8 mg una volta al giorno in base alla funzionalità renale e a condizione che la dose inferiore precedente sia ben tollerata.
Nel caso di pazienti con compromissione renale, la posologia deve essere adattata in base alla clearance della creatinina (ClCR): se ClCR > 60 mL/min la posologia raccomandata corrisponde a 4 mg al giorno, se 30 < ClCR < 60 mL/min corrisponde a 2 mg al giorno, se 15 < ClCR < 30 mL/min corrisponde a 2 mg a giorni alterni e se ClCR < 15 mL/min (pazienti emodializzati) corrisponde a 2 mg al giorno della dialisi (la clearance di dialisi del perindoprilato, metabolita attivo, è di 70 ml/min). Nei pazienti in emodialisi, la dose deve essere somministrata dopo la dialisi.
Nei pazienti con compromissione epatica non è richiesto alcun adattamento della posologia. Infine, nella popolazione pediatrica, l’impiego del farmaco non è attualmente raccomandato poiché l’efficacia e la sicurezza d’impiego non sono state ancora stabilite.
3.2 Meccanismo d’azione
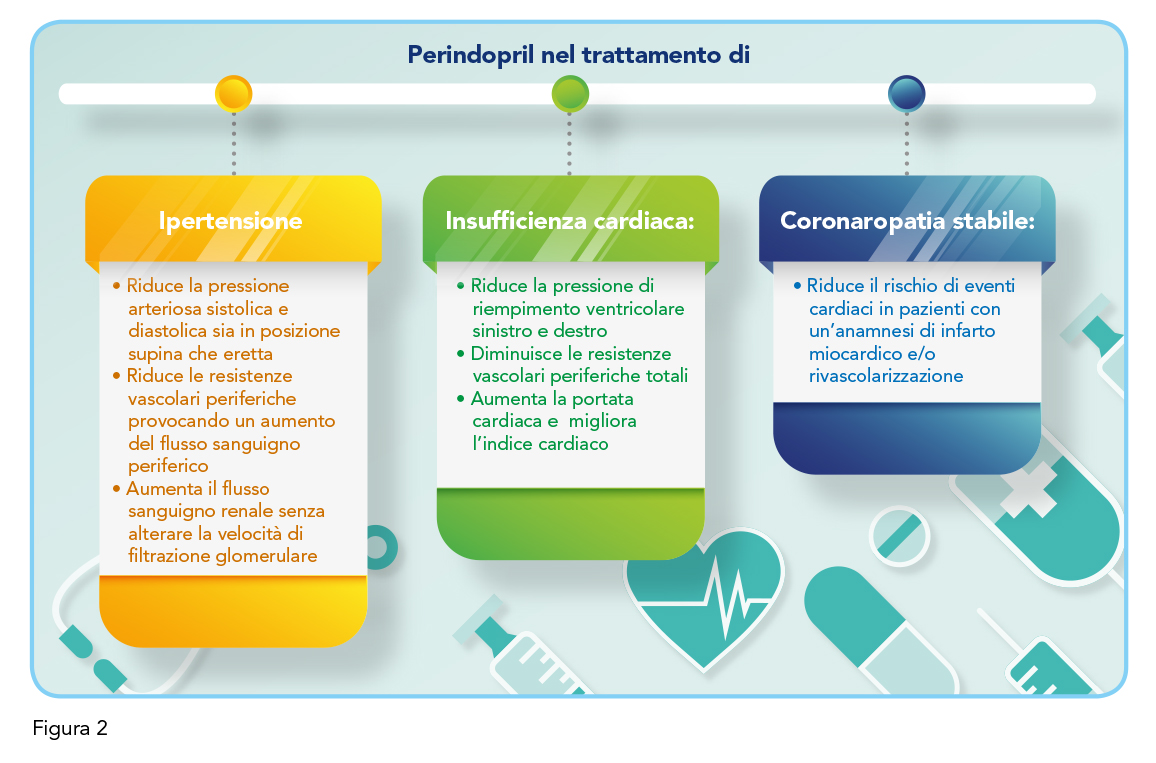
Perindopril è un inibitore dell’enzima ACE responsabile della conversione di angiotensina I in angiotensina II, un agente vasocostrittore che conduce a un aumento di attività della renina plasmatica e a una ridotta secrezione di aldosterone. Inoltre, ACE inattiva la bradichinina, un vasodilatatore, determinando un aumento dell’attività del sistema callicreina-chinina a livello circolatorio e locale (e quindi anche un’attivazione delle prostaglandine). È probabile che tale meccanismo contribuisca alla riduzione della pressione arteriosa da parte degli ACE-inibitori e che sia parzialmente responsabile di alcuni effetti collaterali. Perindopril viene somministrato come perindopril sale di tert-butilamina (nota anche come erbumina) e agisce attraverso il suo metabolita attivo, il perindoprilato; gli altri metaboliti non mostrano inibizione dell’attività di ACE nelle analisi in vitro. Tra i suoi effetti farmacodinamici si annovera la riduzione delle resistenze vascolari periferiche e il conseguente aumento del flusso sanguigno periferico (senza alcun effetto sulla frequenza cardiaca). Inoltre, studi condotti in pazienti affetti da insufficienza cardiaca, hanno evidenziato una riduzione della pressione di riempimento ventricolare sinistro e destro, una diminuzione delle resistenze vascolari periferiche totali, un aumento della portata cardiaca e un miglioramento dell’indice cardiaco. Infine, in pazienti con anamnesi di infarto miocardico e/o rivascolarizzazione, riduce il rischio di eventi cardiaci (Figura 2).
3.3 Farmacocinetica
Perindopril è un farmaco somministrato per via orale, il cui assorbimento è rapido, raggiunge il picco di concentrazione entro 1 ora e ha un’emivita plasmatica di 1 ora. Essendo un profarmaco, il 27% della dose somministrata di Perindopril raggiunge il torrente circolatorio in forma di metabolita attivo perindoprilato, il cui picco di concentrazione plasmatica viene raggiunto in 3-4 ore. Esistono altri cinque metaboliti di Perindopril, tutti inattivi. L’assunzione di cibo riduce la conversione a perindoprilato e dunque la biodisponibilità. Perindopril deve essere somministrato per via orale in un’unica dose giornaliera al mattino prima di un pasto. È stata dimostrata una relazione lineare tra la dose di Perindopril e la sua esposizione plasmatica. Il volume di distribuzione del perindoprilato libero è di circa 0,2 L/kg. Il legame del perindoprilato con le proteine plasmatiche, principalmente con ACE, è del 20% ma è concentrazione-dipendente. L’eliminazione del perindoprilato libero avviene tramite urine e l’emivita terminale della frazione libera è di circa 17 ore, con il raggiungimento dello stato stazionario entro 4 giorni. L’eliminazione del perindoprilato è ridotta nell’anziano, come pure nei pazienti con insufficienza cardiaca o renale (caso in cui la posologia va aggiustata in funzione della clearance della creatinina). La clearance di dialisi del perindoprilato è di 70 ml/min. Nel paziente cirrotico, la cinetica del Perindopril viene modificata: la clearance epatica della molecola madre è ridotta della metà. Tuttavia, la quantità di perindoprilato formatasi non viene ridotta e non è quindi necessario un adattamento della posologia.
3.4 Sicurezza e tollerabilità
Il profilo di sicurezza di Perindopril è coerente con quello degli ACE-inibitori e gli eventi avversi più frequenti riportati negli studi clinici sono: capogiro, cefalea, parestesia, vertigini, disturbi visivi, tinnito, ipotensione, tosse, dispnea, dolore addominale, costipazione, diarrea, disgeusia, dispepsia, nausea, vomito, prurito, eruzione cutanea, crampi muscolari e astenia.
Perindopril è controindicato nei casi di: 1) ipersensibilità al principio attivo, a uno degli eccipienti o a qualunque altro ACE-inibitore; 2) angioedema ereditario, idiopatico o associato a precedente terapia con ACE-inibitori; 3) uso concomitante con la terapia Sacubitril/Valsartan (il trattamento con Perindopril può essere iniziato una volta trascorse 36 ore dall’ultima dose di Sacubitril/Valsartan); 4) gravidanza al secondo e terzo trimestre; 5) uso concomitante con medicinali contenenti aliskiren nei pazienti affetti da diabete mellito o compromissione renale (velocità di filtrazione glomerulare < 60 mL/min/L 1,73 m2); 6) trattamenti extracorporei che portano il sangue a contatto con superfici caricate negativamente; 7) stenosi bilaterale significativa dell’arteria renale o stenosi unilaterale in pazienti con rene unico funzionante.
Gli ACE-inibitori possono provocare una riduzione della pressione arteriosa. Raramente è stata osservata ipotensione sintomatica in pazienti con ipertensione non complicata: tale evento può manifestarsi con più probabilità in pazienti ipovolemici o con insufficienza cardiaca sintomatica (più probabile se di grado severo), associata o meno a insufficienza renale. Nei pazienti con cardiopatia ischemica o disturbi cerebrovascolari, un’eccessiva riduzione della pressione arteriosa può portare a un infarto miocardico o a un accidente cerebrovascolare. Si veda la sezione “Indicazioni e posologia” relativa a questa condizione.
Nei casi di compromissione renale la posologia iniziale del Perindopril deve essere adattata alla ClCR e devono essere monitorati i livelli di potassio. Nei pazienti con insufficienza cardiaca sintomatica, l’ipotensione conseguente all’inizio della terapia con ACE-inibitori può determinare un’ulteriore compromissione della funzionalità renale. In tale situazione, è stata segnalata insufficienza renale acuta generalmente reversibile.
L’angioedema è stato raramente segnalato in pazienti trattati con ACE-inibitori, incluso Perindopril. In questi casi, Perindopril deve essere immediatamente sospeso e il paziente tenuto sotto osservazione fino a completa risoluzione dei sintomi. Il decorso può essere più o meno grave in base alla regione coinvolta (meno grave se limitato a volto e labbra, più grave, o addirittura fatale, se di tipo laringeo). L’angioedema intestinale deve essere incluso nella diagnosi differenziale dei pazienti in trattamento con ACE-inibitori e che presentano dolore addominale. L’uso concomitante di ACE-inibitori con Sacubitril/Valsartan è controindicato a seguito dell’aumento del rischio di angioedema. Per la stessa ragione, si raccomanda cautela nell’uso concomitante di ACE-inibitori con inibitori di mTOR.
I pazienti in trattamento con ACE-inibitori nei quali compaia ittero o un aumento elevato degli enzimi epatici devono sospendere l’ACE-inibitore ed essere posti sotto stretto controllo medico a causa di una rara sindrome, dal meccanismo sconosciuto, che può evolvere in necrosi epatica fulminante.
A seguito della somministrazione di ACE-inibitori è stata segnalata la comparsa di tosse secca e persistente che si risolve alla sospensione del trattamento. La tosse indotta dagli ACE-inibitori deve essere tenuta in considerazione come parte della diagnosi differenziale della tosse.
Poiché inibiscono il rilascio dell’aldosterone, gli ACE-inibitori possono causare iperpotassiemia in particolare in quei pazienti con funzione renale compromessa e/o in pazienti che assumono integratori di potassio, diuretici risparmiatori di potassio, trimetoprim o co-trimoxazolo e specialmente antagonisti dell’aldosterone o bloccanti del recettore dell’angiotensina.
Raramente, sono state osservate reazioni anafilattoidi in risposta alla somministrazione di ACE-inibitori nel caso di pazienti sottoposti a LDL aferesi con destrano solfato, durante un trattamento desensibilizzante (e.g. veleno di imenotteri) e nei pazienti in emodialisi con membrane ad alto flusso. In questi ultimi dovrebbe essere preso in considerazione l’impiego di un tipo diverso di membrane per dialisi o di una classe diversa di agenti antipertensivi.
In pazienti trattati con ACE-inibitori sono stati segnalati casi di neutropenia/agranulocitosi/trombocitopenia e anemia. Per questa motivazione, Perindopril deve essere somministrato con estrema cautela a pazienti con collagenopatie, trattati con agenti immunosoppressori, con allopurinolo o procainamide, o che presentino una combinazione di questi fattori di complicazione, specialmente in presenza di compromissione renale preesistente.
3.5 Studi più rilevanti
- Studio EUROPA (13): Perindopril migliora significativamente l’esito di pazienti con coronaropatia stabile senza insufficienza cardiaca
Gli ACE-inibitori sono farmaci antipertensivi e cardioprotettivi; nello specifico, Perindopril, ha documentate proprietà anti-ischemiche, anti-aterosclerotiche e di rimodellamento vascolare (13). Lo studio EUROPA (EUropean trial on Reduction Of cardiac events with Perindopril in patients with stable coronary Artery disease) è stato istituito per testare l’efficacia di Perindopril in termini di riduzione della mortalità per cause cardiovascolari, infarto miocardico e arresto cardiaco, e ha coinvolto un’ampia popolazione di pazienti con coronaropatia stabile senza insufficienza cardiaca o ipertensione essenziale. Questo studio è stato uno tra i più importanti per l’impego terapeutico di Perindopril, specialmente nel contesto dei pazienti con coronaropatia stabile. Il reclutamento dei partecipanti è avvenuto tra Ottobre 1997 e Giugno 2000: tutti i soggetti erano al di sopra dei 18 anni, senza evidenze cliniche di insufficienza cardiaca ma con coronaropatia documentata da un precedente infarto miocardico (> 3 mesi), da una procedura di rivascolarizzazione coronarica percutanea o chirurgica (> 6 mesi), o con evidenza angiografica di un restringimento di almeno il 70% di una o più arterie coronarie principali.
Prima della randomizzazione, tutti i soggetti inclusi sono stati sottoposti ad un periodo di run-in in cui hanno ricevuto Perindopril 4 mg/die per due settimane (al mattino), seguite da altre due settimane alla dose di 8 mg/die (con possibilità di riduzione se questa non fosse risultata tollerata). In seguito, 6.110 pazienti sono stati assegnati al trattamento con Perindopril 8 mg e 6.108 al placebo, per una durata minima di 3 anni. Il trattamento con Perindopril poteva essere ridotto a 4 mg nel caso in cui la dose più alta non fosse stata tollerata, possibilità che si è poi verificata soltanto nel 7% dei pazienti (valutando a studio completato). I pazienti randomizzati erano perlopiù uomini (85%), con età media di 60 anni e con varie tipologie di patologie pregresse o croniche: il 65% aveva sofferto di un infarto miocardico, il 55% erano stati sottoposti a rivascolarizzazione, il 12% soffriva di diabete, il 27% era iperteso (> 160/95 mmHg, sistolica/diastolica), il 63% soffriva di ipercolesterolemia e l’1,3% aveva storia di insufficienza cardiaca congestizia. Nessuno dei pazienti aveva segni clinici di insufficienza cardiaca al momento della randomizzazione e la maggior parte dei pazienti ha assunto Perindopril o placebo in aggiunta alla terapia convenzionale (farmaci antiaggreganti piastrinici, ipolipemizzanti e beta-bloccanti). I soggetti sono stati monitorati a 3, 6 e 12 mesi dalla randomizzazione, per poi proseguire ogni 6 mesi. L’utilizzo medio del farmaco in studio è stato di 3,7 anni nei 4,2 di follow-up.
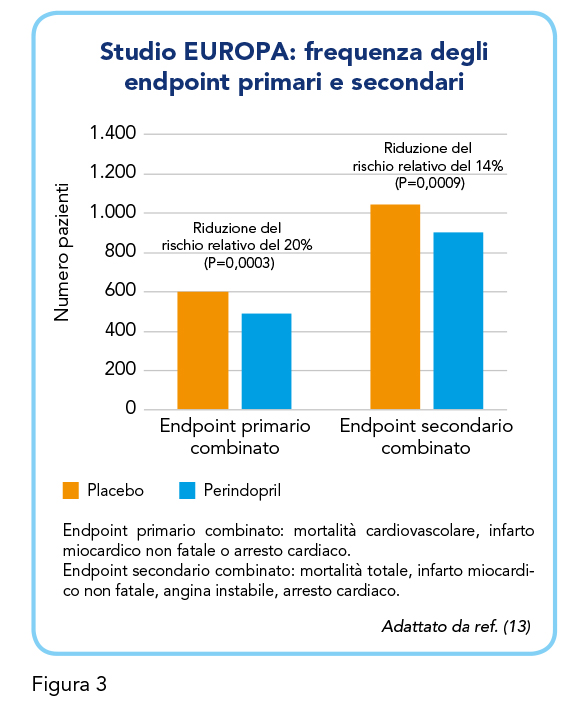
Durante il periodo di run-in, in cui tutti i pazienti ricevevano Perindopril, la pressione arteriosa era scesa da una media di 137/82 mmHg a una media di 128/78 mmHg (sistolica/diastolica). I benefici del trattamento attivo sono iniziati dopo 1 anno dall’inizio della terapia e sono andati crescendo nel corso del trial. Il trattamento con Perindopril ha comportato una significativa riduzione dell’endpoint primario, costituito dalla frequenza composita di mortalità per cause cardiovascolari, infarto non fatale e arresto cardiaco (con rianimazione riuscita). 488 (8%) pazienti del gruppo trattato con Perindopril sono andati incontro all’endpoint primario contro i 603 (10%) del gruppo placebo, per una riduzione significativa del 20% del rischio relativo e dell’1,9% del rischio assoluto (Figura 3). L’effetto benefico di Perindopril sull’endpoint primario era consistente in molti dei sottogruppi valutati (pazienti con o senza ipertensione, affetti da diabete, che hanno subito un precedente infarto miocardico o che assumono beta-bloccanti o terapia ipocolesterolemizzante). In pazienti con anamnesi di infarto miocardico e/o rivascolarizzazione, è stata osservata una riduzione significativa del 22,4% del rischio relativo e del 2,2% del rischio assoluto.
L’endpoint composito secondario – costituito dalla frequenza di mortalità totale, infarto cardiaco non fatale, angina instabile e arresto cardiaco – è risultato significativamente ridotto del 14% nel gruppo Perindopril (Figura 3). La mortalità totale è risultata ridotta dell’11%, sebbene questo calo non comportasse una significatività statistica. Rivascolarizzazione, ictus e scompenso cardiaco sono risultati poco frequenti, con un tasso rispettivo di 9,6%, 1,6% e 1,4%. L’ospedalizzazione per insufficienza cardiaca è risultata significativamente ridotta del 39% e, infine, l’insorgenza di effetti avversi specifici (tosse, ipotensione o aumento anomalo della creatinina) sono risultati poco frequenti.
In sintesi, questo studio ha mostrato che nei pazienti con coronaropatia stabile, senza insufficienza cardiaca evidente, Perindopril può migliorare significativamente l’esito cardiovascolare e l’applicazione di questo trattamento per una durata di 4 anni può significativamente prevenire l’insorgenza di eventi cardiovascolari maggiori. Come affermato dagli autori dello studio EUROPE, stando a questi esiti, il trattamento con Perindopril dovrebbe essere considerato, in aggiunta ad altri farmaci preventivi, in tutti i pazienti con coronaropatia indipendentemente dalla funzionalità cardiaca.
- Studio ASCOT-BPLA (14): il regime antipertensivo calcio-antagonista+Perindopril previene più efficacemente gli eventi cardiovascolari rispetto alla terapia beta-bloccante+diuretico
Lo studio ASCOT-BPLA (Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm) è stato un ampio trial clinico randomizzato e controllato che ha coinvolto 19.257 pazienti ipertesi, atto a confrontare la prevenzione cardiovascolare di due differenti regimi antipertensivi basati sulla combinazione di più classi di farmaci (14). Le linee guida ESC/ESH raccomandano l’impiego di più agenti antipertensivi nei molti pazienti in cui la monoterapia non è sufficiente al raggiungimento dei livelli di pressione arteriosa raccomandati (15). In questo studio è stata presa a riferimento una combinazione convenzionale di frequente utilizzo (beta-bloccante+diuretico: Atenololo+Bendroflumetiazide) e confrontata con una di più recente utilizzo quale Amlodipina+Perindopril (calcio-antagonista+ACE-inibitore). Il protocollo terapeutico prevedeva l’aggiunta del secondo farmaco (Bendroflumetiazide o Perindopril) su necessità, possibilità che si è poi verificata nel 78% dei soggetti inclusi nello studio. I partecipanti, provenienti da paesi scandinavi e anglosassoni, avevano un’età compresa tra i 40 e i 79 anni e valori di pressione sistolica/diastolica ≥ 140/90 mmHg (se già in terapia con antipertensivi) o ≥ 160/100 mmHg (se privi di terapia antipertensiva). Lo studio è durato 5,5 anni alla fine dei quali il 53% dei pazienti ha raggiunto gli obiettivi di pressione arteriosa (il 60% dei pazienti non diabetici e il 32% di quelli diabetici) per una riduzione media complessiva di 26,6/16,6 mmHg. I valori della pressione arteriosa sono risultati più bassi durante tutto lo studio nei soggetti a cui è stato somministrato il regime a base di Amlodipina+Perindopril, rispetto a coloro a cui è stato somministrato il regime a base di Atenololo+Bendroflumetiazide.
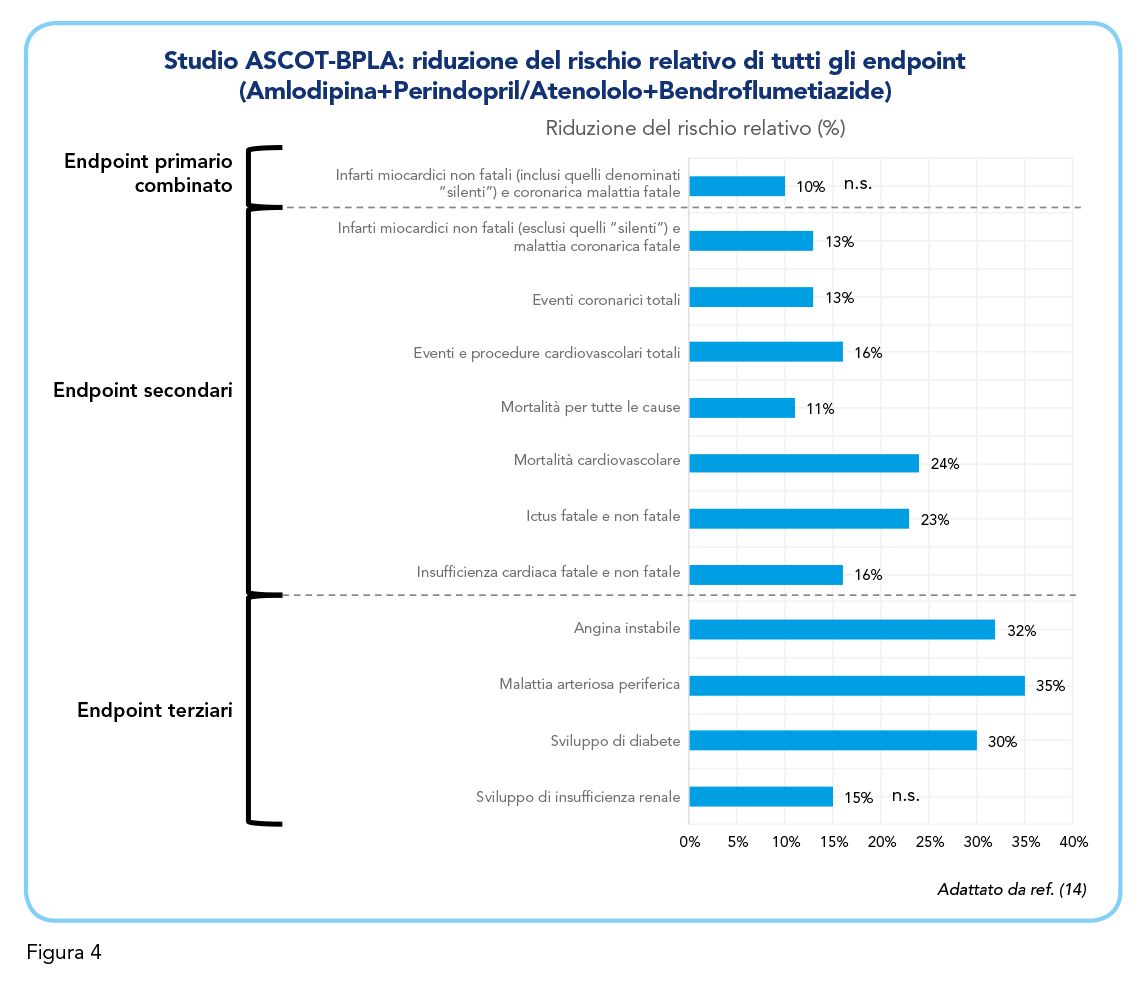
Come endpoint primario combinato è stato valutato il tasso di infarti miocardici non fatali (inclusi quelli denominati “silenti”) e malattia coronarica fatale: il gruppo Amlodipina+Perindopril ha mostrato una riduzione non significativa del 10% del rischio relativo rispetto al gruppo di confronto (Figura 4). Il gruppo trattato con Amlodipina+Perindopril ha poi mostrato una significativa riduzione di diversi endpoint secondari (Figura 4): -13% del rischio relativo di infarti miocardici non fatali (esclusi quelli “silenti”) e malattia coronarica malattia fatale, -13% del rischio relativo di eventi coronarici totali, -16% del rischio relativo di eventi e procedure cardiovascolari totali, -11% del rischio relativo di mortalità per tutte le cause, -24% del rischio relativo di mortalità cardiovascolare e -23% del rischio relativo di ictus fatale e non fatale. Il rischio relativo di insufficienza cardiaca fatale e non fatale è risultato ridotto, in modo non significativo, del 16% sempre nel gruppo Amlodipina+Perindopril (Figura 3). Infine, anche la valutazione degli endpoint terziari si è mostrata in favore del regime Amlodipina+Perindopril con una riduzione significativa del rischio relativo di angina instabile (-32%), malattia arteriosa periferica (-35%), sviluppo di diabete (-30%) e sviluppo di insufficienza renale (-15%).
La strategia antipertensiva Amlodipina+Perindopril ha prevenuto un maggior numero di eventi cardiovascolari principali e ha indotto meno diabete di nuova insorgenza rispetto al regime convenzionale di confronto. Questi effetti potrebbero non essere interamente spiegati da un migliore controllo della pressione arteriosa, come è stato poi evidenziato in un’analisi di compendio che ha valutato il ruolo di questa e altre variabili nei tassi differenziali di eventi cardiovascolari (16). La pressione arteriosa è risultata essere il maggiore singolo contributore all’insorgenza di ictus, mentre le differenze nel colesterolo HDL erano più importanti per il verificarsi di eventi coronarici.
- Studio HYVET (17): efficacia della terapia antipertensiva di diuretico+Perindopril nei pazienti ipertesi con più di 80 anni
Lo studio HYVET (Hypertension in the Very Elderly Trial), pubblicato nel 2008, è stato un altro trial clinico di grande rilevanza per l’impiego di Perindopril nel trattamento dell’ipertensione. Quest’analisi ha coinvolto esclusivamente pazienti ipertesi (sistolica > 160 mmHg) di 80 anni o più (n = 3.845), età in cui l’associazione tra pressione arteriosa e insorgenza di ictus è meno evidente rispetto a soggetti più giovani (17). Dopo la randomizzazione, i pazienti hanno ricevuto Indapamide (diuretico a rilascio prolungato, 1,5 mg) o placebo e, a ogni visita (o a discrezione del clinico), era possibile aggiungere Perindopril 2 mg o 4 mg (o il placebo corrispondente) al fine di raggiungere la pressione sanguigna target (sistolica/diastolica < 150/80 mmHg). L’endpoint primario ha valutato la frequenza di ictus fatali e non fatali lungo un follow-up medio di 1,8 anni. Alla fine dello studio, il 73,4% dei pazienti del gruppo trattato con diuretico aveva ricevuto Perindopril (2 o 4 mg) come agente antipertensivo aggiuntivo.
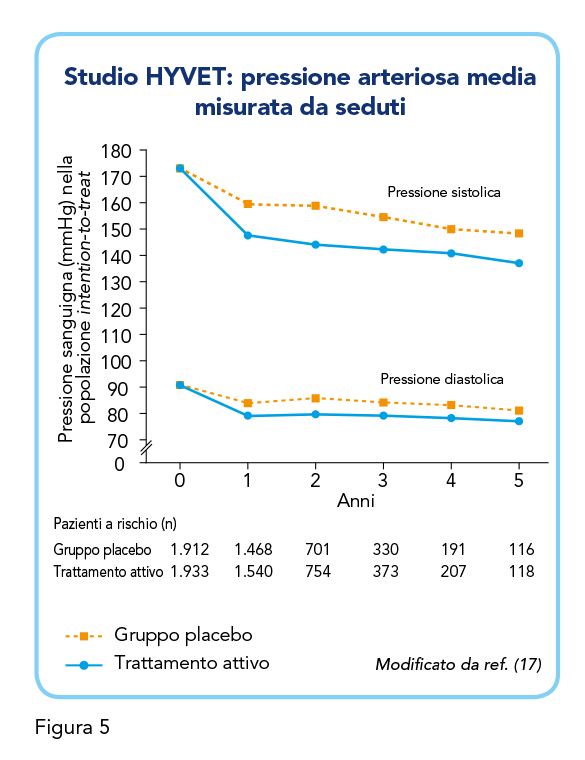
Il gruppo trattato ha mostrato una riduzione dei livelli di pressione sistolica/diastolica di 29,5/12,9 mmHg (vs 14,5/18/5 mmHg nel gruppo placebo) (Figura 5). L’endpoint primario (ictus fatali e non) si è verificato in 51 casi nel gruppo trattato contro i 69 del gruppo placebo, per una riduzione non significativa del 30%. Si è poi osservata una riduzione significativa del tasso del 21% di mortalità per tutte le cause, del 64% della frequenza di insufficienza cardiaca (fatale o non fatale) e del 34% di eventi cardiovascolari complessivi (morte per cause cardiovascolari, ictus, infarto del miocardio, insufficienza cardiaca), mentre il tasso di mortalità per cause cardiovascolari da solo ha mostrato una riduzione non significativa del 39%. Nei 2 anni della durata dello studio, non sono state riportate differenze significative tra i due gruppi in termini di livelli sierici di potassio, mentre un numero significativamente inferiore di eventi avversi si è verificato nei pazienti riceventi il trattamento attivo rispetto a quelli assegnati al placebo (358 vs 448).
In conclusione, questo studio mostra che il trattamento antipertensivo con diuretico+Perindopril (aggiunta che si è verificata in più del 70% dei pazienti) comporta benefici in termini di outcome nei pazienti ipertesi con 80 anni o più.
Conclusioni
Perindopril è un farmaco ACE-inibitore impiegato nel trattamento di ipertensione, insufficienza cardiaca sintomatica e coronaropatia stabile. Esso agisce attraverso un metabolita attivo che blocca la conversione di angiotensina I in angiotensina II attuata dall’enzima ACE, favorendo un effetto vasodilatatorio e riducendo il lavoro cardiaco di pre-carico e post-carico. L’impiego di Perindopril comporta le cautele di utilizzo tipiche di altri ACE-inibitori ed è per questo importante monitorare i valori pressori a inizio terapia, la funzionalità renale (da cui può dipendere la posologia) e i livelli degli elettroliti. Perindopril è stato ampiamente studiato in grandi studi clinici che ne hanno dimostrato l’efficacia antipertensiva e di prevenzione di eventi cardiovascolari in diversi profili di rischio. La terapia di combinazione con altri agenti antipertensivi è un’opzione importante nella pratica clinica e Perindopril ha mostrato evidenze di eccellente efficacia antipertensiva e cardioprotettiva in associazione ad alcuni calcio-antagonisti e diuretici.
Bibliografia
- Ames MK, Atkins CE, Pitt B. The renin-angiotensin-aldosterone system and its suppression. J Vet Intern Med. 2019 Mar;33(2):363–82.
- Patel S, Rauf A, Khan H, Abu-Izneid T. Renin-angiotensin-aldosterone (RAAS): The ubiquitous system for homeostasis and pathologies. Biomed Pharmacother. 2017 Oct;94:317–25.
- Laurent S. Antihypertensive drugs. Pharmacol Res. 2017 Oct;124:116–25.
- Ram CVS. Angiotensin receptor blockers: current status and future prospects. Am J Med. 2008 Aug;121(8):656–63.
- Borghi C, Rossi F, Trimarco B. Ruolo del sistema renina-angiotensina- aldosterone e dei farmaci che inibiscono tale sistema nelle malattie cardiovascolari: complessità e criticità. :29.
- Piepho RW. Overview of the angiotensin-converting-enzyme inhibitors. American Journal of Health-System Pharmacy. 2000 Oct 1;57(suppl_1):S3–7.
- Dzau VJ. Mechanism of action of angiotensin-converting enzyme (ACE) inhibitors in hypertension and heart failure. Role of plasma versus tissue ACE. Drugs. 1990;39 Suppl 2:11–6.
- Herman LL, Padala SA, Ahmed I, Bashir K. Angiotensin Converting Enzyme Inhibitors (ACEI). In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 [cited 2022 Jul 6]. Available from: http://www.ncbi.nlm.nih.gov/books/NBK431051/
- Petrie MC, Padmanabhan N, McDonald JE, Hillier C, Connell JM, McMurray JJ. Angiotensin converting enzyme (ACE) and non-ACE dependent angiotensin II generation in resistance arteries from patients with heart failure and coronary heart disease. J Am Coll Cardiol. 2001 Mar 15;37(4):1056–61.
- Tropeano AI, Boutouyrie P, Pannier B, Joannides R, Balkestein E, Katsahian S, et al. Brachial pressure-independent reduction in carotid stiffness after long-term angiotensin-converting enzyme inhibition in diabetic hypertensives. Hypertension. 2006 Jul;48(1):80–6.
- Agabiti-Rosei E, Heagerty AM, Rizzoni D. Effects of antihypertensive treatment on small artery remodelling. J Hypertens. 2009 Jun;27(6):1107–14.
- Lewis EJ, Hunsicker LG, Bain RP, Rohde RD. The effect of angiotensin-converting-enzyme inhibition on diabetic nephropathy. The Collaborative Study Group. N Engl J Med. 1993 Nov 11;329(20):1456–62.
- Fox KM, EURopean trial On reduction of cardiac events with Perindopril in stable coronary Artery disease Investigators. Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomised, double-blind, placebo-controlled, multicentre trial (the EUROPA study). Lancet. 2003 Sep 6;362(9386):782–8.
- Dahlöf B, Sever PS, Poulter NR, Wedel H, Beevers DG, Caulfield M, et al. Prevention of cardiovascular events with an antihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in the Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm (ASCOT-BPLA): a multicentre randomised controlled trial. Lancet. 2005 Sep 10;366(9489):895–906.
- Williams B, Mancia G, Spiering W, Agabiti Rosei E, Azizi M, Burnier M, et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension. J Hypertens. 2018 Oct;36(10):1953–2041.
- Poulter NR, Wedel H, Dahlöf B, Sever PS, Beevers DG, Caulfield M, et al. Role of blood pressure and other variables in the differential cardiovascular event rates noted in the Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm (ASCOT-BPLA). Lancet. 2005 Sep 10;366(9489):907–13.
- Beckett NS, Peters R, Fletcher AE, Staessen JA, Liu L, Dumitrascu D, et al. Treatment of hypertension in patients 80 years of age or older. N Engl J Med. 2008 May 1;358(18):1887–98.
- Sistema Renina-Angiotensina-Aldosterone (SRAA) e ipertensione
Il Sistema Renina-Angiotensina-Aldosterone (SRAA) è un meccanismo ormonale di vitale importanza per la regolazione della pressione sanguigna e l’omeostasi idroelettrolitica. Il sistema viene innescato dalla secrezione dell’enzima renina, prodotto dai reni in risposta a stimoli quali ridotta pressione sanguigna, ipovolemia o scarsità di sodio (1). Al suo rilascio, consegue una reazione a catena che conduce alla produzione di angiotensina II ad opera dell’enzima di conversione dell’angiotensina (ACE), presente nelle cellule endoteliali di piccoli e grandi vasi. Angiotensina II è un potente vasocostrittore, attiva il sistema simpatico e stimola la secrezione surrenalica di aldosterone con conseguente ritenzione di sodio (1). L’angiotensina II può essere sia circolante che tissutale ed è responsabile dell’aumento della pressione sanguigna attraverso l’attivazione del suo recettore di tipo 1 (AT1) (3). ACE non è l’unico enzima che media la produzione di angiotensina II: anche il complesso enzimatico CAGE (enzima generante angiotensina II chemiostatico-sensibile), la chimasi e la catepsina G possono convertire angiotensina I in angiotensina II (4,5). Fondamentale è anche l’azione dell’aldosterone, ormone terminale del SRAA, che regola l’equilibrio dei liquidi corporei e di vari elettroliti, tra cui sodio e potassio (1). Il SRAA regola dunque la pressione sanguigna, mantiene la tonicità vascolare e l’omeostasi idroelettrolitica corporea fondamentale per un corretto funzionamento di cuore e reni, senza rispettivi sovraccarichi (2). Tuttavia, la sua attivazione cronica, in molteplici patologie, comporta svariati effetti negativi, soprattutto a livello cardiovascolare.
L’iperattivazione del SRAA ha un’azione fortemente vasocostrittiva, ipertrofica, pro-fibrotica e pro-infiammatoria, a livello della muscolatura liscia, e conduce all’ipertensione sistemica e al rimodellamento dei tessuti cardiovascolari e renali. Inoltre favorisce l’insorgenza e la progressione del danno cardiovascolare in patologie quali ipertensione, infarto miocardico acuto e insufficienza cardiaca cronica. L’attivazione cronica del SRAA è anche coinvolta nello sviluppo di malattie renali croniche, complicazioni epatiche (alimentate dall’azione pro-infiammatoria), obesità (per l’azione sugli adipociti), diabete e disturbi del sistema nervoso (2). Di fatto, la disregolazione del SRAA alimenta il rischio cardiovascolare e di danno d’organo a cui conseguono eventi clinici anche fatali. Per questa ragione, sono molti i farmaci ideati per agire sull’iperattivazione del SRAA: gli ACE-inibitori impediscono la conversione di angiotensina I in angiotensina II; i sartani bloccano il legame dell’angiotensina II al suo recettore AT1; e, infine, gli antagonisti dei recettori dei mineralcorticoidi agiscono a valle, frenando le conseguenze dell’azione dell’aldosterone.
- Farmaci antipertensivi: gli ACE-inibitori
Il primo farmaco ACE-inibitore messo in commercio per il trattamento dell’ipertensione è stato captopril, nel 1980, seguito rapidamente da numerosi altri quali enalapril, perindopril, lisinopril, ramipril, quinapril, benazepril, cilazapril, trandolapril, fosinopril, moexipril, imidapril e zofenopril (3). Tutte queste sono molecole analoghe alla 2-metilpropionil-L-prolina (6). Il target molecolare di questa classe di medicinali è l’enzima ACE, responsabile della conversione da angiotensina I ad angiotensina II. ACE è una zinco-metalloproteinasi, generalmente ancorata alla membrana cellulare – solo una piccola parte viene rilasciata in circolo – e localizzata in vari tessuti i cui principali sono l’endotelio, di piccoli e grandi vasi, e i tessuti polmonari (3,7).
Dato il suo strategico posizionamento, ACE regola la quantità di angiotensina II circolante, la quale ha un ruolo di potente vasocostrittore. Di conseguenza, gli ACE-inibitori attuano un significativo effetto vasodilatatore che riduce la resistenza anche di piccole arteriole. La riduzione di angiotensina II aumenta la natriuresi, abbassa la pressione sanguigna e previene il rimodellamento del muscolo liscio e dei miociti cardiaci; ne consegue una riduzione della pressione arteriosa e venosa che riduce il pre- e il post-carico del cuore (8). La gittata e il battito cardiaco rimangono invariati e non viene riportata ipotensione posturale. Inoltre, gli ACE-inibitori interferiscono con la degradazione della bradichinina ossia un peptide, anch’esso substrato di ACE, che induce la vasodilatazione stimolando il rilascio di ossido nitrico (3,6).
Le caratteristiche farmacocinetiche e farmacodinamiche di ciascun ACE-inibitore dipendono dalla loro specifica affinità, potenza, lipofilia e ritenzione da parte dei tessuti che esprimono ACE; tali fattori ne determinano il perdurare dell’inibizione. Sebbene gli ACE-inibitori non agiscano sulla produzione di angiotensina II che si verifica per vie enzimatiche alternative – le quali potrebbero attenuare l’effetto antipertensivo nel lungo termine (9) –, questa classe di farmaci dimostra un adeguato controllo pressorio per mesi o anni. Tale effetto sembra essere dovuto alla mancata degradazione di peptidi vasodilatatori, tra cui la bradichinina (3).
L’efficacia terapeutica antipertensiva degli ACE-inibitori riduce il rischio di quelle problematiche cardiovascolari e coronariche tipicamente associate ad elevati valori di pressione sanguigna (8). La loro azione correla con una riduzione dell’ipertrofia ventricolare sinistra, una riduzione dell’irrigidimento di piccole e grandi arterie e un miglioramento della funzione endoteliale (10,11). Inoltre, alcuni ACE-inibitori sembrano esercitare un effetto nefroprotettivo nei pazienti con nefropatia diabetica, grazie all’efficace riduzione della pressione sanguigna (3,12).
- Perindopril
3.1. Indicazioni e posologia
Perindopril è un farmaco ACE-inibitore indicato per il trattamento di ipertensione, insufficienza cardiaca sintomatica e coronaropatia stabile. La struttura e la formula chimica della molecola sono illustrate nella Figura 1.
Per i pazienti ipertesi, la posologia di Perindopril deve essere stabilita in base al profilo del paziente e alla risposta pressoria; tale farmaco può essere impiegato sia in monoterapia che in associazione con altre classi di antipertensivi. La posologia iniziale raccomandata è di 4 mg al mattino (una volta al giorno), eccetto nei pazienti con SRAA fortemente attivato (in particolare ipertensione renovascolare, deplezione salina e/o volemica, scompenso cardiaco o ipertensione grave) ove può verificarsi un’eccessiva riduzione della pressione arteriosa in seguito all’assunzione della dose iniziale. In tali pazienti, si raccomanda di iniziare il trattamento alla posologia di 2 mg e sotto controllo medico. In pazienti che sono contemporaneamente trattati con diuretici, è più probabile che si verifichi ipotensione sintomatica all’inizio della terapia; pertanto, si raccomanda cautela e, se possibile, di interrompere il diuretico 2 o 3 giorni prima di iniziare il trattamento con Perindopril. Se il diuretico non può essere sospeso, il trattamento con Perindopril deve essere iniziato alla posologia di 2 mg e la funzionalità renale e la potassiemia sierica devono essere tenute sotto controllo. Il dosaggio successivo di Perindopril deve essere adattato in funzione della risposta pressoria; se richiesto, il trattamento diuretico può essere reintrodotto. Nei pazienti anziani il trattamento deve essere iniziato alla posologia di 2 mg che, se necessario, può essere progressivamente aumentata a 4 mg dopo un mese di trattamento e quindi a 8 mg in base alla funzionalità renale.
Nei pazienti con insufficienza cardiaca sintomatica, si raccomanda che il trattamento con Perindopril – generalmente in associazione con un diuretico non risparmiatore di potassio e/o con digossina e/o con un beta-bloccante – sia istituito sotto stretto controllo medico alla posologia iniziale consigliata di 2 mg assunti al mattino. Se tollerata, tale posologia può essere aumentata dopo due settimane fino a 4 mg una volta al giorno, sempre al mattino. Gli aggiustamenti posologici devono avvenire in base alla risposta clinica individuale del paziente. Nei pazienti a rischio elevato di ipotensione sintomatica (e.g. pazienti con deplezione salina con o senza iponatremia, pazienti ipovolemici o pazienti in trattamento con dosi massive di diuretici) si deve procedere, ove possibile, a una correzione di tali fattori prima di intraprendere la terapia con Perindopril. La pressione arteriosa, la funzionalità renale e le concentrazioni plasmatiche di potassio devono essere controllate attentamente sia prima che durante il trattamento con Perindopril.
Nei pazienti con coronaropatia stabile, il trattamento con Perindopril deve essere iniziato alla posologia di 4 mg una volta al giorno per 2 settimane, poi aumentato fino a 8 mg una volta al giorno in base alla funzionalità renale e a condizione che la dose da 4 mg sia ben tollerata. Se durante il primo mese di trattamento si dovesse manifestare un episodio di angina pectoris instabile (sia esso severo o meno), deve essere effettuata un’attenta valutazione del rischio/beneficio prima di continuare il trattamento. I pazienti anziani devono iniziare il trattamento con 2 mg una volta al giorno per una settimana, da aumentare a 4 mg una volta al giorno nella settimana successiva, prima di passare a 8 mg una volta al giorno in base alla funzionalità renale e a condizione che la dose inferiore precedente sia ben tollerata.
Nel caso di pazienti con compromissione renale, la posologia deve essere adattata in base alla clearance della creatinina (ClCR): se ClCR > 60 mL/min la posologia raccomandata corrisponde a 4 mg al giorno, se 30 < ClCR < 60 mL/min corrisponde a 2 mg al giorno, se 15 < ClCR < 30 mL/min corrisponde a 2 mg a giorni alterni e se ClCR < 15 mL/min (pazienti emodializzati) corrisponde a 2 mg al giorno della dialisi (la clearance di dialisi del perindoprilato, metabolita attivo, è di 70 ml/min). Nei pazienti in emodialisi, la dose deve essere somministrata dopo la dialisi.
Nei pazienti con compromissione epatica non è richiesto alcun adattamento della posologia. Infine, nella popolazione pediatrica, l’impiego del farmaco non è attualmente raccomandato poiché l’efficacia e la sicurezza d’impiego non sono state ancora stabilite.
3.2 Meccanismo d’azione
Perindopril è un inibitore dell’enzima ACE responsabile della conversione di angiotensina I in angiotensina II, un agente vasocostrittore che conduce a un aumento di attività della renina plasmatica e a una ridotta secrezione di aldosterone. Inoltre, ACE inattiva la bradichinina, un vasodilatatore, determinando un aumento dell’attività del sistema callicreina-chinina a livello circolatorio e locale (e quindi anche un’attivazione delle prostaglandine). È probabile che tale meccanismo contribuisca alla riduzione della pressione arteriosa da parte degli ACE-inibitori e che sia parzialmente responsabile di alcuni effetti collaterali. Perindopril viene somministrato come perindopril sale di tert-butilamina (nota anche come erbumina) e agisce attraverso il suo metabolita attivo, il perindoprilato; gli altri metaboliti non mostrano inibizione dell’attività di ACE nelle analisi in vitro. Tra i suoi effetti farmacodinamici si annovera la riduzione delle resistenze vascolari periferiche e il conseguente aumento del flusso sanguigno periferico (senza alcun effetto sulla frequenza cardiaca). Inoltre, studi condotti in pazienti affetti da insufficienza cardiaca, hanno evidenziato una riduzione della pressione di riempimento ventricolare sinistro e destro, una diminuzione delle resistenze vascolari periferiche totali, un aumento della portata cardiaca e un miglioramento dell’indice cardiaco. Infine, in pazienti con anamnesi di infarto miocardico e/o rivascolarizzazione, riduce il rischio di eventi cardiaci (Figura 2).
3.3 Farmacocinetica
Perindopril è un farmaco somministrato per via orale, il cui assorbimento è rapido, raggiunge il picco di concentrazione entro 1 ora e ha un’emivita plasmatica di 1 ora. Essendo un profarmaco, il 27% della dose somministrata di Perindopril raggiunge il torrente circolatorio in forma di metabolita attivo perindoprilato, il cui picco di concentrazione plasmatica viene raggiunto in 3-4 ore. Esistono altri cinque metaboliti di Perindopril, tutti inattivi. L’assunzione di cibo riduce la conversione a perindoprilato e dunque la biodisponibilità. Perindopril deve essere somministrato per via orale in un’unica dose giornaliera al mattino prima di un pasto. È stata dimostrata una relazione lineare tra la dose di Perindopril e la sua esposizione plasmatica. Il volume di distribuzione del perindoprilato libero è di circa 0,2 L/kg. Il legame del perindoprilato con le proteine plasmatiche, principalmente con ACE, è del 20% ma è concentrazione-dipendente. L’eliminazione del perindoprilato libero avviene tramite urine e l’emivita terminale della frazione libera è di circa 17 ore, con il raggiungimento dello stato stazionario entro 4 giorni. L’eliminazione del perindoprilato è ridotta nell’anziano, come pure nei pazienti con insufficienza cardiaca o renale (caso in cui la posologia va aggiustata in funzione della clearance della creatinina). La clearance di dialisi del perindoprilato è di 70 ml/min. Nel paziente cirrotico, la cinetica del Perindopril viene modificata: la clearance epatica della molecola madre è ridotta della metà. Tuttavia, la quantità di perindoprilato formatasi non viene ridotta e non è quindi necessario un adattamento della posologia.
3.4 Sicurezza e tollerabilità
Il profilo di sicurezza di Perindopril è coerente con quello degli ACE-inibitori e gli eventi avversi più frequenti riportati negli studi clinici sono: capogiro, cefalea, parestesia, vertigini, disturbi visivi, tinnito, ipotensione, tosse, dispnea, dolore addominale, costipazione, diarrea, disgeusia, dispepsia, nausea, vomito, prurito, eruzione cutanea, crampi muscolari e astenia.
Perindopril è controindicato nei casi di: 1) ipersensibilità al principio attivo, a uno degli eccipienti o a qualunque altro ACE-inibitore; 2) angioedema ereditario, idiopatico o associato a precedente terapia con ACE-inibitori; 3) uso concomitante con la terapia Sacubitril/Valsartan (il trattamento con Perindopril può essere iniziato una volta trascorse 36 ore dall’ultima dose di Sacubitril/Valsartan); 4) gravidanza al secondo e terzo trimestre; 5) uso concomitante con medicinali contenenti aliskiren nei pazienti affetti da diabete mellito o compromissione renale (velocità di filtrazione glomerulare < 60 mL/min/L 1,73 m2); 6) trattamenti extracorporei che portano il sangue a contatto con superfici caricate negativamente; 7) stenosi bilaterale significativa dell’arteria renale o stenosi unilaterale in pazienti con rene unico funzionante.
Gli ACE-inibitori possono provocare una riduzione della pressione arteriosa. Raramente è stata osservata ipotensione sintomatica in pazienti con ipertensione non complicata: tale evento può manifestarsi con più probabilità in pazienti ipovolemici o con insufficienza cardiaca sintomatica (più probabile se di grado severo), associata o meno a insufficienza renale. Nei pazienti con cardiopatia ischemica o disturbi cerebrovascolari, un’eccessiva riduzione della pressione arteriosa può portare a un infarto miocardico o a un accidente cerebrovascolare. Si veda la sezione “Indicazioni e posologia” relativa a questa condizione.
Nei casi di compromissione renale la posologia iniziale del Perindopril deve essere adattata alla ClCR e devono essere monitorati i livelli di potassio. Nei pazienti con insufficienza cardiaca sintomatica, l’ipotensione conseguente all’inizio della terapia con ACE-inibitori può determinare un’ulteriore compromissione della funzionalità renale. In tale situazione, è stata segnalata insufficienza renale acuta generalmente reversibile.
L’angioedema è stato raramente segnalato in pazienti trattati con ACE-inibitori, incluso Perindopril. In questi casi, Perindopril deve essere immediatamente sospeso e il paziente tenuto sotto osservazione fino a completa risoluzione dei sintomi. Il decorso può essere più o meno grave in base alla regione coinvolta (meno grave se limitato a volto e labbra, più grave, o addirittura fatale, se di tipo laringeo). L’angioedema intestinale deve essere incluso nella diagnosi differenziale dei pazienti in trattamento con ACE-inibitori e che presentano dolore addominale. L’uso concomitante di ACE-inibitori con Sacubitril/Valsartan è controindicato a seguito dell’aumento del rischio di angioedema. Per la stessa ragione, si raccomanda cautela nell’uso concomitante di ACE-inibitori con inibitori di mTOR.
I pazienti in trattamento con ACE-inibitori nei quali compaia ittero o un aumento elevato degli enzimi epatici devono sospendere l’ACE-inibitore ed essere posti sotto stretto controllo medico a causa di una rara sindrome, dal meccanismo sconosciuto, che può evolvere in necrosi epatica fulminante.
A seguito della somministrazione di ACE-inibitori è stata segnalata la comparsa di tosse secca e persistente che si risolve alla sospensione del trattamento. La tosse indotta dagli ACE-inibitori deve essere tenuta in considerazione come parte della diagnosi differenziale della tosse.
Poiché inibiscono il rilascio dell’aldosterone, gli ACE-inibitori possono causare iperpotassiemia in particolare in quei pazienti con funzione renale compromessa e/o in pazienti che assumono integratori di potassio, diuretici risparmiatori di potassio, trimetoprim o co-trimoxazolo e specialmente antagonisti dell’aldosterone o bloccanti del recettore dell’angiotensina.
Raramente, sono state osservate reazioni anafilattoidi in risposta alla somministrazione di ACE-inibitori nel caso di pazienti sottoposti a LDL aferesi con destrano solfato, durante un trattamento desensibilizzante (e.g. veleno di imenotteri) e nei pazienti in emodialisi con membrane ad alto flusso. In questi ultimi dovrebbe essere preso in considerazione l’impiego di un tipo diverso di membrane per dialisi o di una classe diversa di agenti antipertensivi.
In pazienti trattati con ACE-inibitori sono stati segnalati casi di neutropenia/agranulocitosi/trombocitopenia e anemia. Per questa motivazione, Perindopril deve essere somministrato con estrema cautela a pazienti con collagenopatie, trattati con agenti immunosoppressori, con allopurinolo o procainamide, o che presentino una combinazione di questi fattori di complicazione, specialmente in presenza di compromissione renale preesistente.
3.5 Studi più rilevanti
- Studio EUROPA (13): Perindopril migliora significativamente l’esito di pazienti con coronaropatia stabile senza insufficienza cardiaca
Gli ACE-inibitori sono farmaci antipertensivi e cardioprotettivi; nello specifico, Perindopril, ha documentate proprietà anti-ischemiche, anti-aterosclerotiche e di rimodellamento vascolare (13). Lo studio EUROPA (EUropean trial on Reduction Of cardiac events with Perindopril in patients with stable coronary Artery disease) è stato istituito per testare l’efficacia di Perindopril in termini di riduzione della mortalità per cause cardiovascolari, infarto miocardico e arresto cardiaco, e ha coinvolto un’ampia popolazione di pazienti con coronaropatia stabile senza insufficienza cardiaca o ipertensione essenziale. Questo studio è stato uno tra i più importanti per l’impego terapeutico di Perindopril, specialmente nel contesto dei pazienti con coronaropatia stabile. Il reclutamento dei partecipanti è avvenuto tra Ottobre 1997 e Giugno 2000: tutti i soggetti erano al di sopra dei 18 anni, senza evidenze cliniche di insufficienza cardiaca ma con coronaropatia documentata da un precedente infarto miocardico (> 3 mesi), da una procedura di rivascolarizzazione coronarica percutanea o chirurgica (> 6 mesi), o con evidenza angiografica di un restringimento di almeno il 70% di una o più arterie coronarie principali.
Prima della randomizzazione, tutti i soggetti inclusi sono stati sottoposti ad un periodo di run-in in cui hanno ricevuto Perindopril 4 mg/die per due settimane (al mattino), seguite da altre due settimane alla dose di 8 mg/die (con possibilità di riduzione se questa non fosse risultata tollerata). In seguito, 6.110 pazienti sono stati assegnati al trattamento con Perindopril 8 mg e 6.108 al placebo, per una durata minima di 3 anni. Il trattamento con Perindopril poteva essere ridotto a 4 mg nel caso in cui la dose più alta non fosse stata tollerata, possibilità che si è poi verificata soltanto nel 7% dei pazienti (valutando a studio completato). I pazienti randomizzati erano perlopiù uomini (85%), con età media di 60 anni e con varie tipologie di patologie pregresse o croniche: il 65% aveva sofferto di un infarto miocardico, il 55% erano stati sottoposti a rivascolarizzazione, il 12% soffriva di diabete, il 27% era iperteso (> 160/95 mmHg, sistolica/diastolica), il 63% soffriva di ipercolesterolemia e l’1,3% aveva storia di insufficienza cardiaca congestizia. Nessuno dei pazienti aveva segni clinici di insufficienza cardiaca al momento della randomizzazione e la maggior parte dei pazienti ha assunto Perindopril o placebo in aggiunta alla terapia convenzionale (farmaci antiaggreganti piastrinici, ipolipemizzanti e beta-bloccanti). I soggetti sono stati monitorati a 3, 6 e 12 mesi dalla randomizzazione, per poi proseguire ogni 6 mesi. L’utilizzo medio del farmaco in studio è stato di 3,7 anni nei 4,2 di follow-up.
Durante il periodo di run-in, in cui tutti i pazienti ricevevano Perindopril, la pressione arteriosa era scesa da una media di 137/82 mmHg a una media di 128/78 mmHg (sistolica/diastolica). I benefici del trattamento attivo sono iniziati dopo 1 anno dall’inizio della terapia e sono andati crescendo nel corso del trial. Il trattamento con Perindopril ha comportato una significativa riduzione dell’endpoint primario, costituito dalla frequenza composita di mortalità per cause cardiovascolari, infarto non fatale e arresto cardiaco (con rianimazione riuscita). 488 (8%) pazienti del gruppo trattato con Perindopril sono andati incontro all’endpoint primario contro i 603 (10%) del gruppo placebo, per una riduzione significativa del 20% del rischio relativo e dell’1,9% del rischio assoluto (Figura 3). L’effetto benefico di Perindopril sull’endpoint primario era consistente in molti dei sottogruppi valutati (pazienti con o senza ipertensione, affetti da diabete, che hanno subito un precedente infarto miocardico o che assumono beta-bloccanti o terapia ipocolesterolemizzante). In pazienti con anamnesi di infarto miocardico e/o rivascolarizzazione, è stata osservata una riduzione significativa del 22,4% del rischio relativo e del 2,2% del rischio assoluto.
L’endpoint composito secondario – costituito dalla frequenza di mortalità totale, infarto cardiaco non fatale, angina instabile e arresto cardiaco – è risultato significativamente ridotto del 14% nel gruppo Perindopril (Figura 3). La mortalità totale è risultata ridotta dell’11%, sebbene questo calo non comportasse una significatività statistica. Rivascolarizzazione, ictus e scompenso cardiaco sono risultati poco frequenti, con un tasso rispettivo di 9,6%, 1,6% e 1,4%. L’ospedalizzazione per insufficienza cardiaca è risultata significativamente ridotta del 39% e, infine, l’insorgenza di effetti avversi specifici (tosse, ipotensione o aumento anomalo della creatinina) sono risultati poco frequenti.
In sintesi, questo studio ha mostrato che nei pazienti con coronaropatia stabile, senza insufficienza cardiaca evidente, Perindopril può migliorare significativamente l’esito cardiovascolare e l’applicazione di questo trattamento per una durata di 4 anni può significativamente prevenire l’insorgenza di eventi cardiovascolari maggiori. Come affermato dagli autori dello studio EUROPE, stando a questi esiti, il trattamento con Perindopril dovrebbe essere considerato, in aggiunta ad altri farmaci preventivi, in tutti i pazienti con coronaropatia indipendentemente dalla funzionalità cardiaca.
- Studio ASCOT-BPLA (14): il regime antipertensivo calcio-antagonista+Perindopril previene più efficacemente gli eventi cardiovascolari rispetto alla terapia beta-bloccante+diuretico
Lo studio ASCOT-BPLA (Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm) è stato un ampio trial clinico randomizzato e controllato che ha coinvolto 19.257 pazienti ipertesi, atto a confrontare la prevenzione cardiovascolare di due differenti regimi antipertensivi basati sulla combinazione di più classi di farmaci (14). Le linee guida ESC/ESH raccomandano l’impiego di più agenti antipertensivi nei molti pazienti in cui la monoterapia non è sufficiente al raggiungimento dei livelli di pressione arteriosa raccomandati (15). In questo studio è stata presa a riferimento una combinazione convenzionale di frequente utilizzo (beta-bloccante+diuretico: Atenololo+Bendroflumetiazide) e confrontata con una di più recente utilizzo quale Amlodipina+Perindopril (calcio-antagonista+ACE-inibitore). Il protocollo terapeutico prevedeva l’aggiunta del secondo farmaco (Bendroflumetiazide o Perindopril) su necessità, possibilità che si è poi verificata nel 78% dei soggetti inclusi nello studio. I partecipanti, provenienti da paesi scandinavi e anglosassoni, avevano un’età compresa tra i 40 e i 79 anni e valori di pressione sistolica/diastolica ≥ 140/90 mmHg (se già in terapia con antipertensivi) o ≥ 160/100 mmHg (se privi di terapia antipertensiva). Lo studio è durato 5,5 anni alla fine dei quali il 53% dei pazienti ha raggiunto gli obiettivi di pressione arteriosa (il 60% dei pazienti non diabetici e il 32% di quelli diabetici) per una riduzione media complessiva di 26,6/16,6 mmHg. I valori della pressione arteriosa sono risultati più bassi durante tutto lo studio nei soggetti a cui è stato somministrato il regime a base di Amlodipina+Perindopril, rispetto a coloro a cui è stato somministrato il regime a base di Atenololo+Bendroflumetiazide.
Come endpoint primario combinato è stato valutato il tasso di infarti miocardici non fatali (inclusi quelli denominati “silenti”) e malattia coronarica fatale: il gruppo Amlodipina+Perindopril ha mostrato una riduzione non significativa del 10% del rischio relativo rispetto al gruppo di confronto (Figura 4). Il gruppo trattato con Amlodipina+Perindopril ha poi mostrato una significativa riduzione di diversi endpoint secondari (Figura 4): -13% del rischio relativo di infarti miocardici non fatali (esclusi quelli “silenti”) e malattia coronarica malattia fatale, -13% del rischio relativo di eventi coronarici totali, -16% del rischio relativo di eventi e procedure cardiovascolari totali, -11% del rischio relativo di mortalità per tutte le cause, -24% del rischio relativo di mortalità cardiovascolare e -23% del rischio relativo di ictus fatale e non fatale. Il rischio relativo di insufficienza cardiaca fatale e non fatale è risultato ridotto, in modo non significativo, del 16% sempre nel gruppo Amlodipina+Perindopril (Figura 3). Infine, anche la valutazione degli endpoint terziari si è mostrata in favore del regime Amlodipina+Perindopril con una riduzione significativa del rischio relativo di angina instabile (-32%), malattia arteriosa periferica (-35%), sviluppo di diabete (-30%) e sviluppo di insufficienza renale (-15%).
La strategia antipertensiva Amlodipina+Perindopril ha prevenuto un maggior numero di eventi cardiovascolari principali e ha indotto meno diabete di nuova insorgenza rispetto al regime convenzionale di confronto. Questi effetti potrebbero non essere interamente spiegati da un migliore controllo della pressione arteriosa, come è stato poi evidenziato in un’analisi di compendio che ha valutato il ruolo di questa e altre variabili nei tassi differenziali di eventi cardiovascolari (16). La pressione arteriosa è risultata essere il maggiore singolo contributore all’insorgenza di ictus, mentre le differenze nel colesterolo HDL erano più importanti per il verificarsi di eventi coronarici.
- Studio HYVET (17): efficacia della terapia antipertensiva di diuretico+Perindopril nei pazienti ipertesi con più di 80 anni
Lo studio HYVET (Hypertension in the Very Elderly Trial), pubblicato nel 2008, è stato un altro trial clinico di grande rilevanza per l’impiego di Perindopril nel trattamento dell’ipertensione. Quest’analisi ha coinvolto esclusivamente pazienti ipertesi (sistolica > 160 mmHg) di 80 anni o più (n = 3.845), età in cui l’associazione tra pressione arteriosa e insorgenza di ictus è meno evidente rispetto a soggetti più giovani (17). Dopo la randomizzazione, i pazienti hanno ricevuto Indapamide (diuretico a rilascio prolungato, 1,5 mg) o placebo e, a ogni visita (o a discrezione del clinico), era possibile aggiungere Perindopril 2 mg o 4 mg (o il placebo corrispondente) al fine di raggiungere la pressione sanguigna target (sistolica/diastolica < 150/80 mmHg). L’endpoint primario ha valutato la frequenza di ictus fatali e non fatali lungo un follow-up medio di 1,8 anni. Alla fine dello studio, il 73,4% dei pazienti del gruppo trattato con diuretico aveva ricevuto Perindopril (2 o 4 mg) come agente antipertensivo aggiuntivo.
Il gruppo trattato ha mostrato una riduzione dei livelli di pressione sistolica/diastolica di 29,5/12,9 mmHg (vs 14,5/18/5 mmHg nel gruppo placebo) (Figura 5). L’endpoint primario (ictus fatali e non) si è verificato in 51 casi nel gruppo trattato contro i 69 del gruppo placebo, per una riduzione non significativa del 30%. Si è poi osservata una riduzione significativa del tasso del 21% di mortalità per tutte le cause, del 64% della frequenza di insufficienza cardiaca (fatale o non fatale) e del 34% di eventi cardiovascolari complessivi (morte per cause cardiovascolari, ictus, infarto del miocardio, insufficienza cardiaca), mentre il tasso di mortalità per cause cardiovascolari da solo ha mostrato una riduzione non significativa del 39%. Nei 2 anni della durata dello studio, non sono state riportate differenze significative tra i due gruppi in termini di livelli sierici di potassio, mentre un numero significativamente inferiore di eventi avversi si è verificato nei pazienti riceventi il trattamento attivo rispetto a quelli assegnati al placebo (358 vs 448).
In conclusione, questo studio mostra che il trattamento antipertensivo con diuretico+Perindopril (aggiunta che si è verificata in più del 70% dei pazienti) comporta benefici in termini di outcome nei pazienti ipertesi con 80 anni o più.
Conclusioni
Perindopril è un farmaco ACE-inibitore impiegato nel trattamento di ipertensione, insufficienza cardiaca sintomatica e coronaropatia stabile. Esso agisce attraverso un metabolita attivo che blocca la conversione di angiotensina I in angiotensina II attuata dall’enzima ACE, favorendo un effetto vasodilatatorio e riducendo il lavoro cardiaco di pre-carico e post-carico. L’impiego di Perindopril comporta le cautele di utilizzo tipiche di altri ACE-inibitori ed è per questo importante monitorare i valori pressori a inizio terapia, la funzionalità renale (da cui può dipendere la posologia) e i livelli degli elettroliti. Perindopril è stato ampiamente studiato in grandi studi clinici che ne hanno dimostrato l’efficacia antipertensiva e di prevenzione di eventi cardiovascolari in diversi profili di rischio. La terapia di combinazione con altri agenti antipertensivi è un’opzione importante nella pratica clinica e Perindopril ha mostrato evidenze di eccellente efficacia antipertensiva e cardioprotettiva in associazione ad alcuni calcio-antagonisti e diuretici.
Bibliografia
- Ames MK, Atkins CE, Pitt B. The renin-angiotensin-aldosterone system and its suppression. J Vet Intern Med. 2019 Mar;33(2):363–82.
- Patel S, Rauf A, Khan H, Abu-Izneid T. Renin-angiotensin-aldosterone (RAAS): The ubiquitous system for homeostasis and pathologies. Biomed Pharmacother. 2017 Oct;94:317–25.
- Laurent S. Antihypertensive drugs. Pharmacol Res. 2017 Oct;124:116–25.
- Ram CVS. Angiotensin receptor blockers: current status and future prospects. Am J Med. 2008 Aug;121(8):656–63.
- Borghi C, Rossi F, Trimarco B. Ruolo del sistema renina-angiotensina- aldosterone e dei farmaci che inibiscono tale sistema nelle malattie cardiovascolari: complessità e criticità. :29.
- Piepho RW. Overview of the angiotensin-converting-enzyme inhibitors. American Journal of Health-System Pharmacy. 2000 Oct 1;57(suppl_1):S3–7.
- Dzau VJ. Mechanism of action of angiotensin-converting enzyme (ACE) inhibitors in hypertension and heart failure. Role of plasma versus tissue ACE. Drugs. 1990;39 Suppl 2:11–6.
- Herman LL, Padala SA, Ahmed I, Bashir K. Angiotensin Converting Enzyme Inhibitors (ACEI). In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 [cited 2022 Jul 6]. Available from: http://www.ncbi.nlm.nih.gov/books/NBK431051/
- Petrie MC, Padmanabhan N, McDonald JE, Hillier C, Connell JM, McMurray JJ. Angiotensin converting enzyme (ACE) and non-ACE dependent angiotensin II generation in resistance arteries from patients with heart failure and coronary heart disease. J Am Coll Cardiol. 2001 Mar 15;37(4):1056–61.
- Tropeano AI, Boutouyrie P, Pannier B, Joannides R, Balkestein E, Katsahian S, et al. Brachial pressure-independent reduction in carotid stiffness after long-term angiotensin-converting enzyme inhibition in diabetic hypertensives. Hypertension. 2006 Jul;48(1):80–6.
- Agabiti-Rosei E, Heagerty AM, Rizzoni D. Effects of antihypertensive treatment on small artery remodelling. J Hypertens. 2009 Jun;27(6):1107–14.
- Lewis EJ, Hunsicker LG, Bain RP, Rohde RD. The effect of angiotensin-converting-enzyme inhibition on diabetic nephropathy. The Collaborative Study Group. N Engl J Med. 1993 Nov 11;329(20):1456–62.
- Fox KM, EURopean trial On reduction of cardiac events with Perindopril in stable coronary Artery disease Investigators. Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomised, double-blind, placebo-controlled, multicentre trial (the EUROPA study). Lancet. 2003 Sep 6;362(9386):782–8.
- Dahlöf B, Sever PS, Poulter NR, Wedel H, Beevers DG, Caulfield M, et al. Prevention of cardiovascular events with an antihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in the Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm (ASCOT-BPLA): a multicentre randomised controlled trial. Lancet. 2005 Sep 10;366(9489):895–906.
- Williams B, Mancia G, Spiering W, Agabiti Rosei E, Azizi M, Burnier M, et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension. J Hypertens. 2018 Oct;36(10):1953–2041.
- Poulter NR, Wedel H, Dahlöf B, Sever PS, Beevers DG, Caulfield M, et al. Role of blood pressure and other variables in the differential cardiovascular event rates noted in the Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm (ASCOT-BPLA). Lancet. 2005 Sep 10;366(9489):907–13.
- Beckett NS, Peters R, Fletcher AE, Staessen JA, Liu L, Dumitrascu D, et al. Treatment of hypertension in patients 80 years of age or older. N Engl J Med. 2008 May 1;358(18):1887–98.
Related papers
La medicina tradizionale basa le sue scelte e soluzioni terapeutiche sulla dimostrazione della efficacia dei farmaci quale emerge dai risultati degli studi clinici controllati che selezionano le molecole più efficaci e dettano la strategia di impiego nei pazienti in cui si presume una maggiore efficacia. Nell’ambito di questa strategia di condotta è possibile identificare due [more info]
L’insostenibile leggerezza dell’essere, splendido romando di Milan Kundera, ha come tema principale la pesantezza esistenziale. Ogni persona vive una sola volta e non si ha mai la possibilità di valutare le proprie scelte, perciò diventa difficile capire se tutto ciò che si fa nella vita è giusto o sbagliato, perché non si ha modo di [more info]
Introduzione Le malattie cardiovascolari (CV) costituiscono una delle principali cause di mortalità in tutto il mondo. Secondo l’Organizzazione Mondiale della Sanità (OMS), nel 2019 circa il 32% delle morti globali è stato attribuito a malattie cardiovascolari (1). Tra queste, ruolo predominante gioca la malattia coronarica aterosclerotica, la quale rappresenta la prima causa di mortalità e [more info]