1. Sistema Renina-Angiotensina-Aldosterone (SRAA) e ipertensione
Il Sistema Renina-Angiotensina-Aldosterone (SRAA) è un meccanismo ormonale di vitale importanza per la regolazione della pressione sanguigna e l’omeostasi idroelettrolitica. Il sistema viene innescato dalla secrezione dell’enzima renina, prodotto dai reni in risposta a stimoli quali ridotta pressione sanguigna, ipovolemia o scarsità di sodio (1). Al suo rilascio, consegue una reazione a catena che conduce alla produzione di angiotensina II ad opera dell’enzima di conversione dell’angiotensina (ACE), presente nelle cellule endoteliali dei piccoli e grandi vasi. Angiotensina II è un potente vasocostrittore, attiva il sistema simpatico e stimola la secrezione surrenalica di aldosterone con conseguente ritenzione di sodio (1). L’angiotensina II può essere sia circolante che tissutale e si lega a due tipi di recettore definiti recettore dell’angiotensina II di tipo 1 e 2 (AT1 e AT2). Dei due, AT1 – localizzato in tessuti quali muscolatura liscia, cuore, reni, aorta, cervello, adipociti e placenta – è il principale responsabile dell’aumento della pressione sanguigna (3). Al contrario, AT2 controbilancia AT1 favorendo la vasodilatazione, ma la sua espressione sembra essere limitata allo sviluppo fetale o in particolari condizioni di stress, e non è ancora ben chiaro come funzioni l’equilibrio tra l’azione di questi due recettori (4,5). Fondamentale è anche l’azione dell’aldosterone, ormone terminale del SRAA, che regola l’equilibrio dei liquidi corporei e di vari elettroliti, tra cui sodio e potassio (1). Il SRAA regola dunque la pressione sanguigna, mantiene la tonicità vascolare e l’omeostasi idroelettrolitica corporea fondamentale per un corretto funzionamento di cuore e reni, senza rispettivi sovraccarichi (2). Tuttavia, la sua attivazione cronica, in molteplici patologie, comporta svariati effetti negativi, soprattutto a livello cardiovascolare.
L’iperattivazione del SRAA ha un’azione fortemente vasocostrittiva, ipertrofica, pro-fibrotica e pro-infiammatoria, a livello della muscolatura liscia, e conduce all’ipertensione sistemica e al rimodellamento dei tessuti cardiovascolari e renali. Inoltre favorisce l’insorgenza e la progressione del danno cardiovascolare in patologie quali ipertensione, infarto miocardico acuto e insufficienza cardiaca cronica. L’attivazione cronica del SRAA è anche coinvolta nello sviluppo di malattie renali croniche, complicazioni epatiche (alimentate dall’azione pro-infiammatoria), obesità (per l’azione sugli adipociti), diabete e disturbi del sistema nervoso (2). Di fatto, la disregolazione del SRAA alimenta il rischio cardiovascolare e di danno d’organo a cui conseguono eventi clinici anche fatali. Per questa ragione, sono molti i farmaci ideati per agire sull’iperattivazione del SRAA: gli ACE-inibitori impediscono la conversione di angiotensina I in angiotensina II; i sartani bloccano il legame dell’angiotensina II al suo recettore AT1 (per questo noti in inglese come ARBs, Angiotensin II Receptor Blockers); e, infine, gli antagonisti dei recettori dei mineralcorticoidi agiscono a valle, frenando le conseguenze dell’azione dell’aldosterone.
2. Farmaci antipertensivi: antagonisti del recettore dell’angiotensina II o sartani
Il primo antagonista del recettore dell’angiotensina II ad essere approvato è stato Losartan, poi seguito da diversi altri quali Valsartan, Olmesartan, Irbesartan e Candesartan. Come anche gli ACE-inibitori, questi farmaci vengono assunti per via orale ma le differenze nella loro struttura molecolare si traduce in una diversa affinità di legame al recettore e in differenti profili farmacocinetici. I sartani si legano al recettore AT1 impedendo l’interazione con il ligando naturale e riducendo la pressione sanguigna attraverso il rilasciamento della muscolatura liscia dei vasi, l’escrezione di sale e acqua e la riduzione del volume del plasma (6). Nella loro azione antipertensiva, i sartani non alterano gittata e frequenza cardiaca e, nonostante l’abbassamento della pressione, non sembrano indurre ipotensione posturale (3). La dissociazione dal recettore è molto lenta, fattore da tenere in considerazione nella farmacocinetica del principio attivo (7). La maggior parte dei sartani commercialmente disponibili controlla la pressione sanguigna sulle 24 ore anche con una singola somministrazione giornaliera, senza alterare il ritmo circadiano, e la loro efficacia persiste nei trattamenti a lungo termine, senza evidenze di tachifilassi (6). I sartani apportano svariati benefici cardiovascolari tra cui: 1) riduzione dell’ipertrofia ventricolare sinistra, 2) miglioramento della funzione diastolica, 3) riduzione della dispersione anomala del QT nell’elettrocardiogramma, 4) miglioramento della disfunzione endoteliale e 5) miglioramento della capacitanza delle grandi arterie (6). I sartani sono infatti raccomandati nei pazienti con scompenso cardiaco e frazione di eiezione ridotta intolleranti agli ACE-inibitori. Lo studio Val-HeFT ha mostrato come l’aggiunta di Valsartan alla terapia standard riducesse le ospedalizzazioni per scompenso e, nello studio CHARM-Alternative, Candesartan ha ridotto sia le ospedalizzazioni per scompenso che la mortalità cardiovascolare. L’unico dei sartani ad essere impiegato nella gestione dei pazienti che hanno subito un recente infarto del miocardio è Valsartan, che nello studio VALIANT ha dimostrato un’efficacia sovrapponibile a quella di un ACE-inibitore.
I sartani sono stati sviluppati per superare alcuni limiti del meccanismo d’azione degli ACE-inibitori, che infatti modulano la produzione di angiotensina II, impedendo la conversione da angiotensina I, ma falliscono nel sopprimerne la produzione da parte di vie enzimatiche alternative (3). Inoltre, gli ACE-inibitori sono causa di un aumento della concentrazione plasmatica di bradichinina, fattore correlato ad alcuni degli effetti collaterali tipici quali tosse secca e rischio di angioedema. Quest’ultima è una reazione rara, ma comunque pericolosa, che può manifestarsi nelle prime settimane di terapia. Rispetto agli ACE-inibitori, i sartani agiscono più a valle e sono associati ad un minor rischio – ma non nullo – di tosse secca e angioedema (7). L’efficacia dei sartani è pari a quella degli ACE-inibitori nel trattamento contro l’ipertensione, sia moderata che severa, e cresce all’aumentare della dose. A inizio terapia, i sartani possono apparire meno efficaci degli ACE-inibitori, in cui però il rischio di ipotensione iniziale è maggiore (7).
Gli antagonisti del recettore dell’angiotensina II sono generalmente farmaci ben tollerati: non compromettono la regolazione del flusso ematico cerebrale, il metabolismo del glucosio o dei lipidi, non provocano alterazioni clinicamente significative delle misure di laboratorio di chimica del siero, ematologia e analisi delle urine (6). Il trattamento con sartani prevede l’impiego di una dose iniziale che va poi titolata a raggiungimento della dose target o del massimo dosaggio tollerato. Il loro utilizzo richiede cautela nei pazienti affetti da malattia renale cronica e insufficienza cardiaca, o diabete, e che ricevono diuretici risparmiatori di potassio o integratori di potassio, poiché possono causare iperkaliemia (7). Nei pazienti trattati con sartani da lungo tempo, è importante considerare che l’interruzione brusca della terapia può causare un improvviso aumento della pressione. Alcuni effetti collaterali comuni sono mal di testa, vertigine, astenia e infiammazione delle vie respiratorie superiori (5). I sartani sono infine sconsigliati in gravidanza a causa della loro tossicità fetale.
3. Valsartan
3.1. Indicazioni e posologia
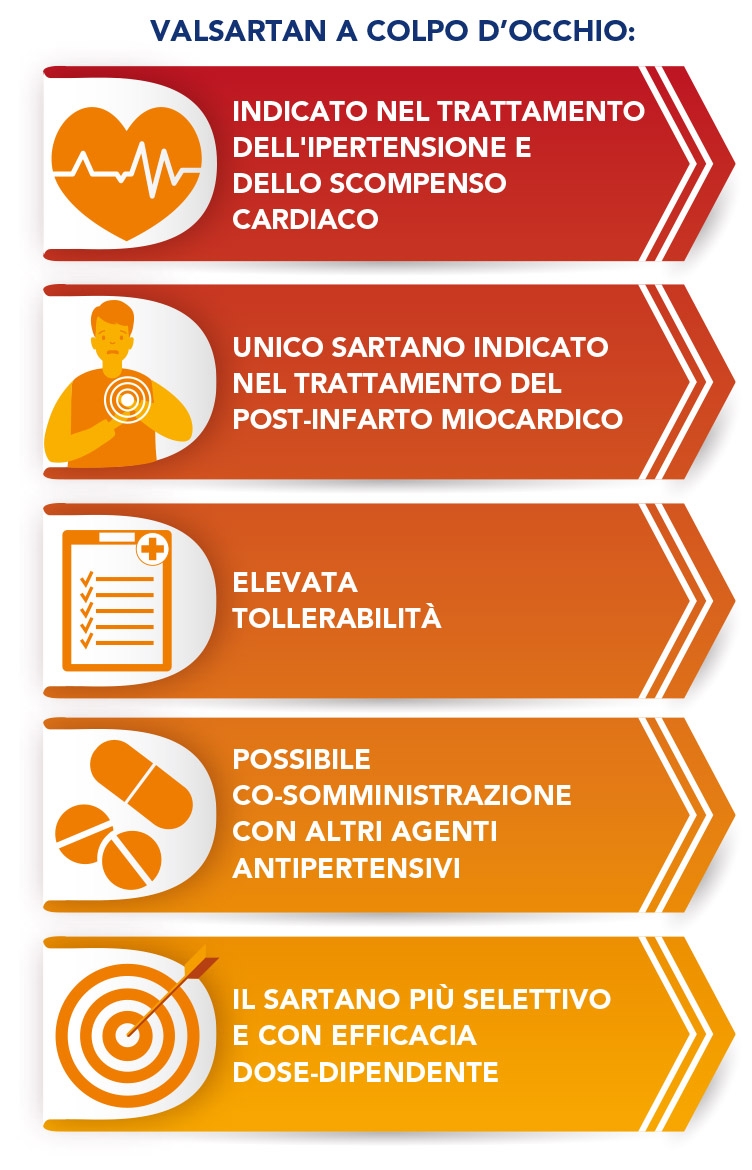
Valsartan (Figura 1) è il secondo bloccante del recettore dell’angiotensina II, dopo Losartan, ad essere stato approvato negli Stati Uniti (nel 1996) per il trattamento dell’ipertensione. La prevenzione cardiovascolare attuata da Valsartan va oltre il controllo pressorio: il suo impiego è stato infatti esteso al trattamento dell’insufficienza cardiaca, quando gli ACE-inibitori non sono tollerati, ed è l’unico sartano indicato nella gestione del paziente dopo infarto del miocardio (8). Valsartan attua una protezione multiorgano agendo a livello cardiovascolare e renale; numerosi studi ne comprovano l’efficacia antipertensiva in anziani, bambini, varie popolazioni etniche e nei pazienti con patologie cardiologiche, nefrologiche o metaboliche. Infine, nei pazienti ipertesi, Valsartan si è dimostrato capace d’invertire l’irrigidimento aortico, indipendentemente dalle variazioni della pressione sanguigna (9), e di ridurre il rischio di diabete (10).
Valsartan ha un’efficacia dose-dipendente nel ridurre sia la pressione sistolica che diastolica nei dosaggi giornalieri tra gli 80 e i 320 mg. Le indicazioni sulla posologia variano in base alle sottocategorie di popolazione trattate, come emerge dalle indicazioni dell’RCP di Valsartan approvato dall’Agenzia Italiana del Farmaco (AIFA) e riportate qui di seguito. Per i pazienti ipertesi, la dose iniziale raccomandata corrisponde a 80 mg una volta al giorno; l’effetto antipertensivo necessiterà solitamente di 2 settimane per manifestarsi, mentre l’efficacia massima verrà raggiunta entro le 4 settimane. Nel caso in cui i pazienti non dovessero raggiungere i valori pressori target, la dose può essere aumentata fino ad un massimo di 320 mg (11). Si consiglia sempre di aggiustare la dose in base alla risposta della pressione arteriosa. Nei pazienti che hanno subito infarto del miocardio, clinicamente stabili, la terapia iniziale consigliata è di 20 mg due volte al giorno. Invece, nei pazienti affetti da insufficienza cardiaca, la dose iniziale è di 40 mg due volte al giorno. In entrambi i casi − infarto del miocardio e insufficienza cardiaca − la dose andrà poi gradualmente aumentata fino al raggiungimento della dose target non oltre la quantità di una compressa da 160 mg due volte al giorno. Un discorso a parte va fatto per la somministrazione di Valsartan nella popolazione pediatrica (6-18 anni): nei bambini di peso inferiore a 35 kg la dose iniziale consigliata è di 40 mg una volta al giorno, che aumenta a 80 mg per bambini con un peso superiore. Le dosi massime studiate nei bambini sono di 80 mg per quelli che hanno un peso compreso tra 18 e 35 kg, di 160 mg tra i 35 e gli 80 kg e di 320 mg se il peso è superiore. La sicurezza e l’efficacia di Valsartan nei bambini di età inferiore a 6 anni non sono state stabilite, come anche l’utilizzo per il trattamento di pazienti di 6-18 anni con scompenso cardiaco o con infarto miocardico: il farmaco non è quindi raccomandato in queste popolazioni.
Se il paziente non raggiunge i livelli target di pressione sanguigna, va considerata la combinazione di Valsartan con altri agenti antipertensivi, con meccanismi d’azione differenti, per ottenere un’azione sinergica (12). Valsartan può essere inoltre somministrato con altre terapie per l’insufficienza cardiaca e per l’infarto miocardico (trombolitici, acido acetilsalicilico, beta-bloccanti, statine e diuretici). L’utilizzo concomitante di Valsartan (o dei sartani in generale) con ACE-inibitori non è raccomandato poiché entrambe le classi di farmaci agiscono sull’attività dell’angiotensina II aumentando il rischio di ipotensione, di iperpotassiemia e di riduzione della funzionalità renale (sconsigliata la co-somministrazione nei pazienti con nefropatia diabetica). Ciononostante, ci sono evidenze di un vantaggio di questo abbinamento in casi d’insufficienza cardiaca (13). Valsartan può essere inoltre associato ad Amlodipina (farmaco calcio-antagonista), a Idroclorotiazide o altri diuretici, tenendo presente che questa combinazione diminuirà ulteriormente la pressione sanguigna. La tripla associazione di un ACE-inibitore, Valsartan e un beta-bloccante o un diuretico risparmiatore di potassio non è raccomandata. È infine rilevante menzionare che Valsartan esiste sul mercato in associazione con Sacubitril, un inibitore della neprilisina, con cui agisce in maniera complementare per il trattamento dell’insufficienza cardiaca sintomatica cronica con frazione di eiezione ridotta. Questa combinazione di farmaci è stata definita ARNI (Angiotensin Receptor Neprilysin Inhibitor).
3.2. Meccanismo d’azione
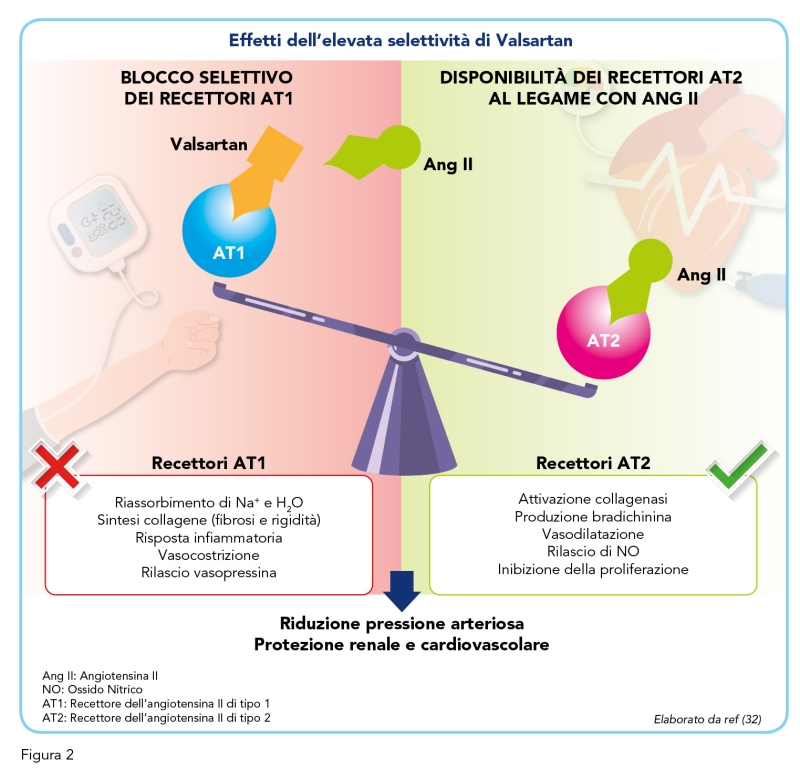
Valsartan è un antagonista non peptidico e non eterociclico la cui formula chimica è simile a quella del Losartan ma in cui l’imidazolo è stato sostituito con un aminoacido acetilato (Figura 1). I suoi effetti antipertensivi in monoterapia sono comparabili a quelli di altri sartani, ACE-inibitori, diuretici, beta-bloccanti e calcio-antagonisti (12). Valsartan non altera la frequenza cardiaca e non ha bisogno di essere metabolizzato per essere efficace (14). Valsartan, come tutti i sartani, si lega selettivamente al recettore AT1 bloccando la cascata di reazioni che porterebbe alla vasocostrizione e all’aumento del volume di sangue circolante – tramite il rilascio di aldosterone dalle ghiandole surrenali – risultando in un aumento della pressione sanguigna (Figura 2). La sua affinità al recettore AT1 è almeno 20.000 volte superiore a quella per AT2, rendendolo il sartano più selettivo di tutta la classe (15). È inoltre possibile che l’aumento di angiotensina II plasmatica stimoli i recettori AT2 non bloccati i quali, contrariamente ad AT1, favoriscono la vasodilatazione contribuendo all’effetto terapeutico generale (16). Non è noto se Valsartan si leghi o blocchi altri recettori ormonali o canali ionici conosciuti che agiscono sulla regolazione cardiovascolare; sembra però mancare di affinità per i recettori adrenergici, di istamina, di sostanza P, muscarinici e di serotonina (14). Poiché Valsartan non agisce su ACE, l’attività catalitica di questo sulla bradichinina è mantenuta, ed è quindi meno probabile che questa classe di farmaci sia associata a tosse.
3.3. Farmacocinetica
Valsartan viene assorbito rapidamente dal tratto gastrointestinale dopo la somministrazione orale e ha una biodisponibilità media del 23% con elevata variabilità (7). Secondo le indicazioni fornite dagli RCP del farmaco, il picco di concentrazione di Valsartan viene raggiunto dopo 2−4 ore quando il farmaco è assunto da solo. L’assunzione di cibo riduce il picco di concentrazione plasmatica di circa il 50% e la sua esposizione totale (misurata come AUC) del 40%. Questo, però, non ne compromette significativamente l’effetto terapeutico, ragion per cui Valsartan può essere assunto con o senza cibo. Il volume di distribuzione di Valsartan allo stato stazionario, dopo somministrazione endovenosa, è di circa 17L, il che indica che Valsartan non si distribuisce ampiamente nei tessuti. Questo farmaco è altamente legato alle proteine sieriche (94−97%), in particolar modo all’albumina. A pH fisiologico, Valsartan è solubile e principalmente presente nella forma ionizzata (17). Valsartan non viene biotrasformato in misura elevata, in quanto soltanto il ~20% della dose viene recuperato sotto forma di metaboliti. Nel plasma sono state identificate basse concentrazioni (meno del 10% dell’AUC di Valsartan) di un suo metabolita idrossilato e farmacologicamente inattivo. Circa il 10% di una dose di Valsartan viene metabolizzata dal fegato, sebbene non è noto quali siano gli enzimi responsabili (7), e il citocromo P450 non sembra essere primariamente coinvolto nel suo metabolismo (8). L’eliminazione avviene principalmente tramite la bile per via fecale (più dell’80% della dose) e in misura minore attraverso le urine (13%), in gran parte come farmaco invariato (7). L’emivita del farmaco è tra le 6 e le 9 ore, ma la sua capacità di ridurre la pressione nelle 24 ore è mantenuta se assunto una volta al giorno.
3.4. Sicurezza e tollerabilità
Valsartan è un farmaco generalmente ben tollerato e gli effetti collaterali − specie a basse dosi − sono poco comuni, ma possono includere mal di testa, vertigini, affaticamento, tosse, disturbi gastrointestinali e tossicità fetale (8). Ad esempio, alla dose di 320 mg/giorno, il 9,3% dei pazienti ha riportato di provare vertigini contro il 3,4% nel caso di dosi più basse (80−160 mg/giorno) (7). Le manifestazioni immunoallergiche (rash, febbre, eosinofilia) sono poco comuni (8), ma l’ipersensibilità al principio attivo o ad uno dei suoi eccipienti rientra tra le controindicazioni primarie di Valsartan.
L’uso di Valsartan è controindicato nei pazienti sia adulti che pediatrici con compromissione epatica grave, cirrosi biliare e nei pazienti con colestasi mentre, se la compromissione è lieve o moderata in assenza di colestasi, può essere somministrato fino a 80 mg/die. Sono stati riportati rari casi di danno epatico acuto associato a questa terapia, presumibilmente dovuti a una reazione di ipersensibilità che ha causato aumenti transitori di aminotransferasi nel siero, senza sfociare né in un’insufficienza epatica acuta né in un danno epatico cronico (8). L’uso concomitante di Valsartan e Aliskiren (inibitore della renina) è controindicato nei pazienti con compromissione renale e velocità di filtrazione glomerulare inferiore a 60 mL/min/1,73 m2, mentre non è richiesto un aggiustamento della dose nei pazienti con clearance della creatinina maggiore a 10 mL/min, se adulti, o maggiore a 30 mL/min, se pediatrici. Non esistono dati clinici nei pazienti pediatrici in caso di livelli di clearance inferiori a 30 mL/min; pertanto, Valsartan non è consigliato in tali pazienti.
Si sconsiglia l’associazione di Valsartan con tutte quelle sostanze che possono aumentare i livelli di potassio (integratori, diuretici risparmiatori di potassio, etc.) e, qualora fosse necessario, si raccomanda di monitorarne i livelli sierici. Nell’utilizzo concomitante con ACE-inibitori sono stati riportati aumenti tossici di litio. La co-somministrazione con diuretici, in pazienti sodio- e/o volume-depleti, può risultare in un abbassamento sintomatico della pressione. In caso di associazione di Valsartan a FANS (farmaci antinfiammatori non steroidei), può verificarsi un’attenuazione dell’effetto antipertensivo e può inoltre aumentare il rischio di peggioramento della funzionalità renale e indurre un aumento del potassio sierico. Se il paziente presenta iperaldosteronismo primario, non deve essere trattato con Valsartan in quanto, in questo caso, il SRAA non è attivato.
3.5. Studi più rilevanti:
• Studio VALUE: efficacia di Valsartan sul rischio cardiovascolare a lungo termine nei pazienti ipertesi
Lo studio VALUE (Valsartan Antihypertensive Long-term Use Evaluation) è un ampio studio multicentrico, in doppio cieco, randomizzato, prospettico in cui è stato comparato, a parità di controllo pressorio, il rischio cardiovascolare a lungo termine di Valsartan e Amlodipina. 13.449 pazienti ipertesi (>50 anni) sono stati arruolati, assegnati ai due gruppi di trattamento e seguiti per una media di 4,2 anni (18,19). Al fine di raggiungere valori pressori sistolici/diastolici ottimali (<140/90 mmHg), era previsto il possibile raddoppio delle dosi in monoterapia (da 80 a 160 mg per Valsartan e da 5 a 10 mg per Amlodipina), l’aggiunta di Idroclorotiazide 12,5 mg (anch’esso raddoppiabile) e, nel caso, di un altro farmaco antipertensivo a scelta (eccetto un altro sartano/calcio-antagonista o ACE-inibitore). All’inizio dello studio, solo il 18,9% dei pazienti possedeva valori pressori adeguati, con una media di 153,5/86,9 mmHg nei pazienti che stavano già ricevendo una terapia antipertensiva, e di 168,1/95,3 mmHg nei restanti (19). Dopo 30 mesi questa percentuale era salita al 60,5%, dato rappresentativo di come un protocollo strutturato e con obiettivi definiti sia fondamentale per raggiungere un controllo ottimale della pressione arteriosa (19). Le differenze nel controllo pressorio a favore di Amlodipina registrate nei primi 6 mesi, tendevano poi ad annullarsi nella parte successiva dello studio.
Nell’incidenza dell’endpoint primario combinato morbilità/mortalità cardiaca, il confronto dei due farmaci non ha mostrato differenze significative (18). Relativamente agli endpoint secondari, Valsartan ha mostrato una tendenza verso una ridotta incidenza di ospedalizzazione per scompenso cardiaco rispetto ad Amlodipina (4,6% vs 5,3%; P=0,12) e l’infarto del miocardio è risultato significativamente meno frequente nel trattamento con Amlodipina (4,1% vs 4,8%; P=0,02) (18), esito spiegabile da una minore riduzione pressoria nel trattamento con Valsartan (80 mg), non adeguata nei pazienti ad alto rischio. Valsartan ha ridotto, rispetto ad Amlodipina, il rischio d’insorgenza di fibrillazione atriale (3,67% vs 4,34%, P<0,05), in particolare nella sua forma persistente (1,35% vs 1,97%, P<0,005) (20) e ridotto la frequenza di diabete di nuova insorgenza (9,8% vs 11,8%; P=0,001) (10).
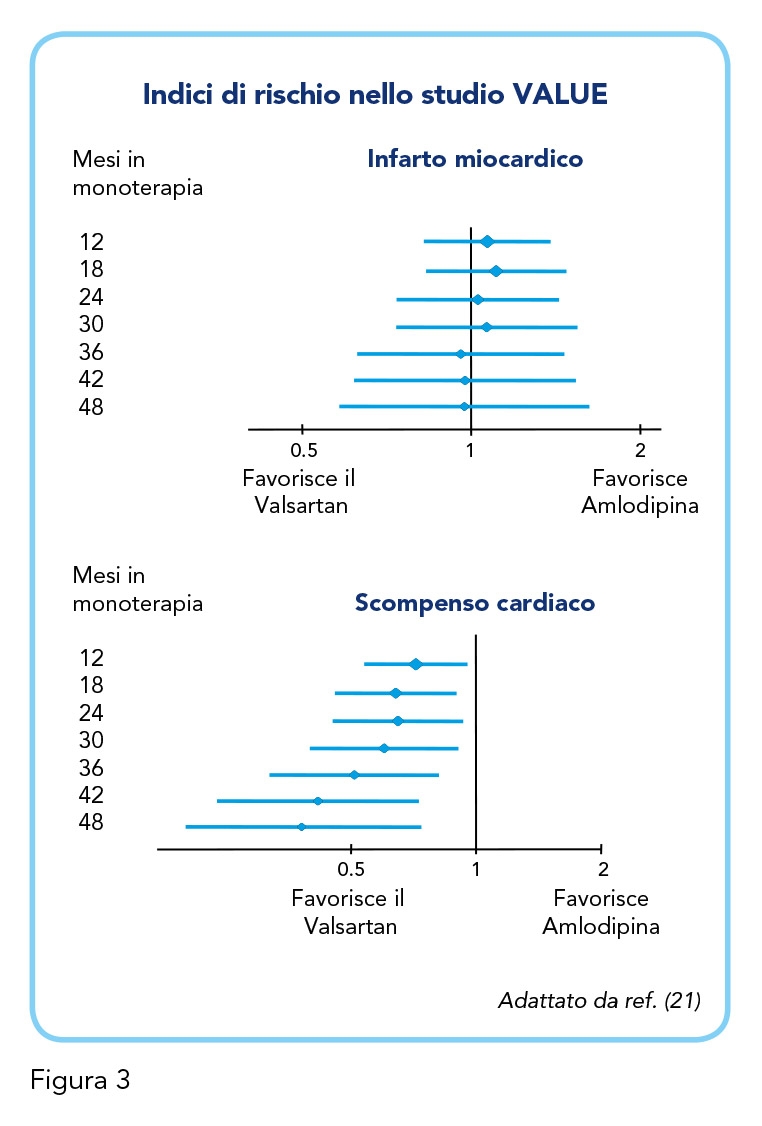
Una sotto-analisi di 7.080 pazienti ha successivamente confrontato gli endpoint primari e secondari dei pazienti nei gruppi in monoterapia. Sono stati inclusi coloro che, al termine di un periodo di 6 mesi previsto dal disegno dello studio, avevano raggiunto e mantenuto i valori pressori target in monoterapia. Il tasso di eventi cardiovascolari nei gruppi in monoterapia sono risultati di 16-39% in meno rispetto allo studio VALUE principale (21), mentre il confronto tra due farmaci i non ha mostrato significative differenze nell’endpoint primario composito (ictus, infarto miocardico e morte per tutte le cause) nella popolazione selezionata. Rispetto agli endpoint secondari, si è osservata una riduzione significativa dell’incidenza di ospedalizzazione per scompenso cardiaco nella monoterapia con Valsartan rispetto a Amlodipina (P<0,05), spiccatamente evidente negli esiti a lungo termine (Figura 3) (21). Riguardo ai possibili effetti avversi, sia lo studio VALUE che un altro studio (18, 22) hanno mostrato una migliore tollerabilità da parte di Valsartan rispetto ad Amlodipina (20,2% vs 31,9%; P<0,005), in particolar modo per quanto riguarda l’incidenza di edema, nettamente più frequente nel gruppo Amlodipina (26,8% vs 4,8%; P<0,001) (22). In conclusione, lo studio VALUE – rilevante sia per metodo, durata che ampiezza del campione – ha corroborato le evidenze di efficacia antipertensiva e di protezione cardiovascolare e metabolica di Valsartan.
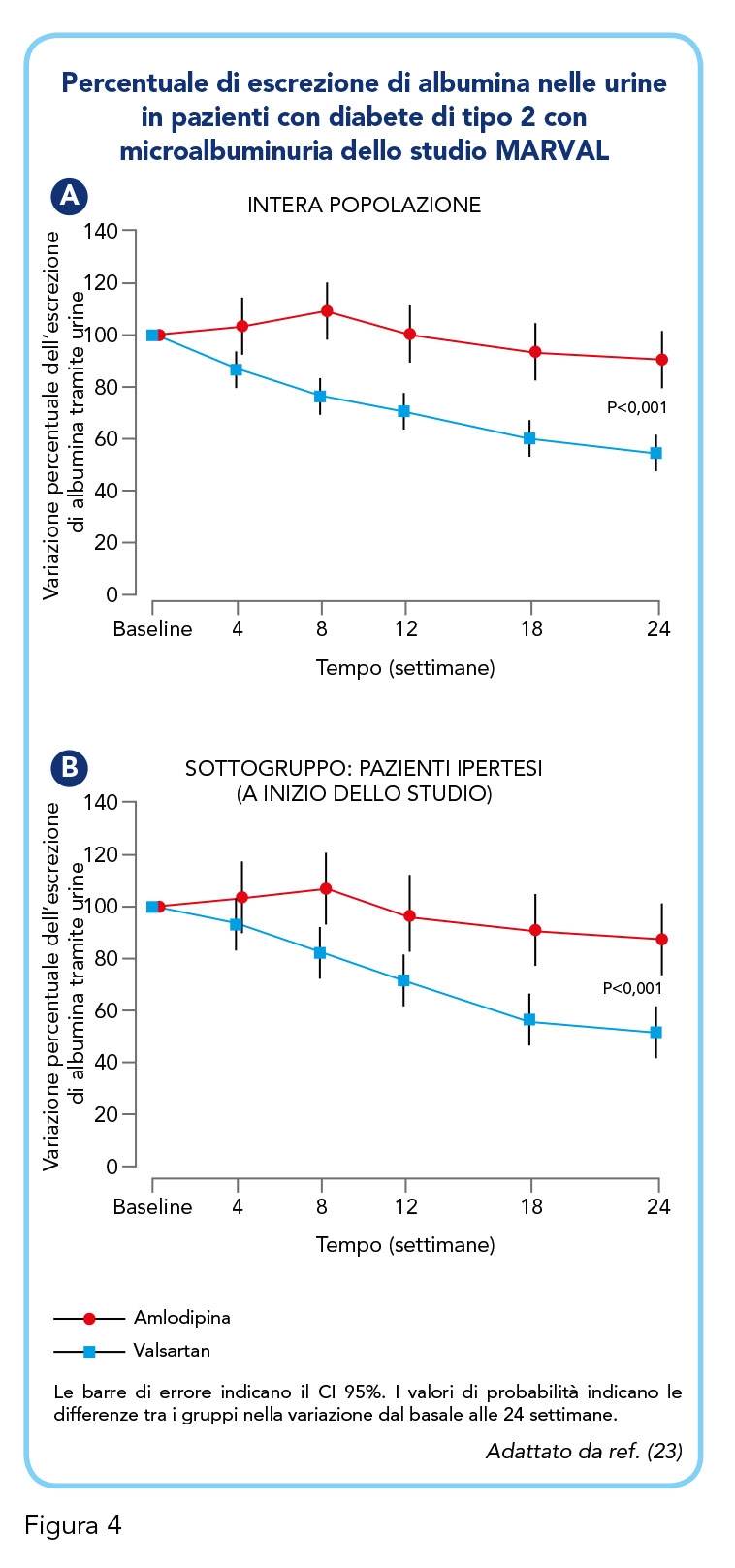
• Studio MARVAL: Valsartan come agente contro la microalbuminuria nei pazienti diabetici ipertesi
Lo studio MARVAL (MicroAlbuminuria Reduction with VALsartan) è stato progettato per valutare l’effetto di Valsartan sull’escrezione di albumina nelle urine, un importante fattore di rischio renale e cardiovascolare, nei pazienti con diabete di tipo 2. L’albumina, proteina tipicamente plasmatica, dovrebbe essere quasi assente nelle urine e la sua presenza, anche in scarsa quantità (microalbuminuria), è indice di nefropatia diabetica. Il blocco del SRAA riduce la microalbuminuria, ma non era chiaro se questo effetto fosse dipendente o meno dalla riduzione della pressione sanguigna. In questo studio, sono stati coinvolti pazienti con diabete di tipo 2 e microalbuminuria, con o senza ipertensione, e assegnati casualmente a una terapia con Valsartan 80-160 mg/die o con Amlodipina 5-10 mg/die per 24 settimane (23). Valsartan si è rivelato efficace nel ridurre la microalbuminuria (Figura 4): solo il 56% dei pazienti presentava microalbuminuria dopo il trattamento, rispetto al 92% del gruppo con Amlodipina (P<0,001). Inoltre, il 29,9% dei pazienti del gruppo Valsartan è tornato a normoalbuminuria, rispetto al 14,5% del gruppo Amlodipina (P=0,001). La riduzione della pressione arteriosa è risultata comparabile nei due gruppi (sistolica/diastolica: -11,2/-6,6 mmHg per Valsartan, -11,6/-6,5 mmHg per Amlodipina), congruentemente con l’esito dello studio VALUE precedentemente menzionato (19, 24).
Un altro studio (DROP; Diovan Reduction Of Proteinuria) ha successivamente esplorato quale dose di Valsartan fosse più efficace nella riduzione dell’albuminuria (25). Sono stati selezionati pazienti con diabete di tipo 2, albuminuria pari a 20–700 µg/min e ipertensione (>90/140 mmHg), randomizzati in tre gruppi di trattamento (160 mg, 320 mg e 640 mg* di Valsartan) e seguiti per 30 settimane. Elevate dosi di Valsartan hanno ridotto più efficacemente l’albuminuria rispetto alla dose da 160 mg, indipendentemente dalla pressione sanguigna (25): alla 30esima settimana, la variazione percentuale di albuminuria dal basale era del 25% nel gruppo a 160 mg, del 51% nel gruppo a 320 mg e del 49% nel gruppo a 640 mg*. Il 24,3% dei pazienti sono tornati a livelli di albuminuria normale con la dose da 640 mg* rispetto al 12,4% di quella a 160 mg (P<0,01). Tutte le dosi di Valsartan hanno significativamente ridotto la pressione sanguigna (P<0,001) e quella a 640 mg* ha permesso di raggiungere i livelli pressori target in una maggiore percentuale di pazienti rispetto alle altre due che sono risultate simili (34% vs 25% P=0,019). Nei 108 pazienti che hanno raggiunto valori pressori target (<80/130 mmHg), la riduzione di albuminuria è risultata maggiormente significativa alla dose di 640 mg* vs 160 mg (25).
* Dose non approvata per l’ipertensione, né commercializzata in Europa.
• Studi VALIANT e Val-HeFT: efficacia di Valsartan nel trattamento del post-infarto miocardico e dello scompenso cardiaco
Lo studio VALIANT (VALsartan In Acute myocardial iNfarcTion) ha valutato l’efficacia di Valsartan nel trattamento dell’infarto recente del miocardio, confrontandola a quella di Captorpil, un ACE-inibitore (26). Gli ACE-inibitori riducono il rischio di eventi come l’infarto del miocardio e, precedentemente allo studio VALIANT, non era noto se anche i sartani esibissero questa caratteristica. È possibile, infatti, che l’aumento di bradichinina, dovuto alla mancata scissione di questa molecola da parte dell’enzima ACE, e l’aumentata stimolazione del recettore AT2, conseguente al blocco del recettore AT1, inducano entrambi ulteriori effetti di protezione cardiovascolare (e.g. vasodilatazione). Allo scopo di investigare questa possibilità, è stata confrontata la frequenza di eventi in pazienti trattati con Captopril (n=4.909), Valsartan (n=4.909) o la loro combinazione (n=4.885) su una popolazione di 14.703 individui. VALIANT ha rappresentato la più grande coorte di pazienti con scompenso cardiaco o disfunzione sistolica ventricolare sinistra dopo infarto miocardico ad essere inserita in uno studio controllato randomizzato (26). Al follow-up (effettuato ad una mediana di 24,7 mesi dall’inizio dello studio), l’incidenza della mortalità per tutte le cause è risultata essere statisticamente comparabile nei tre gruppi (Figura 5) (27). La pressione sistolica/diastolica media era di 127/76 mmHg nel gruppo Captopril, 127/75 mmHg nel gruppo Valsartan e 125/75 mmHg nel gruppo combinato. Rispetto a Captopril, la pressione arteriosa è risultata lievemente inferiore nel gruppo Valsartan (-0,9 mmHg; P<0,001), e ulteriormente piu bassa con la combinazione dei due farmaci (-2,2 mmHg; P<0,001). In conclusione, Valsartan ha un’efficacia comparabile a quella di un ACE-inibitore, come Captopril, nel ridurre i tassi di mortalità nei pazienti ad alto rischio dopo un infarto miocardico.
Lo studio Val-HeFT (Valsartan-Heart Failure Trial) ha invece vagliato la possibilità di aggiungere Valsartan alla terapia standard con ACE-inibitori per lo scompenso cardiaco (13). Sono stati confrontati 1.532 pazienti che hanno ricevuto il supplemento di questo sartano (da due dosi di 40−160 mg) contro 1.502 assegnati al placebo (13). La mortalità è risultata comparabile tra i due gruppi (21,8% vs 22,5%) mentre gli endpoint di morbilità (arresto cardiaco, ricovero per scompenso, somministrazione di agenti cardiovascolari inotropi o vasodilatatori ≥ 4 ore) sono risultati inferiori nel gruppo Valsartan (31,0% vs 36,3%, P=0,002) nei pazienti riceventi ACE-inibitori ma non beta-bloccanti (Figura 6). Valsartan ha inoltre ridotto significativamente la pressione sanguigna sistolica/diastolica (-7,37/-4,85 mmHg Valsartan vs -3,94/-3,44 mmHg placebo), il diametro ventricolare sinistro in diastole (-0,08 cm/m2 Valsartan vs -0,03 cm/m2 placebo) e aumentato la frazione di eiezione (+3,88% Valsartan vs + 2,72% placebo). Tutti questi effetti benefici cardiovascolari sono perdurati lungo tutto il decorso dello studio, avvalorando l’esito positivo apportato dall’aggiunta di questo sartano. Nella valutazione dei livelli circolanti di noradrenalina (NA), di peptide natriuretico di tipo B (BNP) e di aldosterone − considerati fattori prognostici di morbilità e mortalità cardiovascolare − il trattamento con Valsartan ha mostrato livelli finali significativamente inferiori per ciascuno di questi marker rispetto al placebo (NA: 462,4 pg/mL vs 505,1 pg/mL; BNP: 154,9 pg/mL vs 197,0 pg/mL; aldosterone: 114,0 pg/mL vs 160,8 pg/mL), congruentemente con l’efficacia cardioprotettiva di questo farmaco (13). È anche stato ipotizzato che la disattivazione neuroendocrina dovuta alla diminuzione di NA e BNP avesse un ruolo significativo nella progressione dello scompenso cardiaco (28). In successive rianalisi, si è anche mostrato come Valsartan avesse significativamente ridotto i livelli di proteina C reattiva, marker critico d’infiammazione vascolare (29). Infine, è stata osservata una diminuzione del 53% dei ricoveri per scompenso cardiaco (30), una riduzione del 37% del rischio di sviluppo di fibrillazione atriale (31) e, infine, una migliore qualità di vita percepita, valutata tramite questionario, nei pazienti trattati con Valsartan (13).
3.6 Conclusioni
Valsartan è un farmaco antipertensivo appartenente alla classe dei sartani, o bloccanti del recettore AT1 dell’angiotensina II, farmaci con una documentata efficacia antipertensiva legata principalmente ai loro effetti di vasodilatazione, induzione di natriuresi con conseguente riduzione della volemia e riduzione del tono simpatico.
L’azione antipertensiva di Valsartan è comparabile a quella degli ACE-inibitori (27), ma con una riduzione del rischio di alcuni tipici effetti collaterali di questi farmaci quali tosse secca e angioedema. Valsartan è un farmaco ben tollerato, che può essere utilizzato in monoterapia o, se necessario, in combinazione con altri farmaci antipertensivi quali diuretici e calcio antagonisti.
Oltre che per il trattamento dell’ipertensione, Valsartan è l’unico sartano ad essere indicato nel trattamento dell’infarto miocardico recente e viene impiegato nel trattamento dell’insufficienza cardiaca nei pazienti intolleranti agli ACE-inibitori. Valsartan inoltre ha una documentata efficacia in termini di nefroprotezione nei pazienti ipertesi e di riduzione della proteinuria.
In conclusione, Valsartan risulta essere uno strumento farmacologico versatile e maneggevole di indiscutibile utilità nella gestione dei pazienti con problematiche cardiovascolari, renali e metaboliche.
Bibliografia
- Ames MK, Atkins CE, Pitt B. The renin-angiotensin-aldosterone system and its suppression. J Vet Intern Med. 2019 Mar;33(2):363–82.
- Patel S, Rauf A, Khan H, Abu-Izneid T. Renin-angiotensin-aldosterone (RAAS): The ubiquitous system for homeostasis and pathologies. Biomed Pharmacother. 2017 Oct;94:317–25.
- Laurent S. Antihypertensive drugs. Pharmacol Res. 2017 Oct;124:116–25.
- Ram CVS. Angiotensin receptor blockers: current status and future prospects. Am J Med. 2008 Aug;121(8):656–63.
- Hernández-Hernández R, Sosa-Canache B, Velasco M, Armas-Hernández MJ, Armas-Padilla MC, Cammarata R. Angiotensin II receptor antagonists role in arterial hypertension. J Hum Hypertens. 2002 Mar;16 Suppl 1:S93-99.
- Israili ZH. Clinical pharmacokinetics of angiotensin II (AT1) receptor blockers in hypertension. J Hum Hypertens. 2000 Apr;14 Suppl 1:S73-86.
- Dina R, Jafari M. Angiotensin II-receptor antagonists: an overview. Am J Health Syst Pharm. 2000 Jul 1;57(13):1231–41.
- Angiotensin II Receptor Antagonists. In: LiverTox: Clinical and Research Information on Drug-Induced Liver Injury [Internet]. Bethesda (MD): National Institute of Diabetes and Digestive and Kidney Diseases; 2012 [cited 2022 Apr 27]. Available from: http://www.ncbi.nlm.nih.gov/books/NBK548642/
- Nakamura T, Fujii S, Hoshino J, Saito Y, Mizuno H, Saito Y, et al. Selective angiotensin receptor antagonism with valsartan decreases arterial stiffness independently of blood pressure lowering in hypertensive patients. Hypertens Res. 2005 Dec;28(12):937–43.
- Kjeldsen SE, Julius S, Mancia G, McInnes GT, Hua T, Weber MA, et al. Effects of valsartan compared to amlodipine on preventing type 2 diabetes in high-risk hypertensive patients: the VALUE trial. J Hypertens. 2006 Jul;24(7):1405–12.
- Heran BS, Wong MMY, Heran IK, Wright JM. Blood pressure lowering efficacy of angiotensin receptor blockers for primary hypertension. Cochrane Database Syst Rev. 2008 Oct 8;(4):CD003822.
- Black HR, Bailey J, Zappe D, Samuel R. Valsartan: more than a decade of experience. Drugs. 2009;69(17):2393–414.
- Krum H, Carson P, Farsang C, Maggioni AP, Glazer RD, Aknay N, et al. Effect of valsartan added to background ACE inhibitor therapy in patients with heart failure: results from Val-HeFT. Eur J Heart Fail. 2004 Dec;6(7):937–45.
- Burnier M. Angiotensin II type 1 receptor blockers. Circulation. 2001 Feb 13;103(6):904–12.
- Siragy HM. Angiotensin receptor blockers: how important is selectivity? American Journal of Hypertension. 2002 Nov 1;15(11):1006–14.
- Horiuchi M, Akishita M, Dzau VJ. Recent Progress in Angiotensin II Type 2 Receptor Research in the Cardiovascular System. Hypertension. 1999 Feb;33(2):613–21.
- Siddiqui N, Husain A, Chaudhry L, Alam MS, Mitra M, Bhasin PS. Pharmacological and Pharmaceutical Profile of Valsartan: A Review. Journal of Applied Pharmaceutical Science. :8.
- Julius S, Kjeldsen SE, Weber M, Brunner HR, Ekman S, Hansson L, et al. Outcomes in hypertensive patients at high cardiovascular risk treated with regimens based on valsartan or amlodipine: the VALUE randomised trial. Lancet. 2004 Jun 19;363(9426):2022–31.
- Julius S, Kjeldsen SE, Brunner H, Hansson L, Platt F, Ekman S, et al. VALUE trial: Long-term blood pressure trends in 13,449 patients with hypertension and high cardiovascular risk. Am J Hypertens. 2003 Jul;16(7):544–8.
- Schmieder RE, Kjeldsen SE, Julius S, McInnes GT, Zanchetti A, Hua TA, et al. Reduced incidence of new-onset atrial fibrillation with angiotensin II receptor blockade: the VALUE trial. J Hypertens. 2008 Mar;26(3):403–11.
- Julius S, Weber MA, Kjeldsen SE, McInnes GT, Zanchetti A, Brunner HR, et al. The Valsartan Antihypertensive Long-Term Use Evaluation (VALUE) trial: outcomes in patients receiving monotherapy. Hypertension. 2006 Sep;48(3):385–91.
- Malacco E, Varì N, Capuano V, Spagnuolo V, Borgnino C, Palatini P, et al. A randomized, double-blind, active-controlled, parallel-group comparison of valsartan and amlodipine in the treatment of isolated systolic hypertension in elderly patients: the Val-Syst study. Clin Ther. 2003 Nov;25(11):2765–80.
- Viberti G, Wheeldon NM, MicroAlbuminuria Reduction With VALsartan (MARVAL) Study Investigators. Microalbuminuria reduction with valsartan in patients with type 2 diabetes mellitus: a blood pressure-independent effect. Circulation. 2002 Aug 6;106(6):672–8.
- Julius S, Weber MA, Kjeldsen SE, McInnes GT, Zanchetti A, Brunner HR, et al. The Valsartan Antihypertensive Long-Term Use Evaluation (VALUE) Trial. Hypertension. 2006 Sep;48(3):385–91.
- Hollenberg NK, Parving HH, Viberti G, Remuzzi G, Ritter S, Zelenkofske S, et al. Albuminuria response to very high-dose valsartan in type 2 diabetes mellitus. J Hypertens. 2007 Sep;25(9):1921–6.
- Velazquez EJ, Pfeffer MA, McMurray JV, Maggioni AP, Rouleau JL, Van de Werf F, et al. VALsartan In Acute myocardial iNfarcTion (VALIANT) trial: baseline characteristics in context. Eur J Heart Fail. 2003 Aug;5(4):537–44.
- Pfeffer MA, McMurray JJ, Velazquez EJ, Rouleau JL, Køber L, Maggioni AP, Solomon SD, Swedberg K, Van de Werf F, White H, Leimberger JD, Henis M, Edwards S, Zelenkofske S, Sellers MA, Califf RM; Valsartan in Acute Myocardial Infarction Trial Investigators. Valsartan, captopril, or both in myocardial infarction complicated by heart failure, left ventricular dysfunction, or both. N Engl J Med. 2003 Nov 13;349(20):1893-906.
- Grassi G, Seravalle G, Quarti-Trevano F, Dell’oro R. Sympathetic activation in congestive heart failure: evidence, consequences and therapeutic implications. Curr Vasc Pharmacol. 2009 Apr;7(2):137–45.
- Anand IS, Latini R, Florea VG, Kuskowski MA, Rector T, Masson S, et al. C-reactive protein in heart failure: prognostic value and the effect of valsartan. Circulation. 2005 Sep 6;112(10):1428–34.
- Maggioni AP, Anand I, Gottlieb SO, Latini R, Tognoni G, Cohn JN; Val-HeFT Investigators (Valsartan Heart Failure Trial). Effects of valsartan on morbidity and mortality in patients with heart failure not receiving angiotensin-converting enzyme inhibitors. J Am Coll Cardiol. 2002 Oct 16;40(8):1414-21.
- Maggioni AP, Latini R, Carson PE, Singh SN, Barlera S, Glazer R, et al. Valsartan reduces the incidence of atrial fibrillation in patients with heart failure: results from the Valsartan Heart Failure Trial (Val-HeFT). Am Heart J. 2005 Mar;149(3):548–57.
- Webb RL, de Gasparo M. Role of the angiotensin II receptor blocker valsartan in heart failure. Exp Clin Cardiol. 2001 Winter;6(4):215-21. PMID: 20428262; PMCID: PMC2859003.
Related papers
La medicina tradizionale basa le sue scelte e soluzioni terapeutiche sulla dimostrazione della efficacia dei farmaci quale emerge dai risultati degli studi clinici controllati che selezionano le molecole più efficaci e dettano la strategia di impiego nei pazienti in cui si presume una maggiore efficacia. Nell’ambito di questa strategia di condotta è possibile identificare due [more info]
L’insostenibile leggerezza dell’essere, splendido romando di Milan Kundera, ha come tema principale la pesantezza esistenziale. Ogni persona vive una sola volta e non si ha mai la possibilità di valutare le proprie scelte, perciò diventa difficile capire se tutto ciò che si fa nella vita è giusto o sbagliato, perché non si ha modo di [more info]
Introduzione Le malattie cardiovascolari (CV) costituiscono una delle principali cause di mortalità in tutto il mondo. Secondo l’Organizzazione Mondiale della Sanità (OMS), nel 2019 circa il 32% delle morti globali è stato attribuito a malattie cardiovascolari (1). Tra queste, ruolo predominante gioca la malattia coronarica aterosclerotica, la quale rappresenta la prima causa di mortalità e [more info]