1. L’ipertensione arteriosa: eziopatologia e focus sul sistema adrenergico
L’ipertensione arteriosa viene definita come la rilevazione di una pressione arteriosa sistolica (SBP) > 140mmHg e/o diastolica >90mmHg (DBP) (1). Sulla base delle multifattoriali origini eziopatologiche dell’ipertensione arteriosa si distingue generalmente fra ipertensione primitiva e secondaria. Quest’ultima, trova origine in condizioni mediche preesistenti come stenosi dell’arteria renale o iperaldosteronismo primitivo; in questo caso, il trattamento è mirato all’eliminazione della causa di ipertensione sottostante (2). L’ipertensione primitiva (o essenziale), invece, solitamente origina da un errato stile di vita e/o predisposizioni genetiche e rappresenta il 90-95% di tutti i casi di ipertensione diagnosticati: essa viene quindi trattata tramite modifiche dello stile di vita e l’assunzione di farmaci antipertensivi, qualora necessario.
Tra i vari fattori coinvolti nell’insorgenza dell’ipertensione, è importante citare obesità, stress e eccessiva assunzione di alcol e sale, che concorrono ad alterazioni dei sistemi di ritenzione e escrezione del sodio, disfunzione endoteliale e attivazione del sistema nervoso simpatico (SNS) e del tono adrenergico (3). L’attivazione del SNS, mediata da elevati livelli di catecolamine circolanti, porta infatti ad un incremento sia della frequenza e contrattilità cardiaca sia della funzionalità del RAAS (Sistema renina-angiotensina-aldosterone) causando quindi ritenzione di acqua e sodio e vasocostrizione periferica (3).
Le principali catecolamine coinvolte nell’attivazione del tono adrenergico sono i neurotrasmettitori adrenalina e noradrenalina, che esercitano il loro effetto legandosi a specifici recettori adrenergici di superficie, suddivisi in e β4). In particolare, l’attivazione dei recettori β1 adrenergici, localizzati nei vasi sanguigni periferici, porta alla loro costrizione. Allo stesso modo, l’attivazione del recettore β2, localizzato principalmente nella muscolatura liscia bronchiale e dei grandi vasi periferici, conduce a contrazione muscolare e conseguente costrizione bronchiale e vasale (4). Il recettore β3, invece, risulta essere principalmente localizzato nel tessuto adiposo, dove sembra svolgere il ruolo di attivazione di lipasi che agiscono sui trigliceridi di deposito (5).
Il muscolo cardiaco esprime tutti e 3 i recettori appartenenti alla famiglia dei recettori β-adrenergici, che rivestono il ruolo di regolazione della frequenza e della contrattilità cardiaca in risposta ad adrenalina e noradrenalina; tuttavia, il recettore β-adrenergico con una selettiva predominanza nel muscolo cardiaco risulta essere il β1 (6).
Riassumendo, l’attivazione dei recettori adrenergici comporta una varietà di effetti cardiovascolari come un’azione ionotropa, cronotropa e lusitropa positiva a livello del muscolo cardiaco (aumento della contrattilità, frequenza e velocità di rilassamento) e una costrizione dei vasi periferici, che concorrono certamente all’eziopatogenesi e al mantenimento dell’ipertensione arteriosa.
Tuttavia, il sistema adrenergico non è il solo contribuente al tono e alla costrizione vascolare; infatti, l’endotelio stesso è in grado di produrre, in risposta a stimoli fisiologici o patologici, una serie di mediatori vasocostrittori o dilatatori. Fra questi ultimi, è utile ricordare in particolar modo l’ossido nitrico (NO) che gioca un ruolo principale nella regolazione del tono vascolare e della pressione arteriosa.
2. Farmaci antipertensivi: classe dei β-bloccanti
I β-bloccanti sono una classe di farmaci utilizzata da più di 30 anni nella terapia antipertensiva (7). Nonostante siano accomunati dal meccanismo d’azione, in quanto antagonisti di recettori adrenergici, le molecole appartenenti a questa classe si differenziano marcatamente per diversi parametri che impattano sull’effetto clinico: il profilo di selettività d’azione per β1 e β2, l’eventuale attività simpaticomimetica intrinseca, il differente grado di solubilità che influisce sull’assorbimento a livello del sistema nervoso centrale, il profilo farmacocinetico e proprietà aggiuntive di agonismo inverso o di vasodilatazione (7).
Esistono 3 generazioni di farmaci β-bloccanti, col tempo introdotte nella pratica clinica (7). La prima generazione include molecole che non presentano un’affinità selettiva per β1 o β2; di conseguenza, a causa dell’azione antagonizzante su β2 a livello periferico, l’utilizzo di questa generazione di farmaci causa comuni e rilevanti effetti collaterali come il broncospasmo, la vasocostrizione periferica (causa di sensazione di arti freddi e disfunzione erettile) e l’aumento di peso (dovuto all’antagonismo dei recettori β2 a livello del pancreas) (6,7). Gli effetti collaterali appena citati non solo incidono in modo rilevante sulla qualità della vita dei pazienti, ma sono anche alla base della controindicazione di questa generazione di β-bloccanti per il trattamento dell’ipertensione in pazienti con alterazioni metaboliche o asmatici. Dall’esigenza di evitare gli effetti collaterali dovuti dall’antagonismo dei recettori β2, mantenendo però l’azione antipertensiva a livello cardiaco data dal blocco dei recettori β1, sono nati i farmaci β-bloccanti di seconda generazione, caratterizzati da una selettività superiore (ma non assoluta) e dose-dipendente per il recettoreβ1 e quindi meglio tollerati, soprattutto nei pazienti respiratori o con patologie vascolari periferiche (7). La terza generazione di β-bloccanti, invece, è composta da molecole sia selettive sia non selettive per β1 che però possiedono proprietà addizionali (7) (come la capacità vasodilatatoria di stimolare la produzione di NO) che devono essere prese in considerazione per ottimizzare una terapia di tipo personalizzato.
Inoltre, come già accennato, alcuni farmaci β-bloccanti possiedono un’attività simpaticomimetica intrinseca (ISA), ovvero una residua capacità di stimolare l’attività basale dei β-recettori, agendo come agonisti parziali in assenza di catecolamine (7); questa caratteristica può diventare funzionale qualora fosse necessario limitare una condizione di eccessiva bradicardia a riposo.
Infine, alcune molecole appartenenti alla classe dei β-bloccanti, possono esercitare un meccanismo d’azione da agonista inverso (7): in questo caso, a differenza degli antagonisti competitivi che si sostituiscono al ligando endogeno, le molecole possono agire inibendo l’attività recettoriale basale anche in assenza di catecolamine.
Tutte le proprietà presentate, quindi, entrano in gioco nel definire il profilo di un β-bloccante, in un’ottica di terapia centrata sulle esigenze e caratteristiche cliniche del paziente. Da ricordare, infine, che secondo le linee guida europee, l’utilizzo dei β-bloccanti nel trattamento dell’ipertensione è particolarmente raccomandato in specifiche condizioni, come in presenza di una evidente ed eccessiva stimolazione simpatica.
3. METOPROLOLO
3.1 Indicazioni e posologia
Il Metoprololo, approvato a metà degli anni ’70 (8), è una molecola -bloccante di seconda generazione (Figura 1), cioè che agisce bloccando selettivamente i recettori 1 a livello cardiaco. Le indicazioni terapeutiche approvate per il Metoprololo sono per il trattamento di:
• Ipertensione arteriosa
• Angina pectoris
• Infarto miocardico conclamato o sospetto
• Turbe cardiache funzionali
• Trattamento profilattico dell’emicrania.
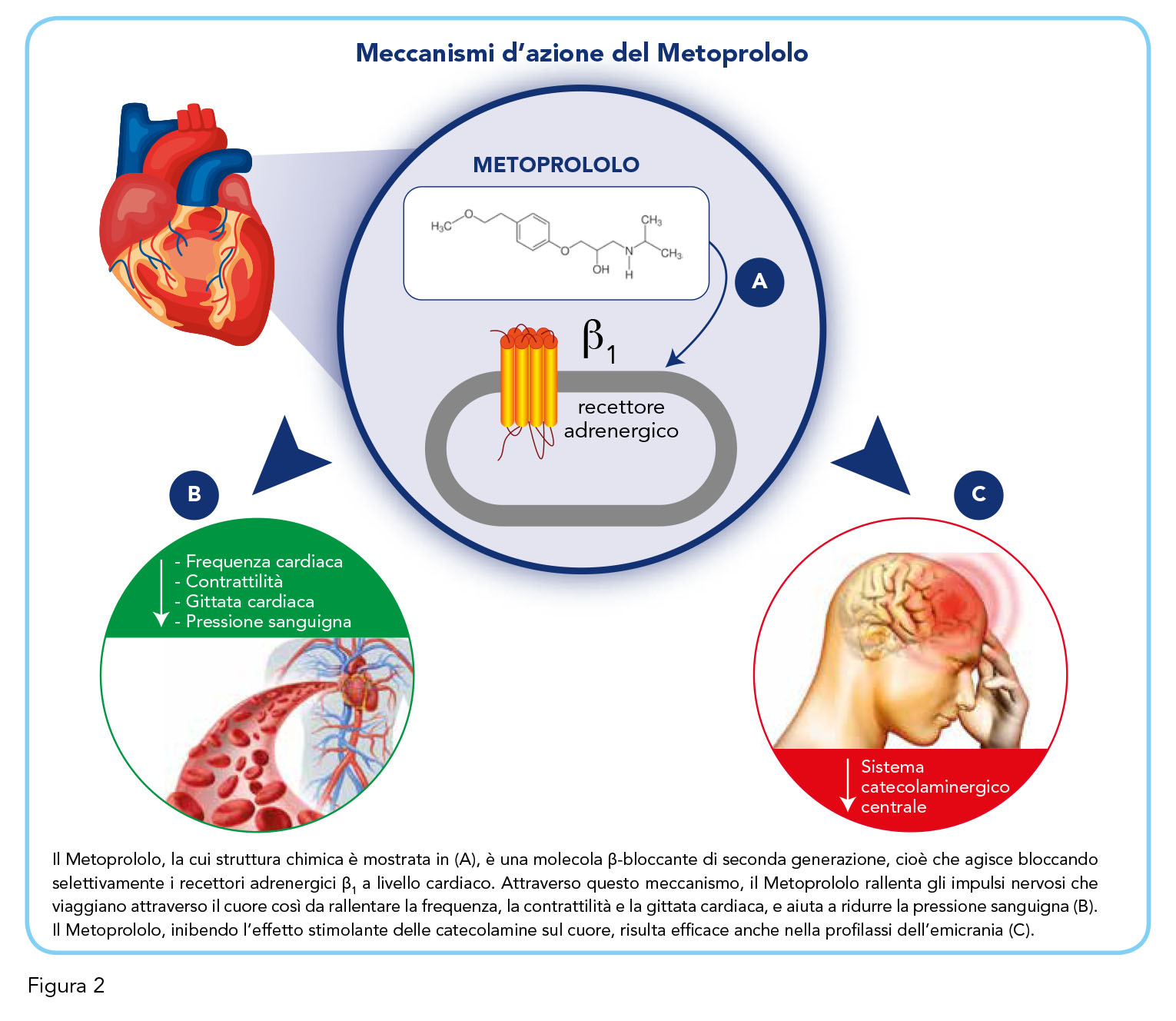
Bloccando gli effetti dell’adrenalina sui recettori β1, il Metoprololo rallenta gli impulsi nervosi che viaggiano attraverso il cuore così da rallentare la frequenza cardiaca e rilassare i vasi sanguigni. Riducendo l’attività del cuore, il Metoprololo aiuta, di conseguenza, a ridurre la pressione del sangue nei vasi sanguigni nel caso dell’ipertensione, a ridurre il dolore al petto nel caso dell’angina, a prevenire le aritmie, e può aiutare a proteggere il cuore dopo o in caso di sospetto infarto. Il Metoprololo viene inoltre prescritto nella profilassi delle emicranie perché l’azione β-bloccante induce il rilassamento della muscolatura liscia presente nella parete vasale, prevenendo gli attacchi del mal di testa.
Circa il trattamento dell’ipertensione arteriosa, il Metoprololo tartrato viene utilizzato sia da solo che associato ad altri farmaci antipertensivi, in particolare diuretici e/o un vasodilatatore periferico. La posologia prevede un dosaggio di 100-200 mg in somministrazione singola o in due dosi frazionate nell’arco della giornata, che sono particolarmente consigliate nei casi di dosaggi elevati per favorirne la tollerabilità. Nel caso del farmaco a rilascio prolungato, è sufficiente una somministrazione al mattino e, se necessario, può essere prescritto in associazione a un ulteriore antipertensivo. Nelle forme leggere di ipertensione può essere sufficiente metà dosaggio, sempre al mattino. L’utilizzo del Metoprololo è indicato nelle profilassi a lungo termine delle crisi anginose, o in somministrazione singola o in due dosi frazionate, da 100-200 mg al giorno, fino a 400 mg se necessario. Nel caso del farmaco a rilascio prolungato, si consiglia metà dose o un singolo dosaggio al mattino e, se necessario, tale somministrazione può essere ripetuta alla sera. Nel caso delle turbe del ritmo cardiaco si raccomandano da 100-150 mg fino a un massimo di 300 mg, frazionati in due o tre somministrazioni. Nel caso dell’infarto miocardico il dosaggio raccomandato può essere adattato sulla base dello stato emodinamico del paziente. La dose orale di mantenimento consigliata è di 200 mg al giorno in due dosi frazionate e il trattamento va continuato per almeno tre mesi (9). Nel caso delle turbe cardiache funzionali con palpitazioni, e nel caso della prevenzione dell’emicrania, la posologia raccomandata è di 100 mg al giorno in un’unica somministrazione al mattino, ma tale dosaggio può essere elevato a 200 mg somministrati in due dosi refratte (mattino e sera). Nel caso del farmaco a rilascio prolungato, si raccomanda o metà dose al mattino, o, se necessario, un dosaggio intero in somministrazione unica, sempre al mattino. I pazienti che non rispondono in modo soddisfacente al solo Metoprololo possono beneficiare di un trattamento aggiuntivo con una diversa classe di farmaci antipertensivi, antianginosi o antiaritmici. Il Metoprololo deve essere evitato nei pazienti con funzione cardiaca compromessa. Nei pazienti con malattia polmonare ostruttiva, diabete mellito instabile, malattia vascolare periferica e in anestesia generale, il Metoprololo deve essere somministrato con cautela e possibilmente a un dosaggio inferiore (10).
3.2 Meccanismo d’azione
Il Metoprololo è un antagonista cardioselettivo degli adrenorecettori β1, con effetto trascurabile sui recettori β2 a meno di alti dosaggi, che riduce o inibisce l’effetto stimolante delle catecolamine sul cuore (11). Il Metoprololo manca di attività stabilizzante di membrana e riduce la frequenza cardiaca da sforzo in misura maggiore rispetto ai β-bloccanti con attività simpaticomimetica intrinseca. Essendo un β-bloccante principalmente lipofilo, sembra essere quasi completamente assorbito dal tratto gastrointestinale quando assunto per via orale (10).
La somministrazione di Metoprololo provoca una riduzione della frequenza cardiaca, della contrattilità, della pressione sanguigna e della gittata cardiaca, sia a riposo che durante l’esercizio, negli individui sani. Questi effetti, che sembrano essere correlati alla dose e alla concentrazione del farmaco, sarebbero dovuti a una diminuzione dell’eccitabilità cardiaca e della domanda di ossigeno del miocardio attraverso il lavoro ridotto del cuore (11). La Figura 2 mostra una panoramica dei meccanismi d’azione del Metoprololo.
Nei soggetti con ipertensione primaria, il Metoprololo riduce rapidamente la pressione sanguigna sistolica, mentre una riduzione massima della pressione diastolica richiede diverse settimane di trattamento. Nel caso dell’angina pectoris, il Metoprololo riduce la frequenza e la gravità degli attacchi e aumenta la tolleranza allo sforzo. Nel caso dell’infarto miocardico conclamato o sospetto, il Metoprololo diminuisce la frequenza di gravi aritmie ventricolari e limita le dimensioni dell’infarto riducendo la mortalità oltre che l’incidenza di re-infarto e la mortalità nel post-infarto nei casi più gravi. Nel caso delle aritmie, il Metoprololo riduce la pendenza del potenziale pacemaker e sopprime la velocità della conduzione atrioventricolare. Tale azione antiaritmica è dovuta principalmente all’inibizione dell’automatismo del nodo seno-atriale e al prolungamento del tempo di conduzione atrioventricolare (11,12).
Inoltre, grazie al suo effetto sui sistemi monoaminergici centrali, il Metoprololo è in grado di ridurre la frequenza degli attacchi di mal di testa ed è quindi indicato per la prevenzione dell’emicrania. Il Metoprololo sembra anche non influire in misura maggiore sul glucosio nel sangue, così che l’ipoglicemia indotta dall’insulina non ne risulta né influenzata né mascherata. Infine, il Metoprololo sembra anche non influenzare il flusso sanguigno renale o epatico nei soggetti normali (10).
3.3 Farmacocinetica
Il metabolismo del Metoprololo è principalmente guidato dall’attività del CYP2D6 e in misura minore dall’attività del CYP3A4 (13). Tale metabolismo è rappresentato principalmente da reazioni di idrossilazione e O-demetilazione (14). Il Metoprololo somministrato per via orale viene quasi completamente assorbito dal tratto gastrointestinale, anche se il metabolismo epatico di primo passaggio riduce massicciamente la sua biodisponibilità sistemica di circa il 50% (15). La concentrazione sierica massima viene raggiunta 20 minuti dopo la somministrazione endovenosa e 1-2 ore dopo la somministrazione orale. Dopo somministrazione orale, circa il 95% di una dose viene escreta nelle urine entro 72 ore, principalmente come metaboliti inattivi, mentre la quantità di farmaco eliminata in forma non modificata è solitamente molto bassa (<5%). L’emivita di eliminazione è di circa 3-4 ore per il farmaco a rilascio non prolungato (10,11,16). Il tasso di assorbimento varia a seconda del tipo di formulazione del farmaco e la frazione disponibile a livello sistemico aumenta quando il Metoprololo viene assunto con cibo (17). Il Metoprololo non è altamente legato alle proteine plasmatiche e solo circa l’11% della dose somministrata si trova legato, principalmente, all’albumina del siero. A causa della sua natura lipofila e al basso legame alle proteine plasmatiche, il farmaco ha un grande volume di distribuzione (4,2-5,6 L/kg) e penetra facilmente nel sistema nervoso. Questa molecola, infatti, è in grado di attraversare la barriera ematoencefalica e circa il 78% del farmaco somministrato può essere trovato nel liquido cerebrospinale. Le formulazioni a lento rilascio di Metoprololo mantengono concentrazioni plasmatiche efficaci per 24 ore durante la somministrazione monodose giornaliera (9,10).
L’età sembra avere poca influenza sulla farmacocinetica del Metoprololo, ma durante la gravidanza la capacità di smaltimento dopo la somministrazione orale può aumentare. Il Metoprololo penetra liberamente nel latte materno ma, come conseguenza dell’escrezione renale e della moderata emivita, sembra presentare un rischio moderatamente basso di accumulo nei neonati (18). La capacità di smaltimento riportato nei pazienti con funzione renale normale è di 0,8 L/min. Nei pazienti cirrotici, la capacità di smaltimento passa a 0,61 L/min. Al contrario, sempre nei pazienti cirrotici, la disponibilità sistemica e l’emivita tendono ad aumentare, mentre la capacità di smaltimento totale tende a diminuire. Infine, è importante notare come il Metoprololo non si accumuli significativamente durante l’insufficienza renale, per cui risulta un trattamento consigliato. In generale, gli effetti farmacologici e terapeutici del Metoprololo sembrano essere legati alla dose (10,11).
3.4 Sicurezza e tollerabilità
Il Metoprololo si è rivelato essere un trattamento sicuro e ben tollerato nella maggior parte dei pazienti con ipertensione da lieve a moderata o con malattia ischemica. Il Metoprololo orale in dosaggi fino a 200 mg al giorno è ben tollerato in pazienti con insufficienza cardiaca cronica stabile da lieve a moderata. La maggior parte dei dati pubblicati sul Metoprololo riguardano l’uso della formulazione a rilascio immediato in pazienti con ipertensione. In questo caso il farmaco è stato associato alle seguenti categorie di eventi avversi: affaticamento/debolezza/letargia/malessere, capogiri/vertigini, mal di testa, diarrea, nausea/vomito, bradicardia, depressione, insonnia, prurito/dermatite, disturbi visivi e dispnea (9).
Per verificare la sicurezza e la tollerabilità nel caso dei pazienti con insufficienza cardiaca cronica, uno studio ha implementato il trattamento con Metoprololo a rilascio immediato, iniziato a bassi dosaggi (9). In seguito, i pazienti sono stati monitorati, durante la titolazione della dose, per gli eventi cardiovascolari avversi più comuni, come bradicardia, ipotensione, intensificazione del blocco atrioventricolare, blocco cardiaco completo e mancanza di respiro. Il dosaggio del farmaco è stato titolato per minimizzare gli eventi emodinamici iniziali avversi. La maggior parte dei pazienti (dal 75 al 100%) che ricevevano Metoprololo a rilascio immediato sono stati in grado di tollerare il dosaggio target prestabilito (da 100 a 200 mg al giorno) del farmaco. Il numero totale di interruzioni del trattamento è risultato essere simile nei gruppi di trattamento con Metoprololo a rilascio immediato e nei gruppi trattati con placebo (9).
Inoltre, il Metoprololo è controindicato nei pazienti con sindrome del seno malato, blocco cardiaco di secondo o terzo grado (in assenza di pacemaker), insufficienza cardiaca scompensata, ipotensione e ipersensibilità documentata al farmaco o sue componenti. In aggiunta, si raccomanda cautela con i pazienti con una storia di non conformità perché la brusca cessazione del farmaco può portare a sindromi da astinenza, tra cui angina e infarto miocardico (11). Infine, nonostante non vi siano evidenze di effetti collaterali dell’utilizzo del Metoprololo in gravidanza o durante l’allattamento (18), è sempre raccomandabile non utilizzarli nel primo trimestre di gravidanza e di prescriverli, in generale, solo se strettamente necessario.
3.5 Studi clinici più rilevanti
• Lo studio MAPHY (1991) (19): Il Metoprololo riduce significativamente la morte cardiaca improvvisa e l’infarto miocardico in pazienti ipertesi
Lo studio MAPHY (Metoprolol Atherosclerosis Prevention in Hypertensives) (19) mirava ad analizzare se il Metoprololo, somministrato a N = 1.609 come trattamento antipertensivo iniziale, prevenisse gli eventi coronarici – morte improvvisa e infarto miocardico – più efficacemente dei diuretici tiazidici (N = 1.625) negli uomini (40-64 anni) con pressione diastolica non trattata superiore a 100 mmHg (i.e. ipertensione).
I risultati di questo studio hanno mostrato come il rischio di eventi coronarici fosse significativamente più basso nei pazienti trattati con Metoprololo rispetto ai pazienti trattati con diuretici. Nello specifico, è risultato ridotto il rischio per gli eventi coronarici sintomatici che quello per gli infarti miocardici silenziosi. Poiché le caratteristiche di base, la pressione sanguigna durante il follow-up up e i tassi di ictus erano molto simili nei due gruppi di trattamento – Metoprololo e diuretici –, gli autori hanno suggerito che la differenza di rischio fosse dovuta probabilmente a meccanismi diversi dal controllo della pressione sanguigna. Tra questi, oltre all’effetto antipertensivo con cui un -bloccante può abbassare il rischio di eventi coronarici, sono da annoverare anche gli effetti cardiaci antischemici, gli effetti antifibrillatori, gli effetti antitrombotici e gli effetti antiaterosclerotici. Questa differenza nel tasso di rischio ha implicazioni potenzialmente importanti per la pratica clinica se si tiene conto dell’elevato numero di pazienti ipertesi che sono a maggior rischio di eventi coronarici. Inoltre, la mortalità totale e quella coronarica sono risultati significativamente inferiori nei fumatori trattati con Metoprololo rispetto a quelli trattati con diuretici. Questa riduzione del rischio nei fumatori potrebbe essere dovuta al fatto che il Metoprololo ha un effetto cardioselettivo. Nonostante ciò, comunque, il rischio di mortalità nei fumatori restava molto più alto che nei non fumatori, il che sottolinea l’importanza dell’incentivazione alle misure per aiutare i fumatori a smettere di fumare (19). Una recente metanalisi del 2016 ha confermato l’efficacia del Metoprololo rispetto al placebo e ad altri agenti antipertensivi, quali i diuretici, per quanto riguarda la riduzione del rischio di morte/ictus/infarto del miocardio nei soggetti ipertesi, in particolar modo quelli di età inferiore ai 60 anni. Gli autori suggeriscono quindi il Metoprololo come ragionevole scelta di terapia (20).
• Lo studio MERIT-HF (1999) (21): una dose giornaliera di Metoprololo, in aggiunta a terapia standard ottimale, riduce la mortalità nei pazienti con insufficienza cardiaca anche in regime di dosaggio individualizzato
Lo studio MERIT-HF (Metoprolol CR/XL Randomized Intervention Trial in Chronic Heart Failure) (21) ha analizzato l’effetto del Metoprololo a rilascio prolungato sulla mortalità nei pazienti con diminuzione della frazione di eiezione e sintomi di insufficienza cardiaca cronica. Attraverso uno studio randomizzato in doppio cieco, a circa duemila pazienti è stato somministrato Metoprololo e a circa duemila pazienti è stato somministrato un placebo. La somministrazione iniziava da un dosaggio relativamente basso e la dose giornaliera target raggiunta era di 200 mg. Le dosi sono state aumentate nell’arco di otto settimane e il tempo medio di follow-up è stato di un anno. Tutti i pazienti erano già clinicamente stabilizzati attraverso una terapia standard ottimale, costituita principalmente da ACE-inibitori e diuretici.
In generale, lo studio MERIT-HF ha messo in evidenza come la mortalità per tutte le cause fosse minore nel gruppo di pazienti che ha ricevuto la somministrazione di una dose giornaliera di Metoprololo rispetto ai pazienti che hanno ricevuto un placebo, in aggiunta al trattamento standard ottimale. Nello specifico, la somministrazione di Metoprololo, in aggiunta alla tradizionale terapia con ACE-inibitori e diuretici, ha avuto l’effetto di ridurre la mortalità cardiovascolare, ridurre le morti improvvise e ridurre le morti dovute al peggioramento dell’insufficienza cardiaca. Pertanto, il trattamento per un anno può prevenire il decesso. Poiché nei pazienti con insufficienza cardiaca cronica l’evidenza mostra che una parte sostanziale delle morti improvvise siano dovute alla fibrillazione ventricolare, i risultati di questo studio suggeriscono un effetto antifibrillatorio del Metoprololo. Questo effetto, causato dal blocco del recettore 1, potrebbe essere legato, secondo gli autori dello studio, all’attività autonomica, alla cinetica del recettore, all’equilibrio energetico miocardico, all’elettrofisiologia, alla disattivazione neuroendocrina, e al rimodellamento ventricolare. Inoltre, la pressione sanguigna sistolica è risultata essere ridotta meno dal Metoprololo che dal placebo, suggerendo anche un miglioramento della geometria e della funzione del ventricolo sinistro (21).
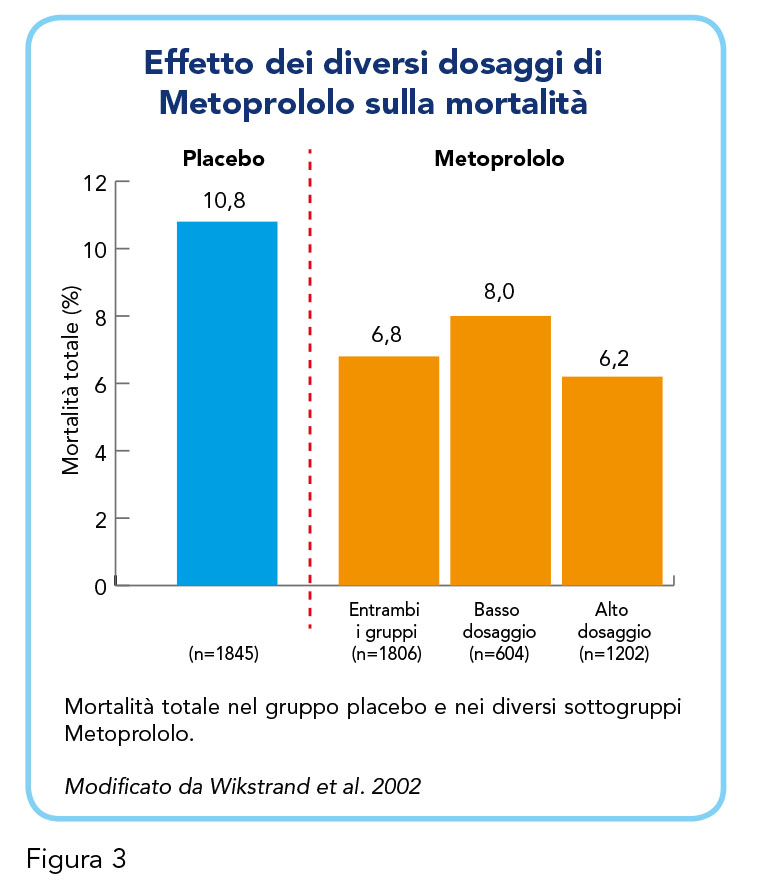
Successivamente, Wikstrand e colleghi, nel 2002, hanno svolto un’analisi post hoc sugli stessi dati divisi in due sottogruppi – dose bassa e dose alta – mettendo in evidenza un rischio di mortalità leggermente più alto nel gruppo a basso dosaggio rispetto a quello ad alto dosaggio. Poiché la frequenza cardiaca risultava essere ridotta in misura simile nei due gruppi, gli autori hanno interpretato questo dato come indicativo di una maggiore sensibilità per l’effetto da -bloccante nel gruppo a basso dosaggio. La riduzione della mortalità totale nei pazienti trattati con Metoprololo rispetto a quelli trattati con placebo era simile (Figura 3).
Da questa evidenza si può concludere che l’effetto -bloccante è quindi simile nei due dosaggi, suggerendo la possibilità concreta di adottare un regime di dosaggio individualizzato, guidato principalmente dalla tollerabilità del paziente e dalla risposta della sua frequenza cardiaca. Questi dati sono interessanti se si pensa che spesso i clinici si chiedono se i pazienti debbano raggiungere la dose target di -bloccanti prima di trarne beneficio (22). Infine, lo stesso gruppo di lavoro ha eseguito un’analisi più recente di questo studio in combinazione con altri trial clinici (23). Questo ulteriore approfondimento non solo ha confermato questi risultati, ma ha anche mostrato che l’efficacia e la tollerabilità del Metoprololo era simile a quella di altri -bloccanti (e.g. Bisoprololo) in pazienti con insufficienza cardiaca sistolica, mentre il Nebivololo era meno efficace e non meglio tollerato.
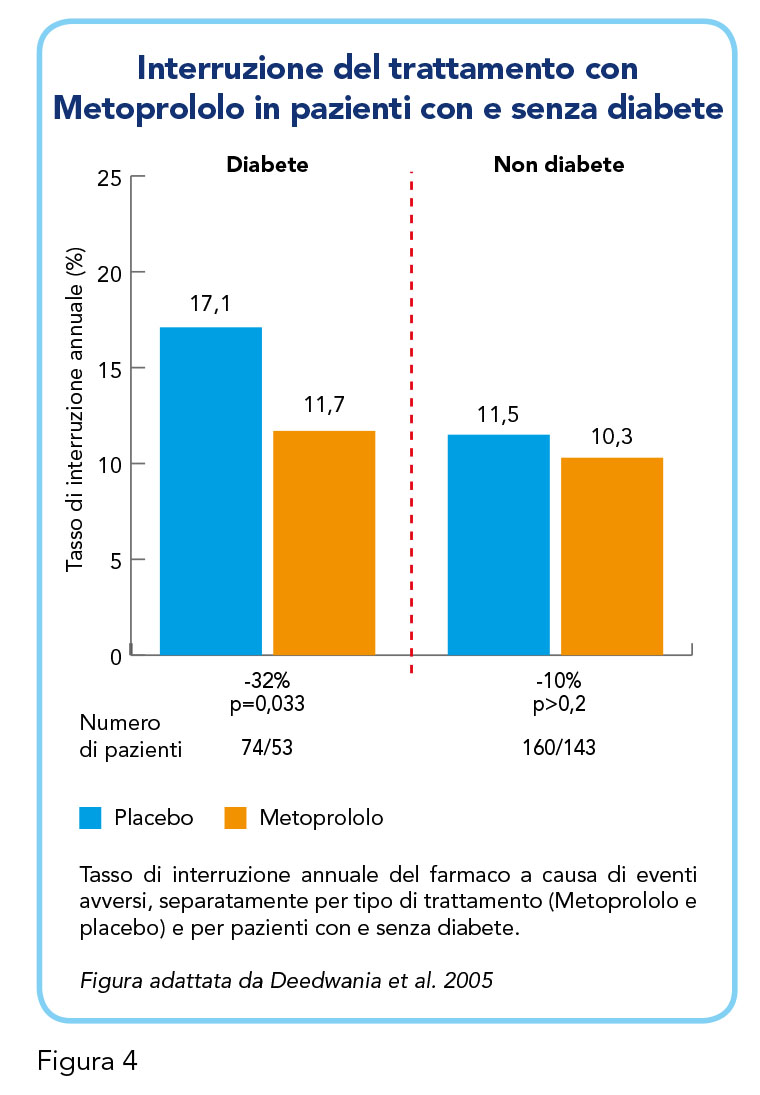
Nel 2005, anche Deedwania e colleghi hanno effettuato un’indagine di approfondimento sui pazienti del MERIT-HF (24), questa volta, allo scopo di esaminare l’efficacia e la tollerabilità del Metoprololo in pazienti con diabete. Innanzitutto, i pazienti con insufficienza cardiaca e diabete, rispetto ai pazienti con insufficienza cardiaca ma senza diabete, riportavano più spesso una storia di infarto miocardico, ipertensione e più grave insufficienza cardiaca, che si associava ad aumentato rischio di ospedalizzazione e mortalità. Nonostante la riduzione del rischio grazie al trattamento con Metoprololo fosse di eguale misura tra pazienti con e senza diabete, questo studio prova l’alta tollerabilità di questa molecola proprio nei pazienti con diabete (Figura 4).
• Il Metoprololo può esercitare il suo effetto profilattico nell’emicrania attraverso l’influenza sull’eccitabilità corticale e sull’elaborazione delle informazioni (25)
Questo recente studio (2007) (25) ha analizzato l’effetto del Metoprololo sull’emicrania attraverso l’analisi della variazione negativa contingente (CNV). Il CNV è un lento potenziale corticale evento-relato che si registra tipicamente, sullo scalpo, tra la presentazione di due stimoli, in soggetti in attesa del secondo evento e in preparazione per l’esecuzione del compito. Questo potenziale è legato al livello di eccitabilità corticale dopo l’attivazione del circuito striato-talamo-corticale e riflette diverse fasi di elaborazione delle informazioni. I pazienti con emicrania mostrano, caratteristicamente, ampiezze aumentate e ridotta assuefazione del CNV, soprattutto della sua componente iniziale. Il CNV può rappresentare l’anticipazione dell’attacco di mal di testa perché la sua ampiezza e l’assuefazione cambiano durante l’intervallo senza mal di testa. Di solito, infatti, alcuni giorni prima di un attacco di emicrania si rileva un aumento graduale di anomalie (25). Attraverso uno studio con disegno randomizzato in doppio cieco, gli autori hanno somministrato o del Metoprololo o un placebo a un gruppo di pazienti che soffriva di emicrania senza aura. Il trattamento ha avuto la durata di tre mesi. Durante il primo mese, il trattamento è iniziato con l’aumento graduale di 50 mg a settimana della dose di Metoprololo o di placebo. La dose massima di 200 mg è stata raggiunta nella quarta settimana di trattamento, in seguito alla quale il trattamento è durato due ulteriori mesi. Dopo il terzo mese del trattamento è stata eseguita una graduale diminuzione del dosaggio del Metoprololo (o placebo), anch’esso di 50 mg per settimana. Durante tutto il periodo di trattamento, incluso un periodo precedente, i pazienti hanno registrato su un diario alcuni parametri tra cui i giorni in cui si è verificato un attacco di emicrania, la durata dell’attacco di emicrania in ore, l’intensità del mal di testa, il dosaggio di tutti i farmaci assunti e gli effetti collaterali. La CNV è stata registrata sia all’inizio che alla fine del periodo precedente al trattamento, sia alla fine di ogni mese di trattamento, per un totale di cinque registrazioni per ciascun paziente. Come risultato, lo studio ha evidenziato, nei pazienti trattati con Metoprololo rispetto ai pazienti trattati con placebo, innanzitutto una riduzione significativa del numero dei giorni al mese con emicrania, dell’intensità degli attacchi di emicrania e della durata del mal di testa. In aggiunta, i dati neurofisiologici hanno mostrato una riduzione più pronunciata dell’ampiezza della CNV da sessione a sessione nei pazienti trattati con Metoprololo rispetto ai pazienti trattati con placebo. Anche l’assuefazione dell’ampiezza della CNV precoce è risultata essere aumentata significativamente da una sessione all’altra, e questo aumento era più pronunciato nel gruppo trattato con Metoprololo rispetto al gruppo trattato con placebo (Figura 5).
In conclusione, questo studio ha mostrato come l’efficacia del Metoprololo possa essere collegata ai cambiamenti nell’eccitabilità corticale e nell’elaborazione delle informazioni, e, di conseguenza, all’abilità del Metoprololo di modulare il sistema catecolaminergico centrale (25).
3.6 Conclusioni
I farmaci β-bloccanti sono inseriti nelle linee guida per il trattamento dell’ipertensione arteriosa. Nonostante siano accomunate dal meccanismo d’azione, in quanto antagonisti di recettori adrenergici, le molecole appartenenti a questa classe si differenziano marcatamente per alcuni parametri con ricadute sull’effetto clinico: il profilo di selettività d’azione per 1 e 2, l’eventuale attività simpaticomimetica intrinseca, il differente grado di solubilità che influisce sull’assorbimento a livello del sistema nervoso centrale, il profilo farmacocinetico e le proprietà aggiuntive di agonismo inverso o di vasodilatazione (7).
Nel corso delle ultime cinque decadi, numerosi studi, indagini di approfondimento e metanalisi su grosse coorti di pazienti, hanno evidenziato l’efficacia del Metoprololo, molecola di seconda generazione, nel trattamento di ipertensione, angina pectoris, infarto miocardico conclamato o sospetto e turbe cardiache funzionali. Il Metoprololo è un antagonista cardioselettivo degli adrenorecettori 1, con effetto trascurabile sui recettori 2 a meno di alti dosaggi, che riduce o inibisce l’effetto stimolante delle catecolamine sul cuore (11). Grazie a tale azione selettiva, il Metoprololo riduce l’attività del cuore aiutando, di conseguenza, a ridurre la pressione del sangue nei vasi sanguigni nel caso dell’ipertensione, a ridurre il dolore al petto nel caso dell’angina, a prevenire le aritmie, e a proteggere il cuore dopo o in caso di sospetto infarto. Diversi studi non solo hanno confermato l’efficacia del Metoprololo nell’insufficienza cardiaca, ma anche la sua elevata tollerabilità. Tale tollerabilità è estesa a pazienti con insufficienza renale e a popolazioni diabetiche. Il Metoprololo viene inoltre prescritto nella profilassi delle emicranie poiché l’azione -bloccante induce rilassamento della muscolatura liscia presente nella parete vasale. L’effetto sull’emicrania è stato anche indagato attraverso parametri neurofisiologici, suggerendo il coinvolgimento di un meccanismo capace di modulare il sistema catecolaminergico centrale.
Bibliografia
- Mancia G, Fagard R, Narkiewicz K, et al. The task force for the management ofarterial hypertension of the european society ofhypertension (esh) and of the european society of cardiology (esc). Journal of Hypertension. 2013;31(7):1281-1357. doi:10.1097/01.hjh.0000431740.32696.cc
- Taler SJ. Secondary Causes of Hypertension. Primary Care – Clinics in Office Practice. 2008;35(3):489-500. doi:10.1016/j.pop.2008.06.001
- Johnson RJ, Feig DI, Nakagawa T, Gabriela Sanchez-Lozada L, Rodriguez-Iturbe B, Cade JR. Pathogenesis of Essential Hypertension: Historical Paradigms and Modern Insights. Vol 26. Wolters Kluwer Health, Lippincott Williams & Wilkins; 2008.
- Triposkiadis F, Karayannis G, Giamouzis G, Skoularigis J, Louridas G, Butler J. The Sympathetic Nervous System in Heart Failure. Physiology, Pathophysiology, and Clinical Implications. Journal of the American College of Cardiology. 2009;54(19):1747-1762. doi:10.1016/j.jacc.2009.05.015
- Enocksson S, Shimizu M, Lönnqvist F, Nordenström J, Arner P. Demonstration of an in vivo functional 3-adrenoceptor in man. Journal of Clinical Investigation. 1995;95(5):2239-2245. doi:10.1172/JCI117914
- Pathak A, Mrabeti S. -Blockade for Patients with Hypertension, Ischemic Heart Disease or Heart Failure: Where are We Now? Vascular Health and Risk Management. 2021;17:337-348. doi:10.2147/VHRM.S285907
- Fumagalli C, Maurizi N, Marchionni N, Fornasari D. -blockers: Their new life from hypertension to cancer and migraine. Pharmacological Research. 2020;151. doi:10.1016/j.phrs.2019.104587
- Brogden RN, Heel RC, Speight TM, Avery GS. Metoprolol: A Review of its Pharmacological Properties and Therapeutic Efficacy in Hypertension and Angina Pectoris. Drugs 1977;14(5):321-348. doi:10.2165/00003495-197714050-00001
- Prakash A, Markham A. Metoprolol: A review of its use in chronic heart failure. Drugs. 2000;60(3):647-678. doi:10.2165/00003495-200060030-00011
- Benfield P, Clissold SP, Brogden RN, Yusuf S. Metoprolol An Updated Review of its Pharmacodynamic and Pharmacokinetic Properties, and Therapeutic Efficacy, in Hypertension, Ischaemic Heart Disease and Related Cardiovascular Disorders. Drugs. 1986;31:376-429.
- Morris J, Dunham A. Metoprolol. In: Treasure Island (FL): StatPearls Publishing; 2022 Jan 19.
- Grassi G. Metoprolol in the treatment of cardiovascular disease: a critical reappraisal. Current Medical Research and Opinion. 2018;34(9):1635-1643. doi:10.1080/03007995.2018.1479245
- Bahar MA, Kamp J, Borgsteede SD, Hak E, Wilffert B. The impact of CYP2D6 mediated drug–drug interaction: a systematic review on a combination of metoprolol and paroxetine/fluoxetine. British Journal of Clinical Pharmacology. 2018;84(12):2704-2715. doi:10.1111/bcp.13741
- Peikova L, Pencheva I, Tzvetkova B. Chemical Stability-Indicating HPLC Study of Fixed-Dosage Combination Containing Metoprolol Tartrate and Hydrochlorothiazide. Journal of Chemical and Pharmaceutical Research. 2013;5(7):132-140.
- Hocht C, Bertera FM, del Mauro JS, Santander Plantamura Y, Taira CA, Polizio AH. What is the Real Efficacy of Beta-Blockers for the Treatment of Essential Hypertension? Current Pharmaceutical Design. 2017;23(31). doi:10.2174/1381612823666170608085109
- Ripley TL, Saseen JJ. -Blockers: A Review of Their Pharmacological and Physiological Diversity in Hypertension. Annals of Pharmacotherapy. 2014;48(6):723-733. doi:10.1177/1060028013519591
- Regardh CG, Johnsson G. Clinical Pharmacokinetics of Metoprolol. Vol 5.; 1980.
- Drug Levels and Effects Summary of Use during Lactation. doi:10.1592/phco.31.10.311e
- Wikstrand J, Warnold I, Tuomilehto J, et al. Metoprolol Versus Thiazide Diuretics in Hypertension Morbidity Results From the MAPHY Study. Hypertension. 1991;17:579-588
- Cruickshank JM. The role of beta-blockers in the treatment of hypertension. In: Advances in Experimental Medicine and Biology. Vol 956. Springer New York LLC; 2017:149-166. doi:10.1007/5584_2016_36
- Hjalmarson A, Goldstein S, Fagerberg B, et al. Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERIT-HF). Lancet. 1999;353(9169):2001-2007. doi:10.1016/S0140-6736(99)04440-2
- Wikstrand J, Ke Hjalmarson A, Waagstein F, et al. Application of Beta-Blockers Dose of Metoprolol CR/XL and Clinical Outcomes in Patients With Heart Failure Analysis of the Experience in Metoprolol CR/XL Randomized Intervention Trial in Chronic Heart Failure (MERIT-HF).; 2002;40(3):491-498.
- Wikstrand J, Wedel H, Castagno D, Mcmurray JJV. The large-scale placebo-controlled beta-blocker studies in systolic heart failure revisited: Results from CIBIS-II, COPERNICUS and SENIORS-SHF compared with stratified subsets from MERIT-HF. Journal of Internal Medicine. 2014;275(2):134-143. doi:10.1111/joim.12141
- Deedwania PC, Giles TD, Klibaner M, et al. Efficacy, safety and tolerability of metoprolol CR/XL in patients with diabetes and chronic heart failure: Experiences from MERIT-HF. American Heart Journal. 2005;149(1):159-167. doi:10.1016/j.ahj.2004.05.056
- Siniatchkin M, Andrasik F, Kropp P, et al. Central mechanisms of controlled-release metoprolol in migraine: A double-blind, placebo-controlled study. Cephalalgia. 2007;27(9):1024-1032. doi:10.1111/j.1468-2982.2007.01377.x
Related papers
La medicina tradizionale basa le sue scelte e soluzioni terapeutiche sulla dimostrazione della efficacia dei farmaci quale emerge dai risultati degli studi clinici controllati che selezionano le molecole più efficaci e dettano la strategia di impiego nei pazienti in cui si presume una maggiore efficacia. Nell’ambito di questa strategia di condotta è possibile identificare due [more info]
L’insostenibile leggerezza dell’essere, splendido romando di Milan Kundera, ha come tema principale la pesantezza esistenziale. Ogni persona vive una sola volta e non si ha mai la possibilità di valutare le proprie scelte, perciò diventa difficile capire se tutto ciò che si fa nella vita è giusto o sbagliato, perché non si ha modo di [more info]
Introduzione Le malattie cardiovascolari (CV) costituiscono una delle principali cause di mortalità in tutto il mondo. Secondo l’Organizzazione Mondiale della Sanità (OMS), nel 2019 circa il 32% delle morti globali è stato attribuito a malattie cardiovascolari (1). Tra queste, ruolo predominante gioca la malattia coronarica aterosclerotica, la quale rappresenta la prima causa di mortalità e [more info]